Una reazione acido-base è una reazione in cui uno ione idrogeno, H+, viene trasferito da una specie chimica all'altra. Tali reazioni sono di importanza centrale per numerosi processi naturali e tecnologici, che vanno dalle trasformazioni chimiche all'interno di cellule o laghi e oceani alla produzione su scala industriale di fertilizzanti, prodotti farmaceutici e altre sostanze essenziali per la società.
Esistono diversi modi per definire un acido. Nel contesto delle soluzioni acquose, un acido è una sostanza che si dissolve per produrre ioni idrogeno.

Questa è la definizione arrhenius di acido, che prende il nome dal chimico svedese Svante Arrhenius (1859-1927). Uno ione idrogeno, rappresentato dal simbolo H+, è chiamato protone. In soluzione, i protoni si combinano chimicamente con molecole d'acqua, attraverso le coppie solitarie sull'ossigeno, per formare ioni di idronio, H3O+.
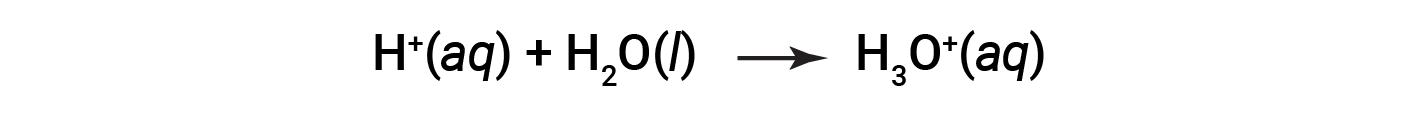
L'equazione chimica per la ionizzazione di un acido è scritta come

Gli acidi che reagiscono completamente con l'acqua in questo modo sono chiamati acidi forti. HCl, HNO3e HBr sono alcuni esempi.
La maggior parte degli acidi incontrati nella vita quotidiana sono acidi deboli. L'acido citrico nei frutti, l'acido acetico nell'aceto e l'acido lattico nel latte sono alcuni esempi. Un esempio familiare di acido debole è l'acido acetico, l'ingrediente principale nell'aceto alimentare. Quando vengono sciolte in acqua in condizioni tipiche, solo circa l'1% delle molecole di acido acetico sono presenti nella forma ionizzata, CH3CO2−.

L'uso di una doppia freccia nell'equazione precedente denota l'aspetto di reazione parziale di questo processo.
Una base è una sostanza che si dissolverà in acqua per produrre ioni idrossido, OH−. Le basi più comuni sono composti ionici composti da formazioni metalliche alcalini o alcaline di terra (gruppi 1 e 2) combinate con lo ione idrossido, ad esempio NaOH e Ca(OH)2. A differenza dei composti acidi discussi in precedenza, questi composti non reagiscono chimicamente con l'acqua; invece, si dissolvono e si dissociano, rilasciando ioni idrossido direttamente nella soluzione. Ad esempio, KOH e Ba(OH)2 si dissolvono in acqua e si dissociano completamente per produrre formazioni (rispettivamente K+ e Ba2+) e ioni idrossido, OH−. Queste basi, insieme ad altri idrossidi che si dissociano completamente in acqua, sono considerate basi forti.
Considera la dissoluzione dell'idrossido di sodio nell'acqua come esempio:

Questa equazione conferma che l'idrossido di sodio è una base. Quando viene sciolto in acqua, NaOH si dissocia per produrre ioni Na+ e OH −. Questo vale anche per qualsiasi altro composto ionico contenente ioni idrossido. Poiché il processo di dissociazione è essenzialmente completo quando i composti ionici si dissolvono in acqua in condizioni tipiche, naoh e altri idrossidi ionici sono tutti classificati come basi forti.
A differenza degli idrossidi ionici, alcuni composti producono ioni idrossido quando vengono sciolti reagendo chimicamente con molecole d'acqua. In tutti i casi, questi composti reagiscono solo parzialmente e quindi sono classificati come basi deboli. Questi tipi di composti sono anche abbondanti in natura e sono importanti materie prime in varie tecnologie. Ad esempio, la produzione globale dell'ammoniaca di base debole è in genere ben oltre le 100 tonnellate metriche all'anno perché è ampiamente utilizzata come fertilizzante agricolo, una materia prima per la sintesi chimica di altri composti e un principio attivo nei detergenti domestici. Quando viene sciolta in acqua, l'ammoniaca reagisce parzialmente alla produzione di ioni idrossido, come mostrato qui:

Questa è, per definizione, una reazione acido-base che comporta il trasferimento di ioni H+ da molecole d'acqua a molecole di ammoniaca. In condizioni tipiche, solo circa l'1% dell'ammoniaca disciolta è presente comeNH 4+ ioni.
Una reazione di neutralizzazione è un tipo specifico di reazione acido-base in cui i reagenti sono un acido e una base (ma non acqua), e i prodotti sono spesso sale e acqua:

Per illustrare una reazione di neutralizzazione, considera cosa succede quando un tipico antacido come il latte di magnesia (una sospensione acquosa di Mg solido(OH)2) viene ingerito per alleviare i sintomi associati all'eccesso di acido dello stomaco (HCl):

Si noti che, oltre all'acqua, questa reazione produce un sale, cloruro di magnesio. L'H+ (aq) dall'acido (forte o debole) si combina con l'OH− (aq) dalla base (o prodotto dalla reazione di una base debole con acqua) per formare H2O (l). Ad esempio, la reazione tra soluzioni acquose di HCl (acido forte) e NaOH (base forte) è scritta come segue:

Sia HCl che NaOH subiscono ionizzazione al 100%. L'equazione ionica completa, quindi, può essere scritta come:
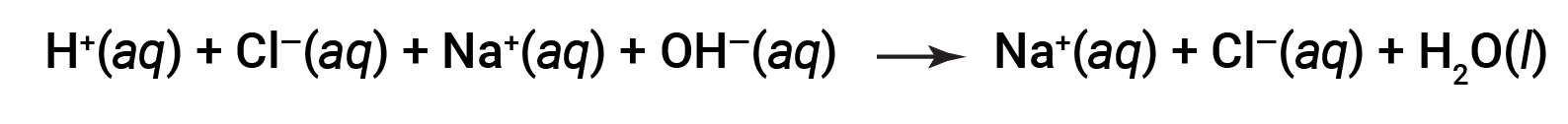
Cl- e Na+ sono chiamati ioni spettatore, che si annullano, dando l'equazione ionica netta come:
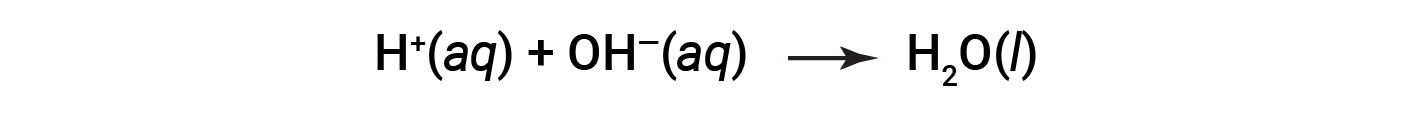
Questo testo è adattato da OpenStax Chemistry 2e, Sezione: 4.2: Classificare le reazioni chimiche.
Dal capitolo 4:

Now Playing
4.12 : Acidi, basi e reazioni di neutralizzazione
Quantità chimiche e reazioni acquose
54.0K Visualizzazioni

4.1 : Stechiometria di reazione
Quantità chimiche e reazioni acquose
62.7K Visualizzazioni

4.2 : Reagente limitante
Quantità chimiche e reazioni acquose
55.7K Visualizzazioni

4.3 : Resa di reazione
Quantità chimiche e reazioni acquose
46.6K Visualizzazioni

4.4 : Proprietà generali delle soluzioni
Quantità chimiche e reazioni acquose
29.7K Visualizzazioni

4.5 : Concentrazione e diluizione della soluzione
Quantità chimiche e reazioni acquose
83.0K Visualizzazioni

4.6 : Soluzioni elettrolitiche e non elettrolitiche
Quantità chimiche e reazioni acquose
61.5K Visualizzazioni

4.7 : Solubilità dei composti ionici
Quantità chimiche e reazioni acquose
61.4K Visualizzazioni

4.8 : Reazioni chimiche in soluzioni acquose
Quantità chimiche e reazioni acquose
58.6K Visualizzazioni

4.9 : Reazioni di precipitazione
Quantità chimiche e reazioni acquose
49.6K Visualizzazioni

4.10 : Reazioni di ossidazione-riduzione
Quantità chimiche e reazioni acquose
63.4K Visualizzazioni

4.11 : Numeri di ossidazione
Quantità chimiche e reazioni acquose
36.1K Visualizzazioni

4.13 : Reazioni di Sintesi e di decomposizione
Quantità chimiche e reazioni acquose
31.6K Visualizzazioni