11.7 : Transizioni di fase: vaporizzazione e condensazione
La forma fisica di una sostanza cambia cambiando la sua temperatura. Ad esempio, l'aumento della temperatura di un liquido fa vaporizzare il liquido (convertirlo in vapore). Il processo è chiamato vaporizzazione, un fenomeno superficiale. La vaporizzazione avviene quando il moto termico delle molecole supera le forze intermolecolari e le molecole (in superficie) fuorievengono nello stato gassoso. Quando un liquido vaporizza in un contenitore chiuso, le molecole di gas non possono fuoriuscire. Man mano che queste molecole di fase gassosa si muovono casualmente, occasionalmente collidono con la superficie della fase condensata, e in alcuni casi, queste collisioni faranno rientrare le molecole nella fase condensata. Il passaggio dalla fase gassosa al liquido è chiamato condensa.
La vaporizzazione è un processo endotermico. L'effetto rinfrescante è evidente dopo una nuotata o una doccia. Quando l'acqua sulla pelle evapora, rimuove il calore dalla pelle e raffredda la pelle. Il cambiamento di energia associato al processo di vaporizzazione è l'entalpia di vaporizzazione, ΔHvap. Ad esempio, la vaporizzazione dell'acqua a temperatura standard è rappresentata da:

Il contrario di un processo endotermico è esotermico. E così, la condensa di un gas rilascia calore:
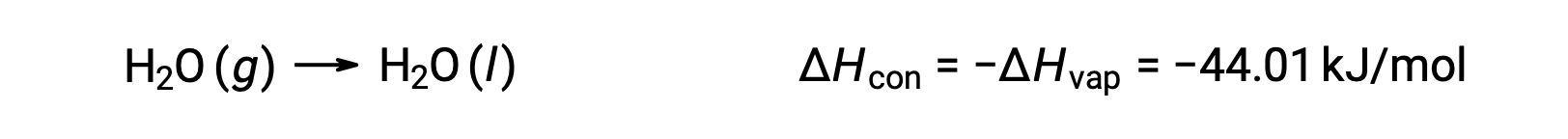
La vaporizzazione e la condensazione sono processi opposti; di conseguenza, i loro valori di entalpia sono identici ai segni opposti. Mentre l'entalpia della vaporizzazione è positiva, l'entalpia della condensa è negativa.
Diverse sostanze vaporizzano in misura diversa (a seconda dei punti di forza dei loro IMF) e quindi mostrano diverse entalpia di valori di vaporizzazione. Forze attrattive intermolecolari relativamente forti tra molecole si traducono in una maggiore entalpia di valori di vaporizzazione. Le deboli attrazioni intermolecolari presentano meno di una barriera alla vaporizzazione, producendo valori relativamente bassi di entalpie di vaporizzazione.
Questo testo è adattato da Openstax, Chemistry 2e, Sezione 10.3: Phase Transitions.
Dal capitolo 11:

Now Playing
11.7 : Transizioni di fase: vaporizzazione e condensazione
Liquidi, solidi e forze intermolecolari
17.0K Visualizzazioni

11.1 : Confronto molecolare di gas, liquidi e solidi
Liquidi, solidi e forze intermolecolari
40.2K Visualizzazioni

11.2 : Forze intermolecolari vs intramolecolari
Liquidi, solidi e forze intermolecolari
84.9K Visualizzazioni

11.3 : Forze intermolecolari
Liquidi, solidi e forze intermolecolari
56.3K Visualizzazioni

11.4 : Confronto delle forze intermolecolari: punto di fusione, punto di ebollizione e miscibilità
Liquidi, solidi e forze intermolecolari
43.6K Visualizzazioni

11.5 : Tensione superficiale, azione capillare e viscosità
Liquidi, solidi e forze intermolecolari
27.3K Visualizzazioni

11.6 : Transizioni di fase
Liquidi, solidi e forze intermolecolari
18.6K Visualizzazioni

11.8 : Pressione del vapore
Liquidi, solidi e forze intermolecolari
34.0K Visualizzazioni

11.9 : Equazione di Clausius-Clapeyron
Liquidi, solidi e forze intermolecolari
55.2K Visualizzazioni

11.10 : Transizioni di fase: fusione e congelamento
Liquidi, solidi e forze intermolecolari
12.2K Visualizzazioni

11.11 : Transizioni di fase: sublimazione e deposizione
Liquidi, solidi e forze intermolecolari
16.6K Visualizzazioni

11.12 : Curve di riscaldamento e raffreddamento
Liquidi, solidi e forze intermolecolari
22.3K Visualizzazioni

11.13 : Diagrammi di fase
Liquidi, solidi e forze intermolecolari
39.0K Visualizzazioni

11.14 : Strutture dei solidi
Liquidi, solidi e forze intermolecolari
13.6K Visualizzazioni

11.15 : Solidi molecolari e ionici
Liquidi, solidi e forze intermolecolari
16.6K Visualizzazioni
See More