12.8 : Abbassamento della pressione del vapore
La pressione di vapore di equilibrio di un liquido è la pressione esercitata dalla sua fase gassosa quando la vaporizzazione e la condensa si verificano a velocità uguali:
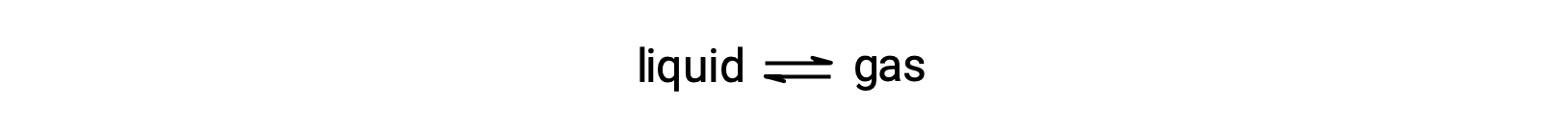
Sciogliere una sostanza non volatile in liquido volatile comporta un abbassamento della pressione di vapore del liquido. Questo fenomeno può essere spiegato considerando l'effetto delle molecole di soluto aggiunte sui processi di vaporizzazione e condensazione del liquido. Per vaporizzare, le molecole di solvente devono essere presenti sulla superficie della soluzione. La presenza di soluto diminuisce la superficie disponibile per le molecole di solvente e quindi riduce il tasso di vaporizzazione del solvente. Poiché la velocità di condensazione non è influenzata dalla presenza di soluto, il risultato netto è che l'equilibrio vaporizzazione-condensazione si ottiene con meno molecole di solvente nella fase di vapore (cioè ad una pressione di vapore inferiore).
Sebbene questa interpretazione sia utile, non tiene conto di diversi aspetti importanti della natura colligante dell'abbassamento della pressione di vapore. Una spiegazione più rigorosa coinvolge la proprietà dell'entropia. Ai fini della comprensione dell'abbassamento della pressione di vapore di un liquido, è sufficiente notare che la natura più dispersa della materia in una soluzione, rispetto alle fasi separate del solvente e del soluto, serve a stabilizzare efficacemente le molecole di solvente e a ostacolarne la vaporizzazione. Si traduce in una pressione di vapore inferiore e in un punto di ebollizione corrispondentemente più elevato.
La relazione tra le pressioni di vapore dei componenti della soluzione e le concentrazioni di tali componenti è descritta dalla legge di Raoult: La pressione parziale esercitata da qualsiasi componente di una soluzione ideale è uguale alla pressione di vapore del componente puro moltiplicata per la sua frazione talpa nella soluzione.
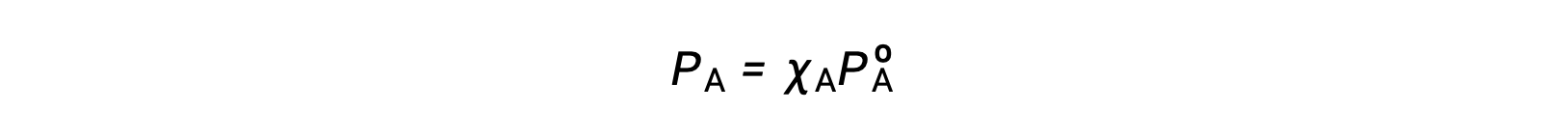
dove PA è la pressione parziale esercitata dal componente A nella soluzione, PºA è la pressione di vapore della A pura, e XAè la frazione talpa di A nella soluzione.
Ricordando che la pressione totale di una miscela gassosa è uguale alla somma delle pressioni parziali per tutti i suoi componenti (legge di Dalton delle pressioni parziali), la pressione totale di vapore esercitata da una soluzione contenente i componenti è
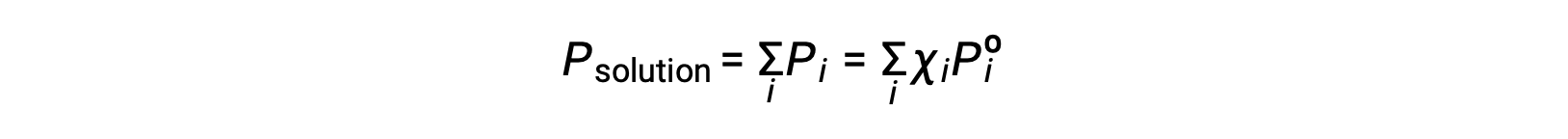
Una sostanza nonvolatile è una sostanza la cui pressione di vapore è trascurabile(Pº ≈ 0), e quindi la pressione di vapore sopra una soluzione contenente solo soluti non volontari è dovuta solo al solvente:
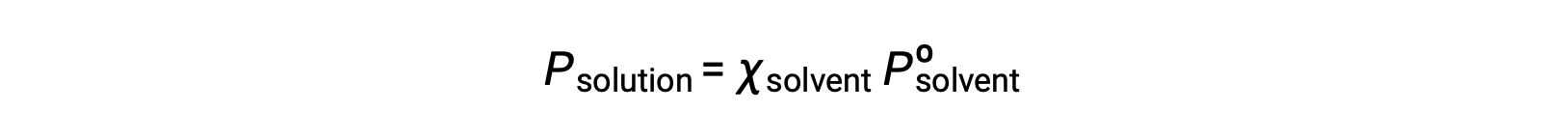
Questo testo è adattato da Openstax, Chimica 2e, Sezione 11.4: Proprietà Colligative.
Dal capitolo 12:

Now Playing
12.8 : Abbassamento della pressione del vapore
Soluzioni e colloidi
25.7K Visualizzazioni

12.1 : Formazione della soluzione
Soluzioni e colloidi
30.9K Visualizzazioni

12.2 : Forze intermolecolari nelle soluzioni
Soluzioni e colloidi
32.7K Visualizzazioni

12.3 : Entalpia della soluzione
Soluzioni e colloidi
24.5K Visualizzazioni

12.4 : Soluzioni acquose e calore di idratazione
Soluzioni e colloidi
14.2K Visualizzazioni

12.5 : Soluzione equilibrio e saturazione
Soluzioni e colloidi
18.2K Visualizzazioni

12.6 : Proprietà fisiche che influenzano la solubilità
Soluzioni e colloidi
22.2K Visualizzazioni

12.7 : Esprimere la concentrazione della soluzione
Soluzioni e colloidi
58.0K Visualizzazioni

12.9 : Soluzioni ideali
Soluzioni e colloidi
18.9K Visualizzazioni

12.10 : Depressione del punto di congelamento e elevazione del punto di ebollizione
Soluzioni e colloidi
33.8K Visualizzazioni

12.11 : Osmosi e pressione osmotica delle soluzioni
Soluzioni e colloidi
38.7K Visualizzazioni

12.12 : Elettroliti: fattore di van't Hoff
Soluzioni e colloidi
32.5K Visualizzazioni

12.13 : Colloidi
Soluzioni e colloidi
17.2K Visualizzazioni