Pochi composti agiscono come acidi forti. Un numero molto maggiore di composti si comporta come acidi deboli e reagisce solo parzialmente con l'acqua, lasciando una grande maggioranza di molecole disciolte nella loro forma originale e generando una quantità relativamente piccola di ioni di idronio. Gli acidi deboli si incontrano comunemente in natura, essendo le sostanze in parte responsabili del gusto piccante degli agrumi, della sensazione pungente delle punture di insetti e degli odori sgradevoli associati all'odore del corpo. Un esempio familiare di acido debole è l'acido acetico, l'ingrediente principale nell'aceto:
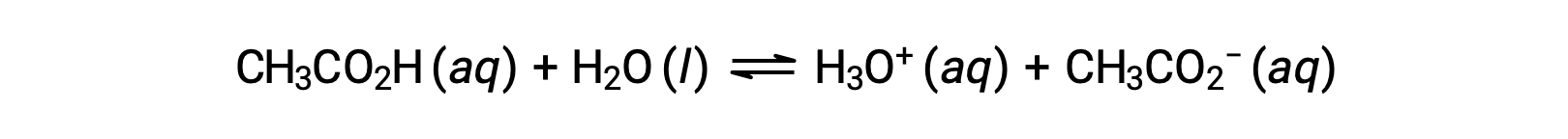
L'uso di una doppia freccia nell'equazione precedente denota l'aspetto di reazione parziale di questo processo. Quando vengono sciolte in acqua in condizioni tipiche, solo circa l'1% delle molecole di acido acetico sono presenti nella forma ionizzata, CH3COO−.
Calcolo delle concentrazioni di ioni idronio e del pH di una soluzione acida debole
L'acido formico, HCO2H, è un irritante che causa la reazione del corpo ad alcuni morsi e punture di formica. Qual è la concentrazione di ioni idronio e il pH di una soluzione di acido formico 0,534-M?
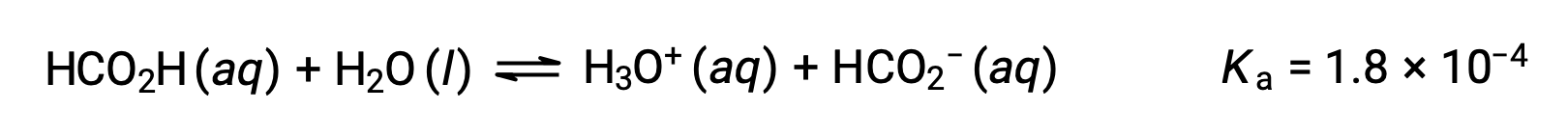
La tabella ICE per questo sistema è
| HCO2H (aq) | H3O+ (aq) | HCO2− (aq) | |
| Concentrazione iniziale (M) | 0.534 | ~0 | 0 |
| Variazione (M) | −x | +x | +x |
| Concentrazione di equilibrio (M) | 0,534 − x | X | X |
Sostituendo i termini di concentrazione di equilibrio nel Kun'espressione dà
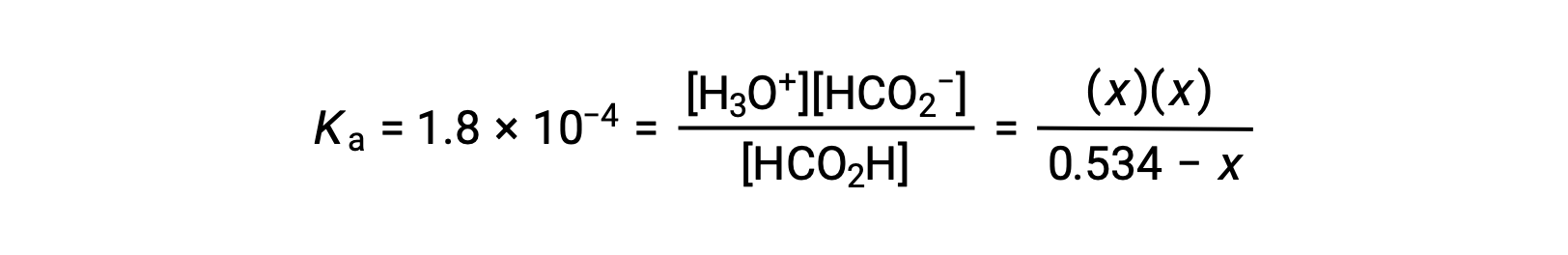
La concentrazione iniziale relativamente grande e la costante di piccolo equilibrio consentono di semplificare l'ipotesi che x sarà molto inferiore a 0,534, e quindi l'equazione diventa
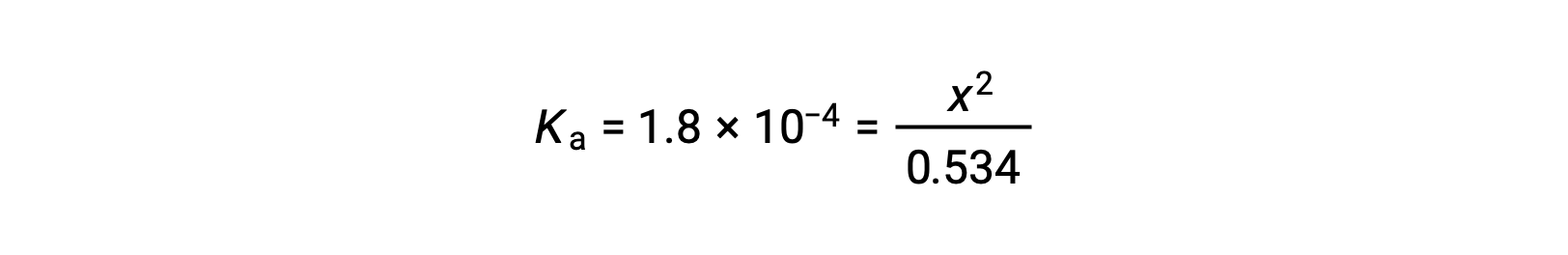
Risolvere l'equazione per i rendimenti x
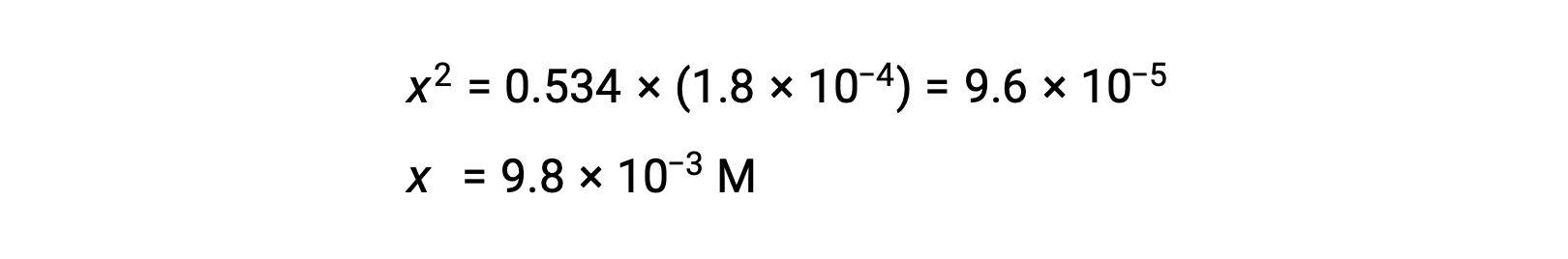
Per verificare l'ipotesi che x sia piccola rispetto a 0,534, la sua magnitudine relativa può essere stimata:
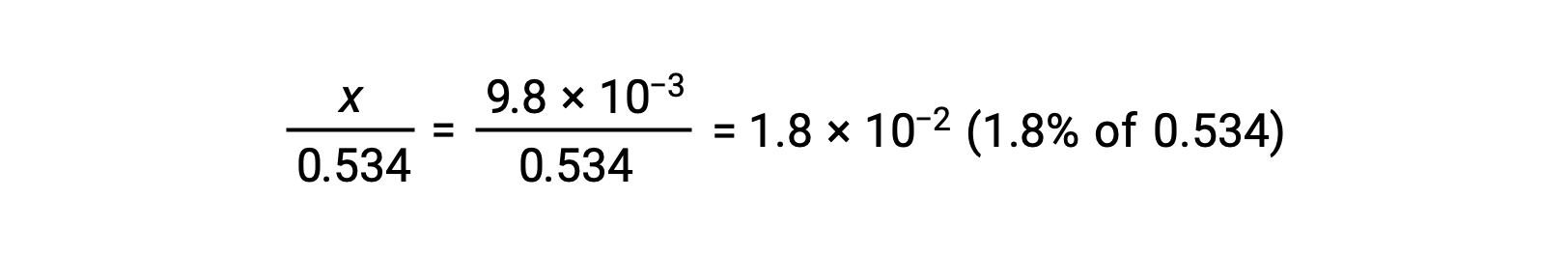
Poiché x è inferiore al 5% della concentrazione iniziale, l'ipotesi è valida. Come definito nella tabella ICE, x è uguale alla concentrazione di equilibrio dello ione idronio:
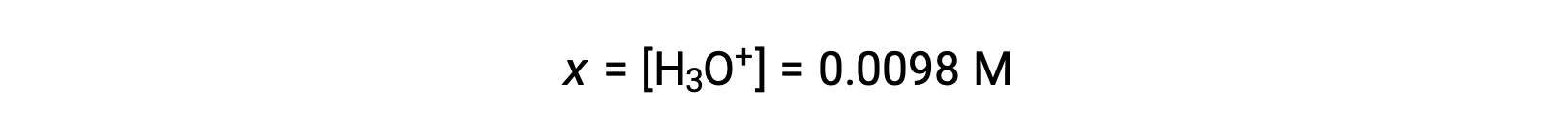
Infine, il pH è calcolato come
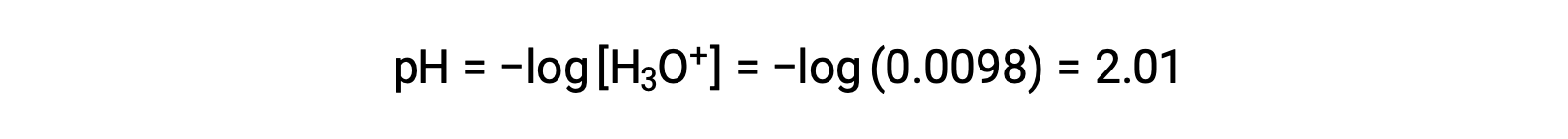
Determinazione di Ka da pH
Il pH di una soluzione di 0,0516 M di acido nitroso, HNO2, è 2,34. Qual è la sua Ka?
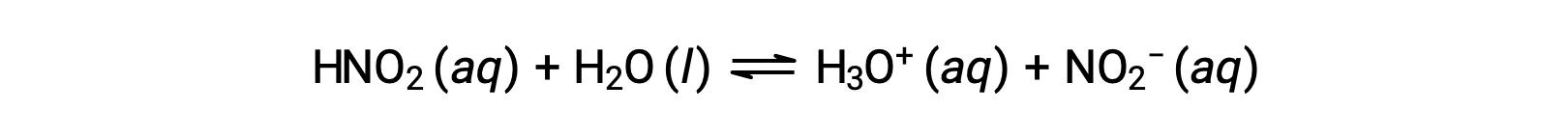
La concentrazione di acido nitroso fornita è una concentrazione formale, che non tiene conto degli equilibri chimici che possono essere stabiliti in soluzione. Tali concentrazioni sono trattate come valori "iniziali" per i calcoli di equilibrio utilizzando l'approccio della tabella ICE. Si noti che il valore iniziale dello ione idronio è elencato approssimativamente come zero perché è presente una piccola concentrazione di H3O+ (1 × 10−7 M) a causa dell'autoionizzazione dell'acqua. In molti casi, questa concentrazione è molto inferiore a quella generata dalla ionizzazione dell'acido (o base) in questione e può essere trascurata.
Il pH fornito è una misura logaritmica della concentrazione di ioni idronio risultante dalla ionizzazione acida dell'acido nitroso, e quindi rappresenta un valore di "equilibrio" per la tabella ICE:
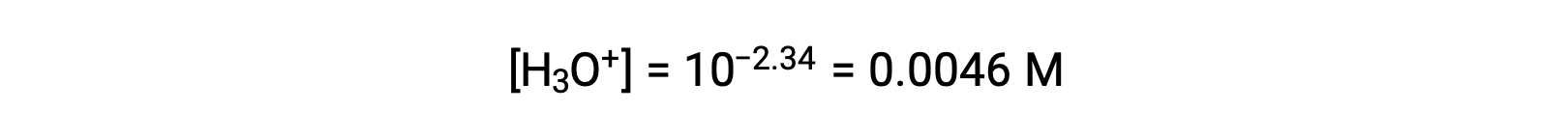
La tabella ICE per questo sistema è quindi
| HNO2 (aq) | H3O+ (aq) | NO2− (aq) | |
| Concentrazione iniziale (M) | 0.0516 | ~0 | 0 |
| Variazione (M) | -0,0046 | +0.0046 | +0.0046 |
| Concentrazione di equilibrio (M) | 0.0470 | 0.0046 | 0.0046 |
Infine, calcolare il valore della costante di equilibrio utilizzando i dati nella tabella:
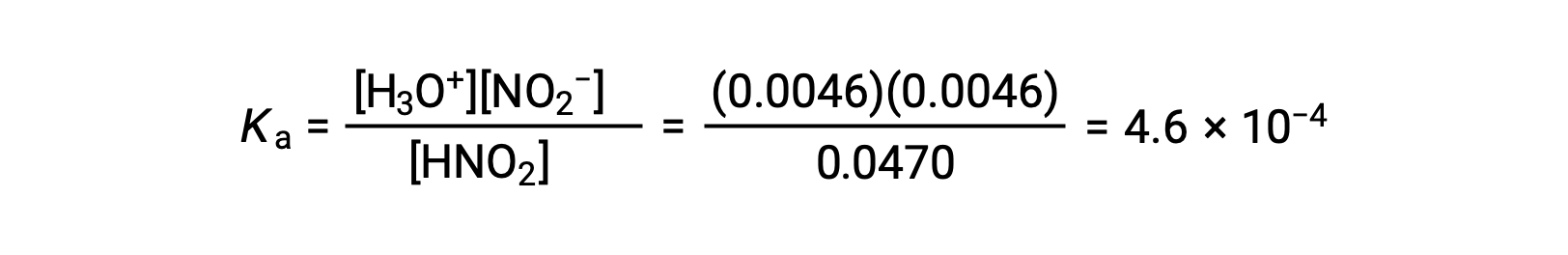
Questo testo è adattato da Openstax, Chimica 2e, Sezione 4.2: Classificazione delle reazioni chimiche e Openstax, Chimica 2e,14.3 Punti di forza relativi di acidi e basi.
Dal capitolo 15:

Now Playing
15.7 : Soluzioni di acidi deboli
Acidi e basi
36.9K Visualizzazioni

15.1 : Acidi e basi di Bronsted-Lowry
Acidi e basi
88.2K Visualizzazioni

15.2 : Forze acido / base e costanti di dissociazione
Acidi e basi
59.1K Visualizzazioni

15.3 : Acqua: un acido e una base Bronsted-Lowry
Acidi e basi
48.6K Visualizzazioni

15.4 : Scala del pH
Acidi e basi
66.8K Visualizzazioni

15.5 : Punti di forza relativi delle coppie coniugate acido-base
Acidi e basi
44.4K Visualizzazioni

15.6 : Soluzioni forti di acidi e basi
Acidi e basi
30.7K Visualizzazioni

15.8 : Soluzioni di basi deboli
Acidi e basi
22.0K Visualizzazioni

15.9 : Miscele di acidi
Acidi e basi
19.3K Visualizzazioni

15.10 : Ioni come acidi e basi
Acidi e basi
22.8K Visualizzazioni

15.11 : Determinazione del pH delle soluzioni saline
Acidi e basi
42.7K Visualizzazioni

15.12 : Acidi poliprotici
Acidi e basi
28.3K Visualizzazioni

15.13 : Forza acida e struttura molecolare
Acidi e basi
30.2K Visualizzazioni

15.14 : Acidi e Basi di Lewis
Acidi e basi
42.4K Visualizzazioni