Il pH di una soluzione contenente un acido può essere determinato usando la sua costante di dissociazione acida e la sua concentrazione iniziale. Se una soluzione contiene due acidi diversi, allora il suo pH può essere determinato usando uno dei diversi metodi a seconda della forza relativa degli acidi e delle loro costanti di dissociazione.
Una miscela di un acido forte e un acido debole
In una miscela di un acido forte e un acido debole, l'acido forte si dissocia completamente e diventa una fonte di quasi tutti gli ioni di idronio presenti nella soluzione. Al contrario, l'acido debole mostra una dissociazione parziale e produce una concentrazione trascurabile di ioni di idronio. L'alta concentrazione di ioni idronio prodotti dall'acido forte riduce ulteriormente la dissociazione dell'acido debole. Questo accade perché, secondo il principio di Le Chatelier - "Quando un sistema chimico in equilibrio è disturbato, il sistema si sposta in una direzione che riduce al minimo il disturbo". Gli ioni di idronio in eccesso prodotti dall'acido forte disturbano l'equilibrio, e quindi la reazione si muoverà nella direzione inversa fino a quando non viene stabilito l'equilibrio. Ciò porta ad una diminuzione della dissociazione dell'acido debole. A causa di questa diminuzione, un pH di una miscela di un acido forte e debole può essere calcolato solo dalla concentrazione dell'acido forte. Ad esempio, il pH di una miscela con una concentrazione uguale di acido cloridrico (HCl), un acido forte, e acido formico (HCHO2), un acido debole, può essere determinato solo dalla concentrazione di HCl. Se la concentrazione dell'HCl nella miscela è di 0,0020 M, il suo pH può essere calcolato come segue.
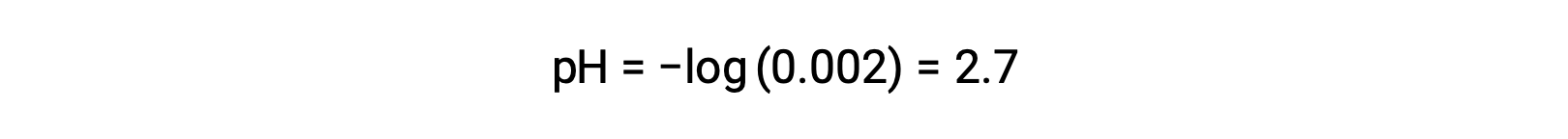
Qui, la concentrazione di ioni idronio prodotta da HCHO2 e l'autoionizzazione dell'acqua sono trascurabili e quindi possono essere ignorati.
Una miscela di due acidi deboli con diverse costanti di dissociazione
In una miscela di due acidi deboli, il pH di una miscela sarà determinato dall'acido più forte se la sua costante di dissociazione è significativamente superiore all'acido più debole. Ad esempio, in una miscela con una concentrazione uguale di acido nitroso (HNO2) e acido ipocloroso (HClO), l'HNO2 sarà il principale determinante del pH della miscela in quanto il suo Ka (4,6 × 10−4) è circa 10.000 volte superiore al Ka (2,9 × 10−8)di HClO. Secondo il principio di Le Chatelier, HClO mostra una diminuzione della dissociazione in presenza di HNO2.
Dal capitolo 15:

Now Playing
15.9 : Miscele di acidi
Acidi e basi
19.3K Visualizzazioni

15.1 : Acidi e basi di Bronsted-Lowry
Acidi e basi
88.1K Visualizzazioni

15.2 : Forze acido / base e costanti di dissociazione
Acidi e basi
59.1K Visualizzazioni

15.3 : Acqua: un acido e una base Bronsted-Lowry
Acidi e basi
48.6K Visualizzazioni

15.4 : Scala del pH
Acidi e basi
66.8K Visualizzazioni

15.5 : Punti di forza relativi delle coppie coniugate acido-base
Acidi e basi
44.4K Visualizzazioni

15.6 : Soluzioni forti di acidi e basi
Acidi e basi
30.6K Visualizzazioni

15.7 : Soluzioni di acidi deboli
Acidi e basi
36.9K Visualizzazioni

15.8 : Soluzioni di basi deboli
Acidi e basi
21.9K Visualizzazioni

15.10 : Ioni come acidi e basi
Acidi e basi
22.7K Visualizzazioni

15.11 : Determinazione del pH delle soluzioni saline
Acidi e basi
42.7K Visualizzazioni

15.12 : Acidi poliprotici
Acidi e basi
28.3K Visualizzazioni

15.13 : Forza acida e struttura molecolare
Acidi e basi
30.2K Visualizzazioni

15.14 : Acidi e Basi di Lewis
Acidi e basi
42.4K Visualizzazioni