In una cella galvanica, il lavoro elettrico viene eseguito da un sistema redox sull'ambiente circostante mentre gli elettroni prodotti dalle reazioni redox spontanee vengono trasferiti attraverso un circuito esterno. In alternativa, un circuito esterno funziona su un sistema redox imponendo una tensione sufficiente a guidare una reazione altrimenti nonpontanea in un processo noto come elettrolisi. Ad esempio, la ricarica di una batteria comporta l'uso di una fonte di alimentazione esterna per guidare la reazione cellulare spontanea (scarica) nella direzione inversa, ripristinando in una certa misura la composizione delle mezze celle e la tensione della batteria. Altri esempi includono l'uso dell'elettrolisi nel perfezionamento dei minerali metallici, la produzione di prodotti chimici di base e la galvanica di rivestimenti metallici su utensili, gioielli, ecc.
Prevedere il prodotto dell'elettrolisi
L'elettrolisi del cloruro di sodio fuso, NaCl (l), è utilizzata per la produzione industriale di sodio metallico, Na e gas cloro, Cl2. Gli ioni di sodio (Na+) sono ridotti in atomi al catodo, mentre gli ioni cloruro (Cl−) vengono ossidati in gas cloro, Cl2, all'anodo. Le reazioni redox sono:
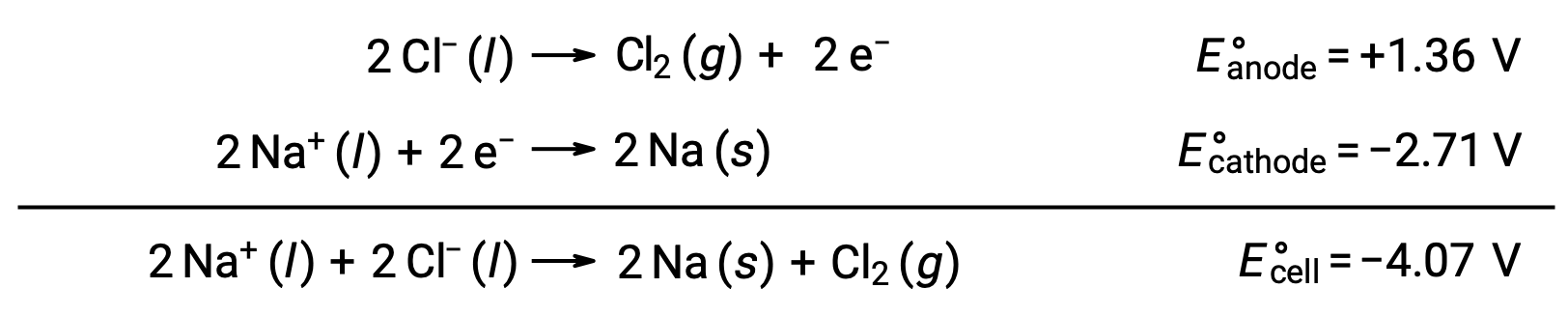
Il potenziale cellulare negativo indica una reazione non salina che deve essere guidata imponendo un potenziale positivo di magnitudine superiore a -4,07 V. L'elettrolisi del cloruro di sodio fuso viene effettuata ad un'alta temperatura di 801 °C quando i solidi ionici si sciolgono ad alte temperature.
L'elettrolisi dell'acqua produce quantità stechiometriche di gas ossigeno all'anodo e idrogeno al catodo. Per migliorare la conducibilità elettrica, la concentrazione di ioni idrogeno dell'acqua viene aumentata aggiungendo un acido forte. Le reazioni redox associate sono:
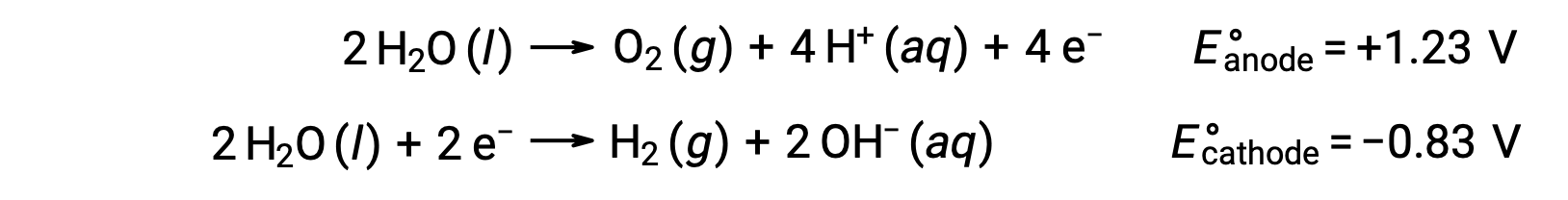
L'elettrolisi di soluzioni di composti ionici come il cloruro acquoso di sodio può comportare l'elettrolisi di specie d'acqua (H2O, H+, OH-) o di specie solute (catenamenti e anioni del composto) all'anodo e al catodo.
L'elettrolisi del cloruro acquoso di sodio potrebbe coinvolgere una di queste due reazioni anodica:
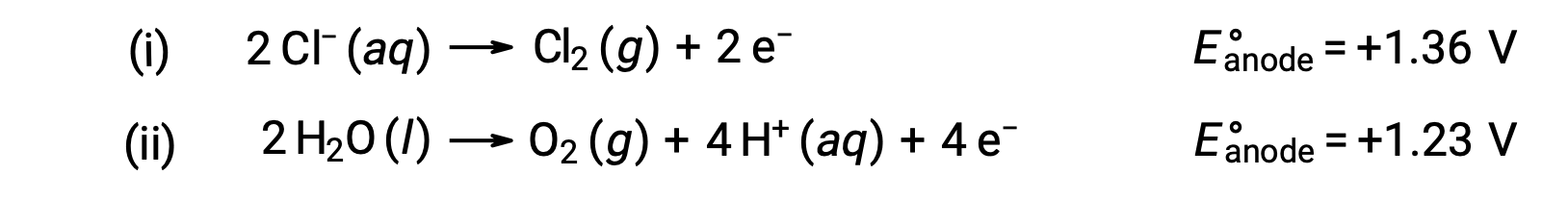
Termodinamicamente, l'acqua sarebbe più facilmente ossidata; tuttavia, in pratica, viene prodotto gas cloro. L'ossidazione dell'acqua richiederebbe una tensione molto più grande per iniziare. Per superare questa sovratensione, vengono scelti elettrodi e il potenziale della cellula viene attentamente monitorato per garantire che l'ossidazione degli ioni cloruro all'anodo.
Allo stesso modo, le possibili reazioni di riduzione al catodo sono:
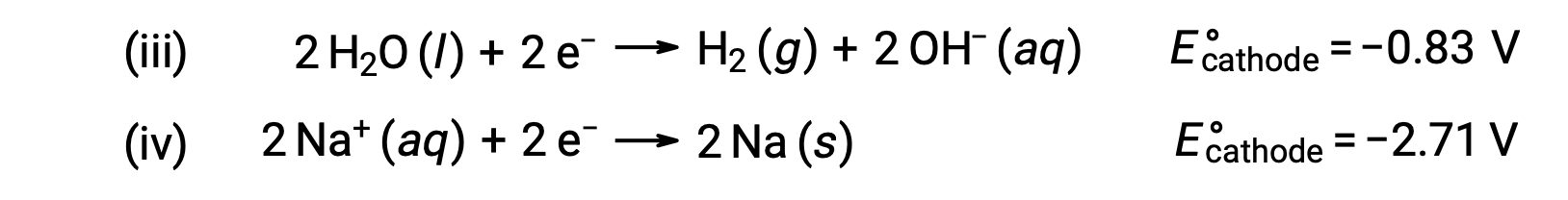
Confrontando questi potenziali standard di semireazione si suggerisce che la riduzione dell'acqua è termodinamicamente favorita. La reazione cellulare netta in questo caso è quindi:
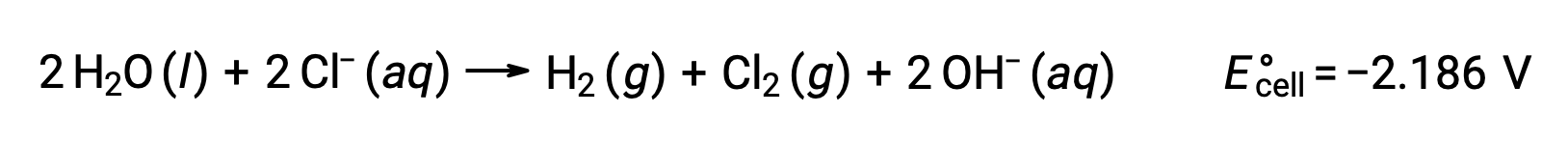
Aspetti quantitativi dell'elettrolisi
La corrente elettrica è la velocità di flusso degli elettroni ed è misurata in ampere, un coulomb al secondo (A = 1 C/s). La carica trasferita, Q, per passaggio di una corrente costante, I, su un intervallo di tempo specificato, t, è data da
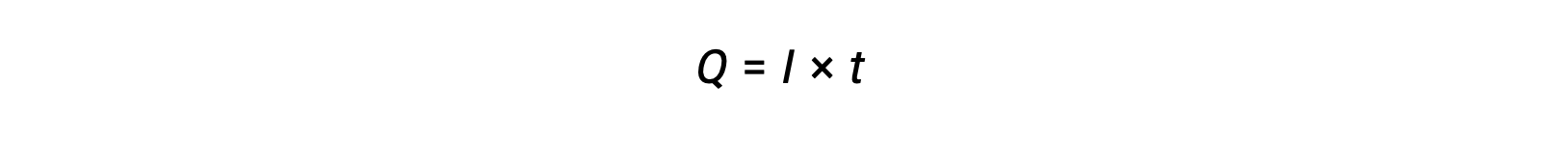
Quando gli elettroni vengono trasferiti durante un processo redox, la stechiometria della reazione può essere usata per ricavare la quantità totale di carica (elettronica) coinvolta. Ad esempio, il processo di riduzione generico,
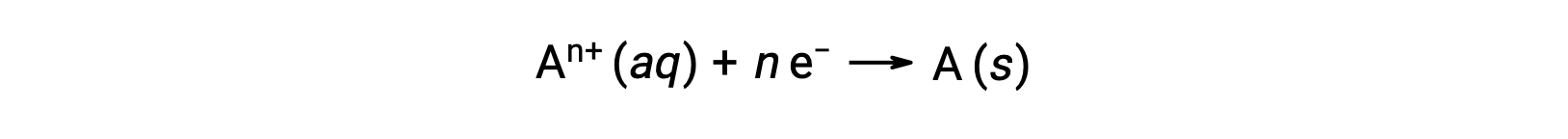
comporta il trasferimento di n mole di elettroni. L'addebito trasferito è, pertanto,
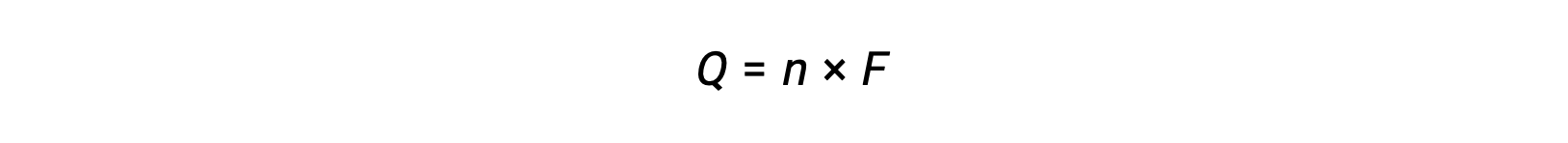
dove F è la costante di Faraday, la carica in coulombs per una talpa di elettroni. Per una cella elettrochimica, il flusso di corrente viene misurato e può essere utilizzato nei calcoli stechiometrici relativi alla reazione cellulare.
Questo testo è adattato da OpenStax, Chimica 2e, Sezione 17.7: Elettrolisi.
