Em uma célula galvânica, o trabalho elétrico é feito por um sistema redox nas suas imediações, à medida que os eletrões produzidos pelas reações redox espontâneas são transferidos através de um circuito externo. Em alternativa, um circuito externo funciona em um sistema redox, impondo uma voltagem suficiente para conduzir uma reação não espontânea em um processo conhecido como eletrólise. Por exemplo, o recarregamento de uma bateria envolve a utilização de uma fonte de alimentação externa para conduzir a reação espontânea (descarga) da célula na direção inversa, restaurando, em certa medida, a composição das semi-células e a voltagem da bateria. Outros exemplos incluem o uso de eletrólise no refinamento de minérios metálicos, na fabricação de químicos úteis, e a galvanoplastia de revestimentos metálicos sobre utensílios, jóias, etc.
Previsão do Produto da Eletrólise
A eletrólise do cloreto de sódio fundido, NaCl (l), é utilizada para a produção industrial de sódio metálico, Na, e gás cloro, Cl2. Os iões de sódio (Na+) são reduzidos para átomos no cátodo, enquanto que os iões de cloreto (Cl−) são oxidados para gás cloro, Cl2, no ânodo. As reações redox são:
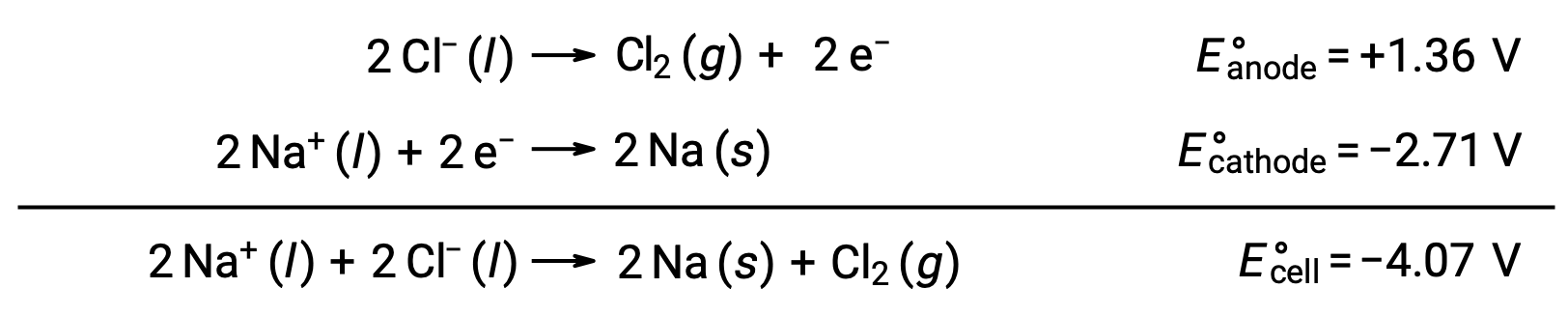
O potencial negativo da célula indica uma reação não espontânea que deve ser conduzida impondo um potencial positivo de magnitude maior que −4,07 V. A eletrólise do cloreto de sódio fundido é realizada a uma temperatura elevada de 801 °C, uma vez que os sólidos iónicos derretem a altas temperaturas.
A eletrólise da água produz quantidades estequiométricas de gás oxigénio no ânodo e de hidrogénio no cátodo. Para melhorar a condutividade elétrica, a concentração de hidrogénio iónico da água é aumentada adicionando um ácido forte. As reações redox associadas são:
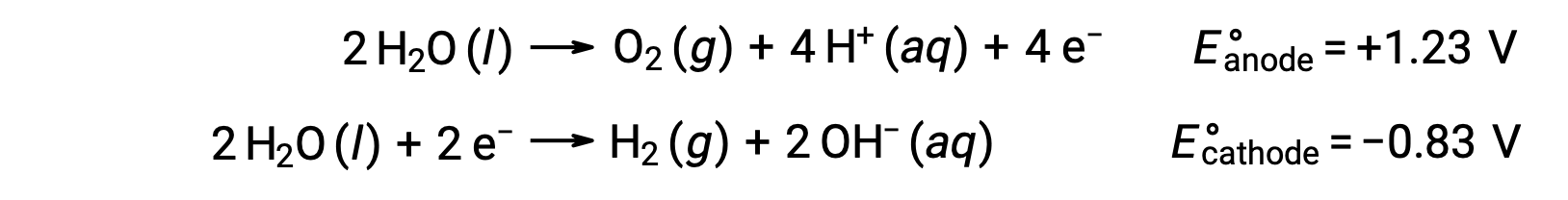
A eletrólise de soluções de compostos iónicos, como o cloreto de sódio aquoso, pode envolver a eletrólise de espécies da água (H2O, H+, OH-) ou de espécies de solutos (os catiões e aniões do composto) no ânodo e no cátodo.
A eletrólise do cloreto de sódio aquoso pode envolver qualquer uma destas duas reações anódicas:
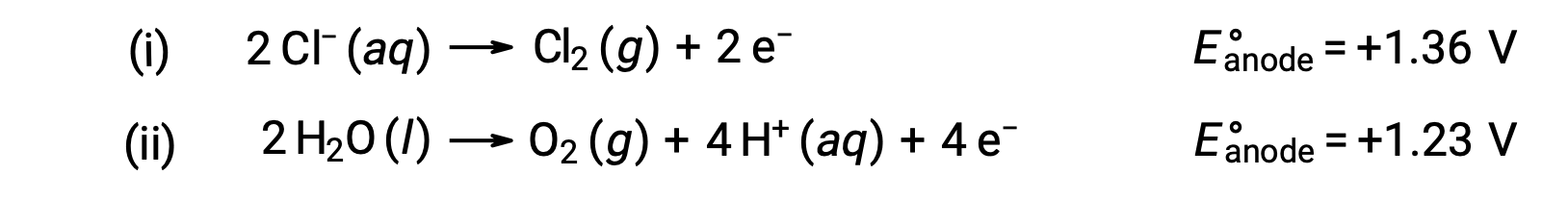
Termodinamicamente, a água seria mais prontamente oxidada; no entanto, na prática, o gás cloro é produzido. A oxidação da água exigiria uma voltagem muito maior para iniciar. Para ultrapassar esta sobrevoltagem, são escolhidos elétrodos e o potencial celular é cuidadosamente monitorizado para garantir a oxidação dos iões cloreto no ânodo.
Da mesma forma, as possíveis reações de redução no cátodo são:
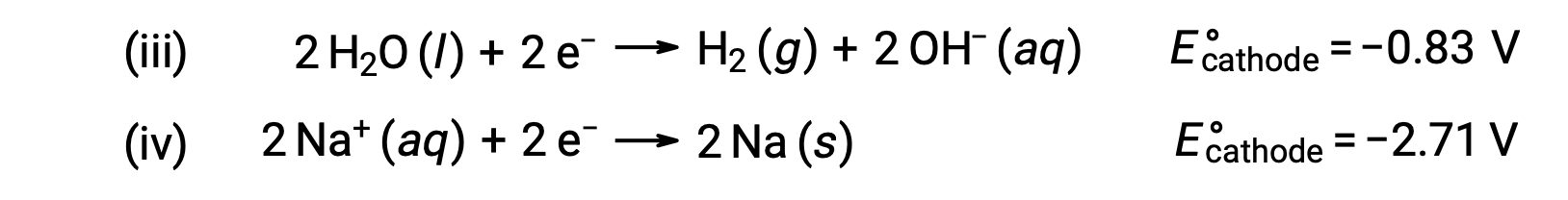
A comparação desses potenciais de semi-reação padrão sugere que a redução da água é termodinamicamente favorecida. Neste caso, a reação celular líquida é:
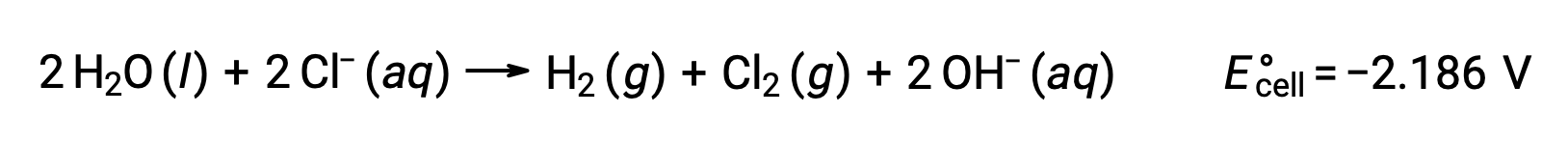
Aspetos Quantitativos da Eletrólise
A corrente elétrica é a velocidade do fluxo de eletrões e é medida em amperes, um coulomb por segundo (A = 1 C/s). A carga transferida, Q, por passagem de uma corrente constante, I, durante um intervalo de tempo especificado, t, é dada por
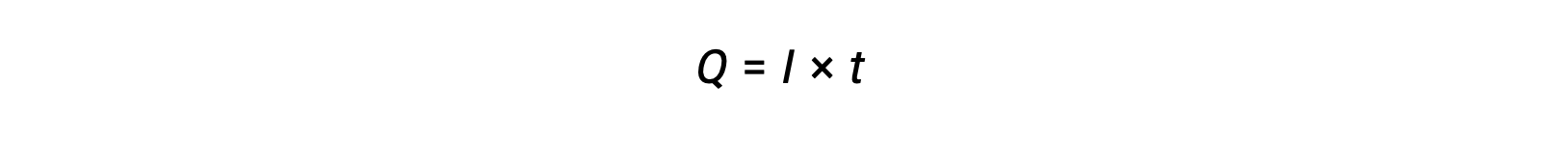
Quando os eletrões são transferidos durante um processo redox, a estequiometria da reação pode ser utilizada para obter a quantidade total de carga (eletrónica) envolvida. Por exemplo, o processo de redução genérico,
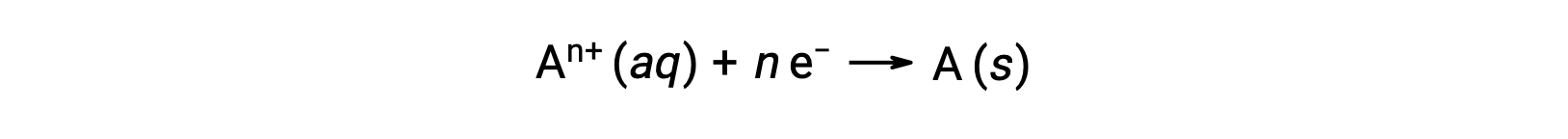
envolve a transferência de n moles de eletrões. A carga transferida é, portanto,
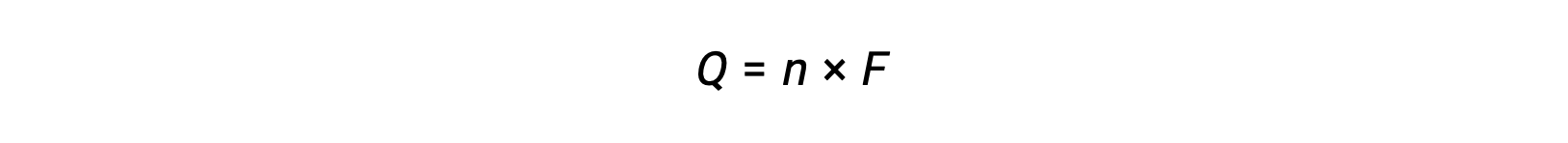
onde F é a constante de Faraday, a carga em coulombs para um mole de eletrões. Para uma célula eletroquímica, o fluxo de corrente é medido e pode ser usado em cálculos estequiométricos relacionados com a reação celular.
Este texto é adaptado de OpenStax, Chemistry 2e, Section 17.7: Electrolysis.
Tags
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
