I metalli di transizione sono definiti come quegli elementi che hanno parzialmente riempito gli orbitali d. Come illustrato nella figura 1, gli elementi d-blocknei gruppi 3-12 sono elementi di transizione. Gli elementi del blocco f,chiamati anche metalli di transizione interna (i lantanidi e gli attinidi), soddisfano anche questo criterio perché l'orbitale d è parzialmente occupato prima degli orbitali f.
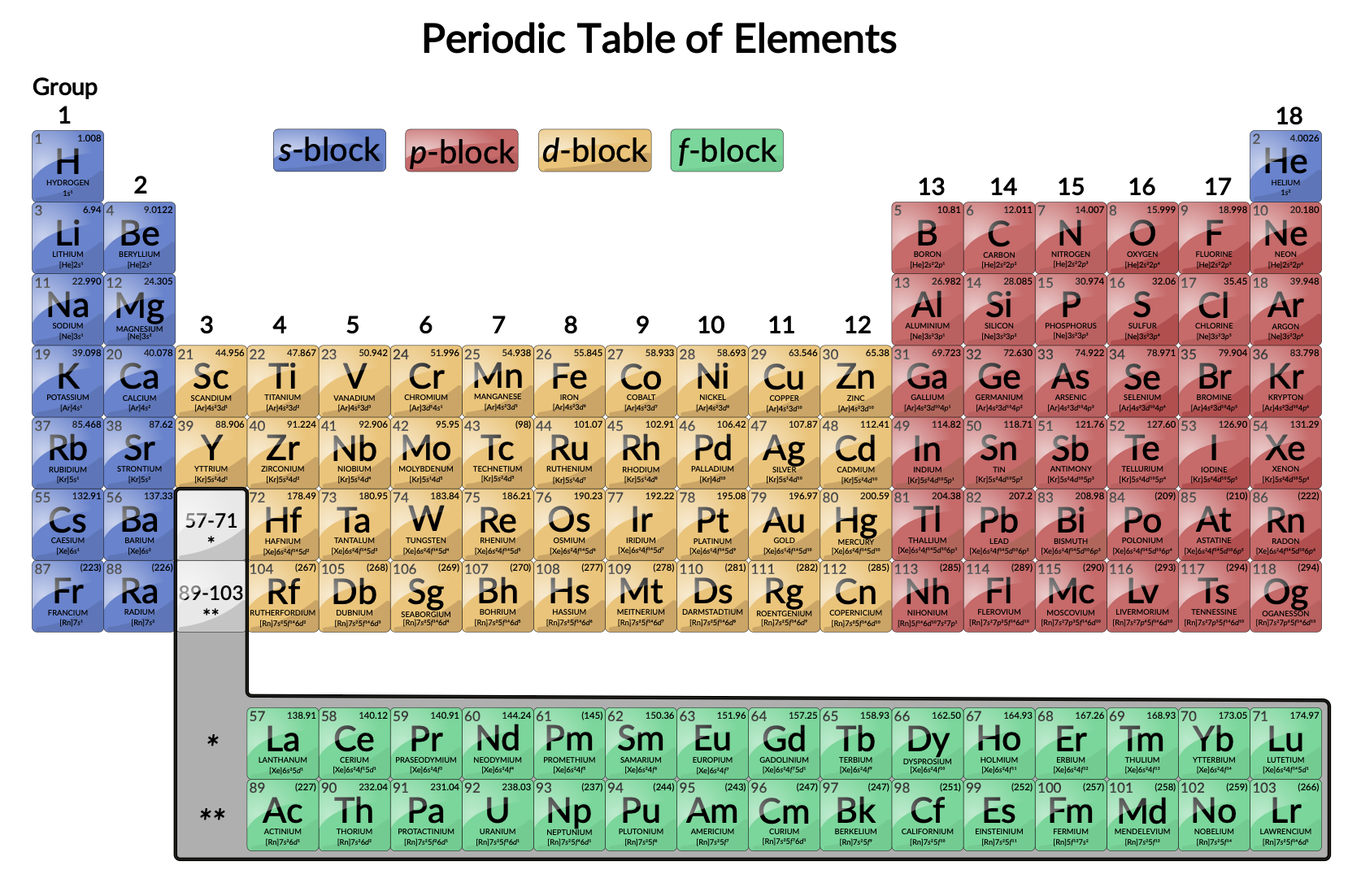
Figura 1: Tavola periodica. I metalli di transizione si trovano nei gruppi 3-11 della tavola periodica. I metalli di transizione interni si trovano nelle due file sotto il corpo della tabella.
Gli elementi d-blocksono divisi nella prima serie di transizione (gli elementi da Sc a Cu), la seconda serie di transizione (gli elementi da Y ad Ag) e la terza serie di transizione (l'elemento La e gli elementi da Hf a Au). Attinio, Ac, è il primo membro della quarta serie di transizione, che include anche Rf attraverso Rg.
Gli elementi f-blocksono gli elementi da Ce a Lu, che costituiscono la serie di lantanidi (o serie lantanoide), e gli elementi da Th a Lr, che costituiscono la serie dell'attinide (o serie attiniide). Poiché il lantanio si comporta molto come gli elementi lantanidi, è considerato un elemento lantanido, anche se la sua configurazione elettronica lo rende il primo membro della terza serie di transizione. Allo stesso modo, il comportamento dell'attinio significa che fa parte della serie dell'attinide, anche se la sua configurazione elettronica lo rende il primo membro della quarta serie di transizione.
Gli elementi di transizione hanno molte proprietà in comune con altri metalli. Sono quasi tutti solidi duri e ad alta fusione che conducono bene calore ed elettricità. Formano facilmente leghe e perdono elettroni per formare formazioni stabili. Inoltre, i metalli di transizione formano un'ampia varietà di composti di coordinazione stabili, in cui l'atomo o lo ione metallico centrale agisce come un acido di Lewis e accetta una o più coppie di elettroni. Molte molecole e ioni diversi possono donare coppie solitarie al centro metallico, fungendo da basi di Lewis.
Proprietà degli elementi di transizione
I metalli di transizione dimostrano una vasta gamma di comportamenti chimici. Alcuni metalli di transizione sono forti agenti riducenti, mentre altri hanno una reattività molto bassa. Ad esempio, i lantanidi formano tutti 3+ formazioni acquose stabili. La forza trainante per tali ossidazioni è simile a quella dei metalli alcalini della terra come Be o Mg, formando Be2+ e Mg2+. D'altra parte, materiali come il platino e l'oro hanno un potenziale di riduzione molto più elevato. La loro capacità di resistere all'ossidazione li rende materiali utili per costruire circuiti e gioielli.
Gli ioni degli elementi più leggeri del blocco d,come Cr3+,Fe3+e Co2+,formano ioni idrati colorati che sono stabili in acqua. Tuttavia, gli ioni nel periodo appena sotto questi (Mo3+, Ru3+e Ir2+) sono instabili e reagiscono prontamente con l'ossigeno dall'aria. La maggior parte degli ioni semplici stabili all'acqua formati dagli elementi di blocco d più pesantisono ossiyanioni come MoO42− e ReO4−.
Rutenio, osmio, rodio, iridio, palladio e platino sono i metalli del platino. Con difficoltà, formano semplici formazioni stabili in acqua e, a differenza degli elementi precedenti della seconda e terza serie di transizione, non formano ossiyanioni stabili.
Entrambi gli elementi diblocco d - e freagiscono con i non metalli per formare composti binari; il riscaldamento è spesso richiesto. Questi elementi reagiscono con gli alogeni per formare una varietà di alogenuri che vanno in stato di ossidazione da +1 a +6. Al riscaldamento, l'ossigeno reagisce con tutti gli elementi di transizione tranne palladio, platino, argento e oro. Gli ossidi di questi ultimi metalli possono essere formati usando altri reagenti, ma si decompongono al riscaldamento. Gli elementi f-block,gli elementi del gruppo 3, e gli elementi della prima serie di transizione tranne il rame reagiscono con soluzioni acquose di acidi, formando idrogeno gassoso e soluzioni dei sali corrispondenti.
I metalli di transizione possono formare composti con una vasta gamma di stati di ossidazione. Alcuni degli stati di ossidazione osservati degli elementi della prima serie di transizione sono riportati nella tabella 1. Spostandosi da sinistra a destra attraverso la prima serie di transizione, il numero di stati di ossidazione comuni aumenta in un primo momento fino a un massimo verso il centro della tabella, quindi diminuisce. I valori nella tabella sono valori tipici; ci sono altri valori noti, ed è possibile sintetizzare nuove aggiunte. Ad esempio, nel 2014, i ricercatori sono riusciti a sintetizzare un nuovo stato di ossidazione dell'iridio (+9).
| 21Sc | 22Ti | 23V | 24Cr | 25milioni di euro | 26Fe | 27Co | 28Ni | 29Cu | 30Zn |
| +1 | |||||||||
| +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | ||
| +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | |
| +4 | +4 | +4 | +4 | ||||||
| +5 | |||||||||
| +6 | +6 | +6 | |||||||
| +7 |
La tabella 1. I metalli di transizione della prima serie di transizione possono formare composti con vari stati di ossidazione.
Per gli elementi scandio attraverso manganese (la prima metà della prima serie di transizione), il più alto stato di ossidazione corrisponde alla perdita di tutti gli elettroni sia negli orbitali s che d dei loro gusci di valenza. Lo ione titanio(IV), ad esempio, si forma quando l'atomo di titanio perde i suoi due elettroni 3d e due 4 s. Questi più alti stati di ossidazione sono le forme più stabili di scandio, titanio e vanadio. Tuttavia, non è possibile continuare a rimuovere tutti gli elettroni di valenza dai metalli mentre continuiamo attraverso la serie. Il ferro è noto per formare stati di ossidazione da +2 a +6, con ferro(II) e ferro (III) che sono i più comuni. La maggior parte degli elementi della prima serie di transizione formano ioni con una carica di 2+ o 3+ che sono stabili in acqua, anche se quelli dei primi membri della serie possono essere facilmente ossidati dall'aria.
Gli elementi della seconda e terza serie di transizione sono generalmente più stabili negli stati di ossidazione più alti rispetto agli elementi della prima serie. In generale, il raggio atomico aumenta verso il basso di un gruppo, il che porta gli ioni della seconda e terza serie ad essere più grandi di quelli della prima serie. Rimuovere gli elettroni dagli orbitali che si trovano più lontano dal nucleo è più facile che rimuovere gli elettroni vicino al nucleo. Ad esempio, il molibdeno e il tungsteno, membri del gruppo 6, sono limitati principalmente a uno stato di ossidazione di +6 in soluzione acquosa. Il cromo, il membro più leggero del gruppo, forma ioni Cr3+ stabili in acqua e, in assenza di aria, ioni Cr2+ meno stabili. Il solfuro con il più alto stato di ossidazione per il cromo è Cr2S3, che contiene lo ione Cr3+. Molibdeno e tungsteno formano solfuri in cui i metalli mostrano stati di ossidazione di +4 e +6.
La varietà di proprietà esposte dai metalli di transizione è dovuta ai loro complessi gusci di valenza. A differenza della maggior parte dei metalli del gruppo principale in cui si osserva normalmente uno stato di ossidazione, la struttura del guscio di valenza dei metalli di transizione significa che di solito si verificano in diversi stati di ossidazione stabile. Inoltre, le transizioni di elettroni in questi elementi possono corrispondere all'assorbimento dei fotoni nello spettro elettromagnetico visibile, portando a composti colorati. A causa di questi comportamenti, i metalli di transizione mostrano una chimica ricca e affascinante.
Questo testo è adattato da Openstax, Chemistry 2e, Chapter 19.1 Occurrence, Preparation, and Properties of Transition Metals and Their Compounds.
