2.1 : Reazioni chimiche
Un'equazione chimica bilanciata fornisce le informazioni sulle formule chimiche dei reagenti e dei prodotti coinvolti nella reazione chimica. La stechiometria di una reazione aiuta a prevedere la quantità di reagente necessaria per produrre la quantità desiderata di prodotto o, in alcuni casi, la quantità di prodotto che si formerà da una quantità specifica di reagente.
Le quantità relative di reagenti e prodotti rappresentati in un'equazione chimica bilanciata sono spesso chiamate quantità stechiometriche. Tuttavia, in realtà, non sempre i reagenti sono presenti nelle quantità stechiometriche indicate dall'equazione bilanciata.
In una reazione chimica, il reagente che viene consumato per primo e che limita la quantità di prodotto formato, è il reagente limitante, mentre l'altra sostanza diventa il reagente in eccesso. Spesso viene utilizzato un eccesso di uno o più reagenti per garantire la completa conversione dell'altro reagente nel prodotto.
Consideriamo la reazione per la formazione dell'acqua rappresentata dall'equazione:
La stechiometria indica che due moli di idrogeno e una mole di ossigeno reagiscono per produrre due moli di acqua; cioè, idrogeno e ossigeno si combinano in un rapporto 2:1.
Immagina se fossero presenti 5 moli di idrogeno e 2 moli di ossigeno. Il rapporto dei reagenti è ora 5:2 (o 2,5:1), che è maggiore del rapporto stechiometrico di 2:1. L'idrogeno, quindi, è presente in eccesso e l'ossigeno è il reagente limitante. La reazione di tutto l'ossigeno fornito (2 mol) consumerà 4 mol delle 5 mol di idrogeno fornite, lasciando 1 mol di idrogeno non reagito. Calcolare le quantità molari di ciascun reagente fornito e confrontarle con le quantità stechiometriche rappresentate nell'equazione chimica bilanciata è un modo per identificare i reagenti limitanti ed in eccesso.
La velocità di reazione è la variazione della quantità di un reagente o di un prodotto nell'unità di tempo. Le velocità di reazione vengono quindi determinate misurando la dipendenza dal tempo di alcune proprietà che possono essere correlate alle quantità di reagenti o prodotti.
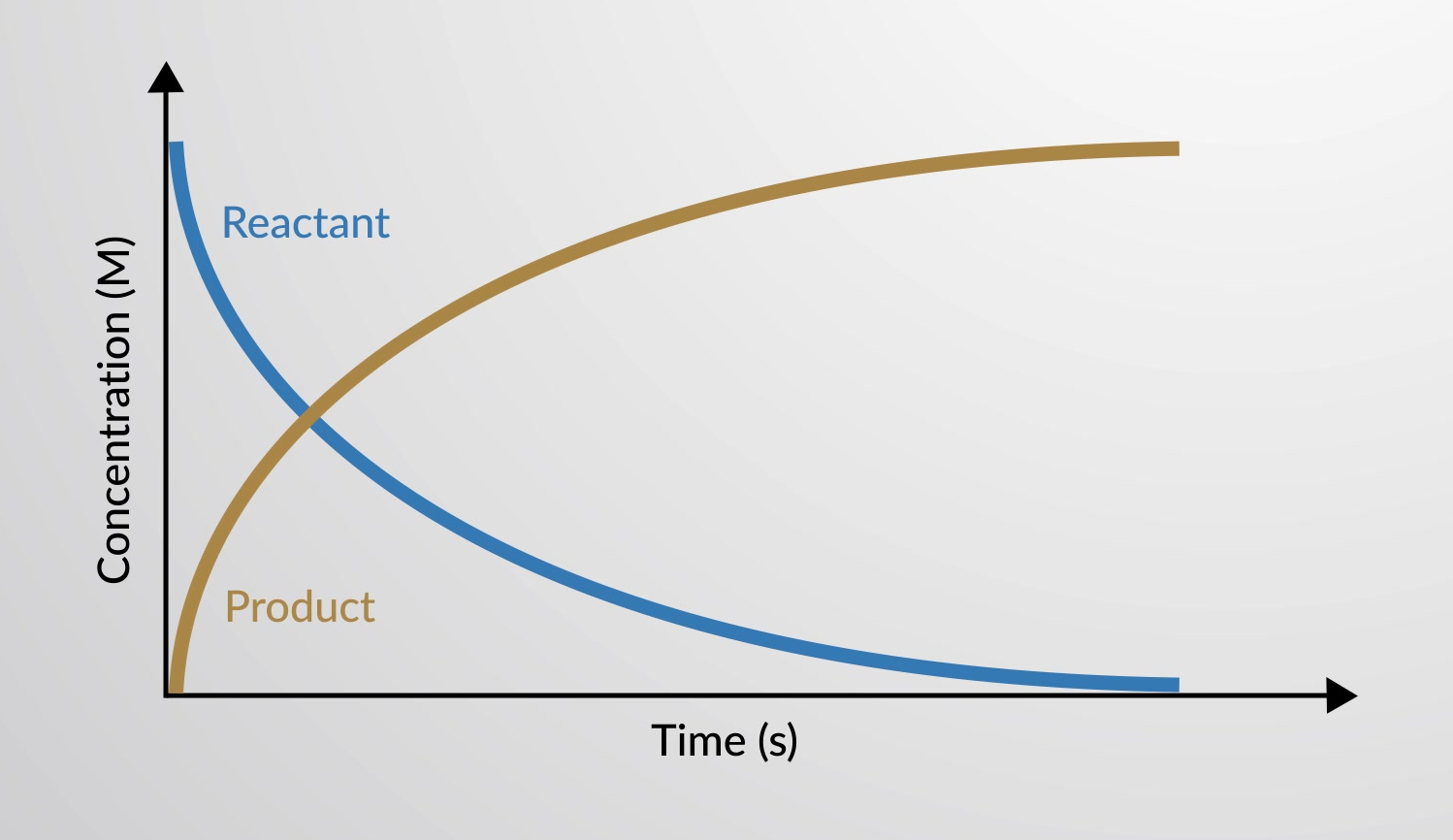
La velocità di una reazione chimica può essere rappresentata in un grafico come la variazione delle concentrazioni di reagenti e prodotti in funzione del tempo.
Una reazione chimica reversibile rappresenta un processo chimico che procede sia in avanti (da sinistra a destra) che indietro (da destra a sinistra). Lo stato di una reazione reversibile viene convenientemente stimato valutando il suo quoziente di reazione (Q). Per una reazione reversibile descritta da
il quoziente di reazione si deriva direttamente dalla stechiometria dell'equazione bilanciata as
dove il pedice c denota l'uso delle concentrazioni molari nell'espressione.
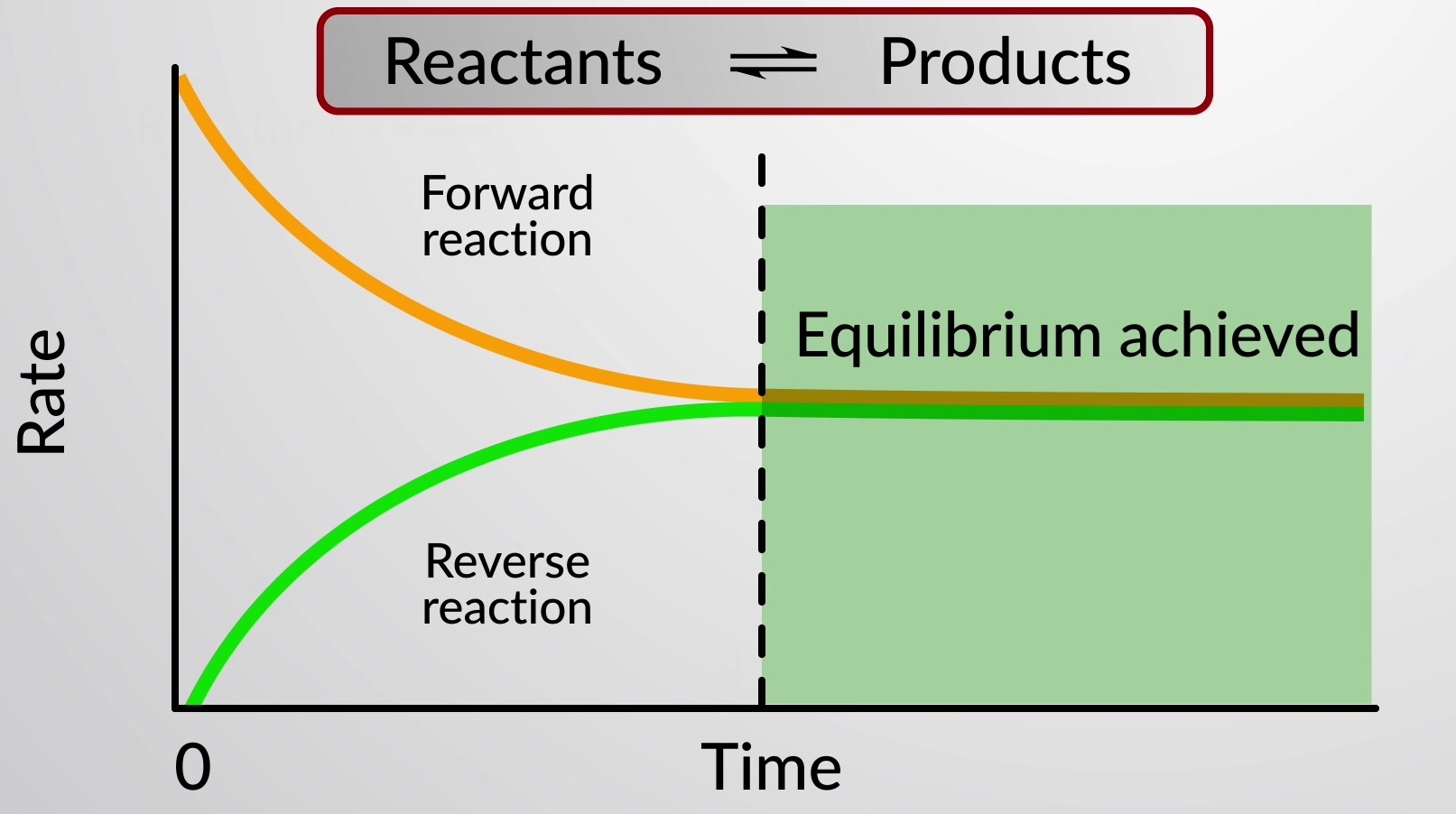
Quando le velocità delle reazioni dirette e inverse sono uguali, le concentrazioni delle specie reagente e prodotto rimangono costanti nel tempo e il sistema è all'equilibrio. Una speciale doppia freccia viene utilizzata per enfatizzare la natura reversibile della reazione.
Questo testo è adattato da OpenStax Chemistry 2e, Section 4.3: Reaction Stoichiometry; Section 4.4: Reaction Yield; Section 12.1: Chemical Reaction Rates; Section 13.1 Chemical Equilibria, Section 13.2 Equilibrium Constants.
Dal capitolo 2:

Now Playing
2.1 : Reazioni chimiche
Termodinamica e cinetiche chimiche
9.8K Visualizzazioni

2.2 : Entalpia e calore di reazione
Termodinamica e cinetiche chimiche
8.3K Visualizzazioni

2.3 : Entalpia di soluzione
Termodinamica e cinetiche chimiche
6.7K Visualizzazioni

2.4 : Entropia e solvatazione
Termodinamica e cinetiche chimiche
7.0K Visualizzazioni

2.5 : L'energia libera di Gibbs e la spontaneità delle reazioni
Termodinamica e cinetiche chimiche
6.7K Visualizzazioni

2.6 : Equilibri chimici e di solubilità
Termodinamica e cinetiche chimiche
4.1K Visualizzazioni

2.7 : Equazione cinetica e ordine di reazione
Termodinamica e cinetiche chimiche
9.3K Visualizzazioni

2.8 : Effetti delle variazioni di temperatura sulla velocità di reazione
Termodinamica e cinetiche chimiche
4.0K Visualizzazioni

2.9 : Reazioni chimiche a più stadi
Termodinamica e cinetiche chimiche
7.2K Visualizzazioni

2.10 : Energia di dissociazione di legame ed energia di attivazione
Termodinamica e cinetiche chimiche
8.7K Visualizzazioni

2.11 : Diagrammi di energia, stati di transizione e intermedi di reazione
Termodinamica e cinetiche chimiche
16.1K Visualizzazioni

2.12 : Predire i prodotti di una reazione
Termodinamica e cinetiche chimiche
8.2K Visualizzazioni