È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Zebrafish intero monte ad alta risoluzione doppia fluorescente In Situ Ibridazione
In questo articolo
Riepilogo
Montare tutto ibridazione in situ è una delle tecniche più utilizzate in biologia dello sviluppo. Qui, presentiamo una ad alta risoluzione doppio fluorescente in protocollo ibridazione in situ per analizzare il modello preciso espressione di un singolo gene e per determinare la sovrapposizione dei domini di espressione di due geni. Includiamo un propidio ioduro nucleare contro-macchia per evidenziare l'organizzazione dei tessuti.
Abstract
Intero monte
Protocollo
1. FISSAGGIO
- Fissare gli embrioni notte a 4 ° C con il 4% paraformaldeide (PFA) in PBS.
- Rimuovere e lavare fissare 2 x PBS, 5 minuti ciascuno a temperatura ambiente (RT).
- Embrioni manualmente dechorionate in PBS in un piatto depressione vetro con pinze orologiaio. Dopo dechorionation, gli embrioni vengono trasferiti utilizzando un incendio lucidato vetro pipetta Pasteur in quanto possono attenersi a pipette polipropilene.
- Trasferimento di embrioni attraverso una serie di 25%, 50% e 75% di metanolo in PBS per 5 minuti ciascuno.
- Sostituire il liquido con il 100% di metanolo, incubare 5 minuti e poi sostituirlo con metanolo fresco.
- Luogo embrioni a -20 ° C per un minimo di un'ora. (Noi di solito incubare gli embrioni durante la notte. Standard di ibridazione in situ lavorerà sugli embrioni conservati per più di un anno, ma non abbiamo esaminato se l'alta risoluzione di ibridazione in situ fluorescente si perde di un immagazzinamento prolungato.)
- Lavare gli embrioni per 5 minuti ciascuno nel 75%, 50%, 25% di metanolo in PBST a temperatura ambiente. Lavare due volte per 5 minuti ciascuno in PBST a temperatura ambiente.
- Fissare di nuovo per 20 minuti in PFA 4% in PBS a temperatura ambiente.
- Lavare due volte per 5 minuti ciascuno in PBST a temperatura ambiente.
NOTE SUL PFA:
Noi memorizzare 4% PFA in aliquote a -20 º C (vedi tabella dei reagenti). Per la fissazione iniziale, usiamo solo PFA che non è mai stato precedentemente scongelati. Per le fissazioni successive, che spesso utilizza PFA che è stato scongelato in precedenza. La fissazione iniziale sembra essere critica per la colorazione di successo con questo protocollo.
2. Proteinasi E POSTFIXATION
- Digerire con proteinasi K (5μg/ml in PBST) a temperatura ambiente per 3 a 12 minuti per permeabilize gli embrioni. (Il tempo di incubazione dipende dall'età degli embrioni più giovani stadi sono più sensibili. Dipende anche il lotto di enzima.) Per gli embrioni fase somitogenesis, di solito permeabilize per 3-4 minuti. Durante questa incubazione, poniamo la provetta su un fianco.
- Sciacquare brevemente in PBST e lavare una volta per 5 minuti in PBST.
- Fissare di nuovo per 20 minuti in PFA 4% in PBS a temperatura ambiente.
- Lavare due volte, per 5 minuti ciascuno, in PBST a temperatura ambiente.
3. PREHYBRIDIZATION
- Incubare gli embrioni per 5 minuti a 65 º C in HYB-.
- Prehybridize a 65 ° C per almeno 1 ora in HYB +.
4. IBRIDAZIONE
- Rimuovere tutti ma il 50 microlitri della preHYB, ma assicurarsi di mantenere gli embrioni completamente sommerso.
- Aggiungere 1-2 ml di ogni riboprobe (digossigenina e marcato con fluoresceina riboprobes) per gli embrioni e mescolare delicatamente sfogliando il tubo. La quantità di sonda è tipicamente 1-2μl da una reazione di 20μl sintesi sonda.
- Dato che la fluoresceina è sensibile alla luce, i tubi dovrebbero essere avvolti in carta stagnola o comunque esposte alla luce minima da questo punto in avanti.
- Incubare gli embrioni notte a 65 ° C.
5. SONDA RIMOZIONE
Si noti che le soluzioni detergenti in avanti da questo punto mancano. Eliminazione di detersivo sembra aiutare le reazioni colorazione, ma provoca gli embrioni a diventare piuttosto appiccicosa.
- Rimuovere il riboprobe.
- Lavare 2 x 30 minuti a 65 º C nel 50% formamide/2xSSC.
- Lavare per 15 minuti a 65 º C in 2 x SSC.
- Lavare per 30 minuti 65 ° C a 0,2 x SSC.
6. ANTICORPI ANTI-fluoresceina INCUBAZIONE
- Blocco per almeno 1 ora a temperatura ambiente in 500μl di una soluzione di 1x tampone acido maleico più reattivo 2% di blocco (vedi tabella dei reagenti).
- Aggiungere l'anti-fluoresceina-POD anticorpi, come fornito da Roche, a una diluizione 1:500 nella soluzione di blocco.
- Incubare una notte a 4 ° C. Durante questa incubazione, poniamo la provetta su un fianco.
- Lavare 4 x 20 minuti in 1x tampone acido maleico. Lavare due volte per 5 minuti ciascuno in PBS.
7. RILEVAZIONE DEI fluoresceina ETICHETTA SONDA
- Incubare per 30-60 minuti in soluzione TSA Plus. fluoresceina. (Spin giù substrato TSA prima di effettuare soluzione colorante. Per la reazione, reagente tyramide diluire 1:50 nel tampone diluente amplificazione Perkin Elmer.) Durante questa incubazione, poniamo la provetta su un fianco. Tempo di reazione deve essere determinato empiricamente per ogni sonda. Purtroppo, la reazione di colorazione non può essere visivamente monitorato come il substrato è fluorescente, e si vedrà onnipresente fluorescenza verde per tutta la reazione di colorazione.
- Lavare per 10 minuti ciascuno nel 30%, 50%, 75% e 100% metanolo in PBS.
- Incubare in una soluzione di 1% di H 2 0 2 in metanolo per 30 minuti per inattivare la perossidasi prima.
- Lavare 10 minuti ciascuno nel 75%, 50% e 30% di metanolo in PBS. Poi lavare due volte per 10 minuti ciascuno in PBS. E 'importante che tutti gli incontratohanol essere rimossi.
NOTE SUL amplificazione del segnale TYRAMIDE:
Abbiamo utilizzato la Perkin Elmer Kit TSA. Troviamo che l'Alexa-Tyramide substrati macchia e utilizzando l'amplificazione Perkin Elmer tampone diluente, ma non abbiamo avuto successo utilizzando il buffer colorazione fornita con il kit di Invitrogen / sonde molecolari. Infine, abbiamo trovato che Cy5 fluorescenza viene eliminato dai successivi metanolo / H 2 O 2, mentre il trattamento con fluorescina e Alexa-647 non sono influenzati. Cy3 può anche essere influenzato negativamente dal metanolo / H 2 O 2 trattamento in quanto è strutturalmente correlata alla Cy5. Per questo motivo, Cy3 e Cy5 reazioni TSA deve essere utilizzato solo per la reazione di colorazione fluorescente secondo in una doppia protocollo in situ.
8. ANTICORPI ANTI-digossigenina INCUBAZIONE
- Bloccare gli embrioni ancora per almeno 1 ora a temperatura ambiente in una soluzione di 1x tampone acido maleico più 2% reagente di blocco.
- Aggiungere l'anticorpo anti-DIG POD come fornito dalla Roche a una diluizione 1:1000 sopra il blocco soluzione
- Incubare una notte a 4 ° C. Durante questa incubazione, poniamo la provetta su un fianco.
- Lavare 4 x 20 minuti in 1x tampone acido maleico. Lavare due volte per 5 minuti ciascuno in PBS.
9. RILEVAZIONE DEI digossigenina-MARCATO SONDA
- Incubare per 30-60 minuti in TSA Plus. Cy5 Solution (Spin giù substrato TSA prima di effettuare soluzione colorante. Per la reazione, reagente tyramide diluire 1:50 nel tampone di amplificazione diluente) Durante questa incubazione, poniamo le provetta su un fianco. Tempo di reazione deve essere determinato empiricamente per ogni sonda.
- Lavare tre volte per 10 minuti ciascuno in PBST.
10. Ioduro di propidio COLORAZIONE
- Lavare due volte per 5 minuti ciascuno in 2 x SSC.
- Incubare gli embrioni per 30 minuti a 37 ° C in 50 microlitri 2 x SSCT con 10 microlitri RNAse (per una concentrazione finale di 100μg/ml).
- Lavare sei volte per 3 minuti ciascuno in 2 x SSC a temperatura ambiente.
- Macchia embrioni per 8 minuti in una soluzione di ioduro di propidio 330μg/ml in 2 x SSC.
- Lavare sei volte per 3 minuti ciascuno in 2 x SSC a temperatura ambiente.
- Fix per 20 minuti in PFA 4% in PBS a temperatura ambiente.
- Lavare due volte, per 5 minuti ciascuno, in PBST a temperatura ambiente.
11. MONTAGGIO
- Incubare gli embrioni per 10 minuti ciascuno nel 25% e 50% glicerolo in PBST. Chiaro durante la notte nel 75% glicerolo a 4 ° C.
- Noi sezionare e deyolk gli embrioni e piatta montarle su un vetrino da microscopio. Il tuorlo può produrre significativi fluorescenza di fondo. Dissezione è molto più facile dopo che gli embrioni hanno eliminato ovenight in gylcerol.
SOLUZIONI:
| PBST | PBS addizionato con lo 0,1% Tween | |
| SSCT | SSC più Tween 0,1% | |
| HYB- | 50% formamide 5xSSC 0,1% Tween-20 | |
| HYB + | HYB- 5mg/ml torula (lievito) RNA 50μg/ml eparina | L'RNA torula si prepara digestione proteinasi K di RNA con conseguente-fenolo, fenolo-cloroformio, cloroformio e-extraction.The RNA è precipitato e disciolto in DEPC trattati con acqua. |
| 1 x tampone acido maleico | 150mm acido maleico, 100mM NaCl (pH 7,5) |
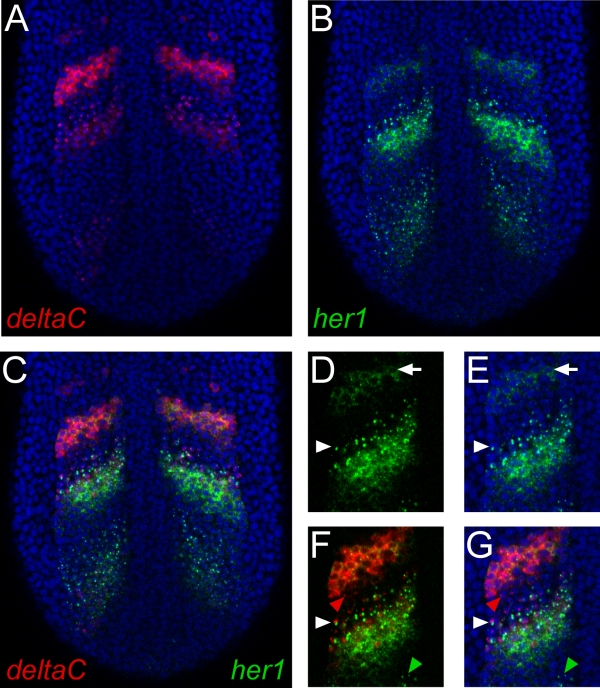
Figura 1. Risultati rappresentante del monte intero doppio ibridazione in situ fluorescente. (AC). Le immagini mostrano una singola sezione confocale attraverso la regione posteriore di un embrione di pesce zebra a dieci somite palco. La vista è dorsale con anteriore verso l'alto. Macchiato nuclei con ioduro di propidio sono di colore blu. (A) deltaC mRNA è stato rilevato utilizzando un riboprobe digossigenina-etichettati e TSA-Cy5 reagente. (B) mRNA trascritto dal gene HER1 è stato rilevato con un riboprobe marcato con fluoresceina e TSA-fluoresceina reagente. (C) Unire i canali verde e rosso identifica in modo univoco le regioni di espressione genica distinto o sovrapposizione dei due geni. (D, E) Particolare HER1 espressione che dimostrano l'alta risoluzione di questa procedura. Localizzazione subcellulare di mRNA può essere chiaramente discernere. Frecce indicano una cella espositrici trascrizione attivo, rivelato da punti di colorazione nel nucleo. Le frecce indicano una cella che mostra la localizzazione citoplasmatica di mRNA. (F, G) per doppia colorazione HER1 e deltaC rivela cellule che sono la trascrizione entrambi i geni (bianco punta di freccia), o sia gene separatamente (punte di freccia rossa e verde).
Discussione
Il protocollo presentato qui funziona bene con le sonde che danno un forte segnale pulito dopo la colorazione per 30-45 minuti in una fosfatasi alcalina-mediata tipica reazione. Prima di eseguire il protocollo di ibridazione fluorescente in situ, abbiamo sempre testare le nostre sonde utilizzando lo standard non fluorescente protocollo (fornito in materiale supplementare con il protocollo di sintesi sonda). Abbiamo avuto meno successo con il protocollo di ibridazione fluorescente in situ utilizzando sonde più debole, m...
Riconoscimenti
Vorremmo ringraziare per i contributi di Dörthe Jülich, Jennifer e Andrew rotonda Mara nello sviluppo di questo protocollo. Sostenere la ricerca fornita dal NICHD, l'American Cancer Society e la March of Dimes.
Materiali
| Name | Company | Catalog Number | Comments |
| Paraformaldehyde 16% solution, EM Grade | Electron Microscopy Sciences | 15710 | Dilute to 4% in 1.33x PBS (final 1x). Store in 2ml aliquots at –20°C |
| Proteinase K, recombinant PCR grade | Roche Group | 03115879001 | Make a 20mg/ml stock solution in water. Store in 1ml aliquots at –20°C |
| Blocking Reagent | Roche Group | 11096176001 | Make a 10% stock solution in 1x maleic acid buffer. Store in 50ml aliquots at –20°C. Stable over multiple freeze/thaws. |
| Anti-Fluorescein-POD, Fab fragments | Roche Group | 11426346910 | Aliquot and store at -20°C. Keep one working aliquot at 4°C. |
| Anti-Digoxigenin-POD, Fab fragments | Roche Group | 11207739910 | As above. |
| TSA Plus Fluorescein system | PerkinElmer, Inc. | NEL741001KT | Prepare each vial of TSA reagent only when needed. Dissolve in 60μl DMSO. Store at 4°C. |
| TSA Plus Cyanine5 system | PerkinElmer, Inc. | NEL745001KT | As above |
| TSA Plus Cyanine3 system | PerkinElmer, Inc. | NEL744001KT | As above |
| TSA Kit #16 AlexaFluor647 tyramide (plus HRP-goat-anti-rabbit IgG) | Molecular Probes, Life Technologies | T20926 | Dissolve tyramide reagent in 150μl DMSO, aliquot and store at –20°C. |
| RNase, DNase free | Roche Group | 11119915001 | Supplied as 500μg/ml solution |
| Propidium Iodide | Molecular Probes, Life Technologies | P-3566 | Supplied as 1mg/ml solution in water. |
Riferimenti
- Schulte-Merker, S., Ho, R. K., Herrmann, B. G., Nüsslein-Volhard, C. The protein product of the zebrafish homologue of the mouse T-gene is expressed in nuclie of the germ ring and the notochord of the early embryo. Development. 116, 1021-1027 (1992).
- Jowett, T. Double in situ hybridization techniques in zebrafish. Methods. 23, 345-358 (2001).
- Jülich, D. beamter/deltaC and the role of Notch ligands in the zebrafish somite segmentation, hindbrain neurogenesis and hypochord differentiation. Dev Biol. 286, 391-404 (2005).
- Mara, A., Schroeder, J., Chalouni, C., Holley, S. A. Priming, Initiation and Synchronization of the Segmentation Clock by deltaD and deltaC. Nat Cell Biol. 9, 523-530 (2007).
- Lecuyer, E. Global analysis of mRNA localization reveals a prominent role in organizing cellular architecture and function. Cell. 131, 174-187 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon