È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In vivo Ca 2 + - Imaging di neuroni Corpo funghi durante l'apprendimento olfattivo nel Honey Bee
In questo articolo
Riepilogo
Le api possono essere condizionate in un paradigma di apprendimento olfattivo appetitivo (PER condizionata). Utilizzando gli odori come stimoli, abbiamo stabilito un metodo in cui il comportamento viene registrato contemporaneamente Imaging calcio è utilizzato per misurare l'attività odore evocato nei neuroni del corpo dei funghi In vivo.
Abstract
In vivo e semi-in preparazione per l'imaging in vivo di calcio è stato sviluppato nel nostro laboratorio da Joerges, Kuttner e Galizia oltre dieci anni fa, per misurare l'attività odore evocato nel lobo antennale 1. Da allora in poi, è stato continuamente perfezionato e applicato a diversi neuropiles nel cervello delle api. Qui, descriviamo la preparazione attualmente in uso in laboratorio per misurare l'attività nei neuroni del corpo dei funghi con un accoppiato destrano calcio-sensibili colorante (Fura-2). Noi retrogrado macchia neuroni corpo funghi, iniettando colorante nella loro assoni o regione soma. Ci si concentra sulla riduzione della invasività, per ottenere una preparazione in cui è ancora possibile formare l'ape utilizzando PER condizionata. Siamo in grado di monitorare e quantificare la risposta comportamentale di registrazione elettro-myograms dal muscolo che controlla il PER (M17) 2.
Dopo l'esperimento fisiologico delle strutture ripreso sono studiati in dettaglio utilizzando la microscopia confocale a scansione per affrontare l'identità dei neuroni.
Protocollo
Bee Preparazione e Back-riempiono
- Cattura api bottinatrici in arnia e freddo in ghiaccio per immobilizzazione.
- Montaggio in plexiglass registrazione camere 3. Fissare gli occhi e torace alle pareti della camera di registrazione con la cera a basso punto di fusione dura.
- Tirare in vetro capillari, comunemente usate per elettrofisiologia e rompere alla punta ad ottenere un diametro punta di ca. 10μm. Coprire punta del capillare con pasta colorante. Pasta colorante è costituito da una miscela 10:01 di Fura-2 destrano e lisina risolvibile tetrametilrodamina destrano.
- Per la procedura di colorazione immobilizzare antenne con minuzie o n-eicosane. Rimuovere un pezzo di cuticola al di sopra del cervello e spingere ghiandole e trachea al lato per consentire l'accesso al corpo dei funghi.
- Iniettare capillari in nessuna regione del soma o assonale dei neuroni del corpo funghi. Questo può essere fatto a mano libera o utilizzando un micro-manipolatore. Quindi ripristinare pezzo cuticola sulla capsula testa e allentare antenne.
- Nutrire le api con una soluzione di saccarosio al 30% prima di riporlo in un caso umidificato per almeno quattro ore o per tutta la notte a 20 ° C.
Imaging in vivo
- Prevenire i movimenti dei es. api con un piccolo pezzo di spugna che viene premuto contro l'addome e fissa con una clip o nastro alla camera di registrazione.
- Per impedire il movimento del cervello risultante dal pompaggio dell 'esofago, tagliate una piccola incisione nella cuticola sopra il labbro ed estrarre con attenzione l'esofago e le sue solide strutture circostanti per metterla in tensione, senza danneggiare l'esofago 4. Coprire con due componenti in silicone.
- Eseguire fori con un ago ed inserire elettrodi a filo per la registrazione di M17.
- Rimuovere pezzo cuticola, trachea e le ghiandole sopra il cervello. Succhiare heamolymph all'interno della capsula testa con un pezzo di carta.
- Riempire la capsula testa con due componenti in silicone. E 'importante che il cervello è completamente coperto.
- Ape posto sul palco microscopio e una goccia d'acqua sulla superficie del silicone per immergere l'obiettivo del microscopio tuffo nella goccia. Focus su neuroni macchiato.
Odore stimolazione e registrazione di segnali
Olfattometro: Usiamo un controllo del computer, dispositivo di stimolazione personalizzati costruiti o "olfattometro" come descritto in precedenza da Galizia e Vetter 3. Gli odori sono diluiti in un flusso d'aria costante diretto verso le antenne. Ogni stimolo consiste in un impulso 3s odore di aria satura dell'odore 0,2 ml. Il protocollo di stimolazione può essere impostato nel TILLVision software di registrazione.
Microscopio Imaging e set-up: Noi usiamo un microscopio a fluorescenza Zeiss. Le immagini vengono registrate a 25 ° C con un tasso di campionamento di 5 Hz utilizzando un AL-Photonics dispositivo di imaging montato sul microscopio. Segnali di calcio sono registrati attraverso un X60, 0,9 W Olympus tuffo obiettivo con una fotocamera CCD Imago (640X480 pixel, 4X cestinate su chip a 160x120 pixel). Fura-2 è eccitato con luce monocromatica di 340 e 380 nm di lunghezza d'onda per misure raziometrico. Fluorescenza viene rilevata attraverso uno specchio dicroico 410nm e 440nm un filtro passaggio lungo. I parametri per la registrazione sono impostate nel software di registrazione. Ogni misura ha una durata di 10 secondi e tempo di esposizione per le due lunghezze d'onda può essere regolata per l'intensità di colorazione in ogni preparazione.
M17 registrazione: Il muscolo goniometro del labium (M17) è registrato extracellulare di monitorare le risposte comportamentali legati all'apprendimento, cioè il PER 5, 6. Iniettare un filo di rame nel muscolo vicino al parti della bocca. Iniettare elettrodo di terra negli occhi. I potenziali muscolari sono amplificate con una generazione personalizzata pre-amplificatore, digitalizzati e archiviati su un computer. Insorgenza stimolo è innescato dal olfattometro.
Analisi dei dati
- Durante l'esperimento: Le registrazioni del segnale calcio sono immessi in un computer e memorizzati. Il TILLVision software di registrazione permette una ispezione iniziale dei segnali, come il calcolo del rapporto tra le lunghezze d'onda (340nm/380nm) e calcolo di deltaF (sottrazione di base).
- L'elaborazione delle immagini viene eseguita con programmi personalizzati scritti in IDL. Calcolare il rapporto di Ca 2 + segnali da 340nm e 380nm misure per ogni pixel. Determinare gli fluorescenza (F) da una media di oltre fotogrammi prima lo stimolo e sottrarre dal segnale raziometrico (deltaF).
- Per definire Regione di interesse (ROI): Calcolare media dei fotogrammi durante lo stimolo e applicare un filtro passa-basso (3X3px). Convertire in scala di grigi a scala di falsi colori. Determinare l'attività in strutture neuronali come macchie attività nelle immagini in falsi colori e definire come il ROI.
- Calcolare la dinamica temporale delle regioni attive facendo la media dei pixel nella ROI su tutti i fotogrammi, senza alcun filtro o correzione.
Analisi morfologica e la ricostruzione
Insieme al Fura-2 destrano riempiamo i neuroni con la risolvibile colorante rodamina destrano ("mini rubino"). Entrambi i coloranti hanno lo stesso peso molecolare, che devono essere co-locati nei neuroni. Grande campo di imaging permette solo la risoluzione spaziale molto limitata, quindi si raccomanda di indagare le strutture macchiate dopo l'esperimento usando la microscopia confocale a scansione.
- Dopo le misurazioni fisiologiche, sezionare il cervello e fissare.
- Sciacquare in PBS e disidratare in etanolo graduale e chiaro in salycilate metile.
- Per la microscopia confocale incorporare cervello in salycilate metile.
- Usiamo un microscopio Leica TCS SP2. Lunghezza d'onda di eccitazione è 543nm.
- Abbiamo la scansione del cervello con l'aria o l'immersione obiettivo di petrolio e confrontare le strutture colorate con i dati di imaging.
Rappresentante dei risultati:
Se la colorazione e la preparazione ha avuto successo, il segnale in scala di falsi colori, ad esempio in funghi corpo alfa neuroni del lobo estrinseca, potrebbe apparire come in figura 1.
La risposta comportamentale (PER) può essere calcolato come frequenza picco durante lo stimolo meno frequenza di picco prima lo stimolo (Figura 2).
Le strutture colorate possono essere studiati in dettaglio utilizzando un microscopio confocale (Figura 3).

Figura 1: Rappresentante segnali Imaging di calcio (stimolazione con heptanal). R: Imaged regione del cervello delle api. B: prime immagini fluorescenti, come visto attraverso un tuffo X20 obiettivo alla lunghezza d'onda di eccitazione 380 nm, l'alfa-lobo del corpo dei funghi è delineato in viola. Colorante è stato iniettato nel ventro-laterale bordo della alfa-lobi a macchia neuroni estrinseci. C: immagine a colori falsi derivato dalla media del segnale, deltaF (340/380), durante lo stimolo tre secondi; alfa-lobo delineato in viola, selezionati ROI delineati in nero. D: dinamica temporale del segnale del calcio in risposta alla stimolazione odore, segnale media della regione di interesse, come indicato in C. E: la dinamica temporale del segnale del calcio in risposta alla stimolazione del saccarosio ipsi-e contra-laterali antenna rispettivamente al ROI indicato in C.

Figura 2: Rappresentante M17 risposta. Dopo il condizionamento olfattivo l'ape estende la proboscide, quando l'odore è presentato senza ricompensa. Linea rossa indica stimolo odore. Inset: PER delle api.
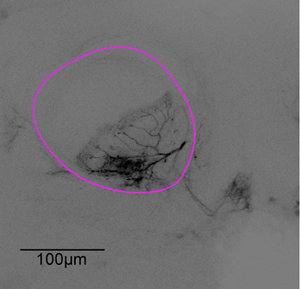
Figura 3: serie di immagini Rappresentante. Dopo l'esperimento di imaging del cervello è stato sezionato. Il neurone di figura 1 viene sottoposto a scansione utilizzando un microscopio confocale con un obiettivo ad immersione olio X20, l'alfa-lobo delineato in viola.
Discussione
In questa presentazione abbiamo vissuto tutti i passaggi per indagare nei segnali di calcio in vivo l'ape. Abbiamo applicato questa tecnica ai neuroni del corpo dei funghi, ma l'imaging può essere fatto su tutti i neuroni per cui una tecnica di colorazione può essere stabilita. Ci siamo concentrati sui neuroni nel percorso olfattivo delle api. Gli esperimenti sono tutti eseguiti in una camera oscura. Il set up è illuminato con una luce onda lunga che si trova fuori dal campo della percezione...
Riconoscimenti
Questo lavoro è finanziato dalla DFG.
Materiali
| Name | Company | Catalog Number | Comments |
| low melting point hard wax Deiberit 502 | Dr. Böhme Schöps Dental GmbH | ||
| FURA-2 dextran potassium salt, 10 000 MW | Invitrogen | F-3029 | Protect from light. |
| tetramethylrhodamine dextran 10 000 MW | Invitrogen | D-3312 | Protect from light. |
| n-eicosane | Sigma-Aldrich | 21, 927-4 | |
| Kwik Sil Adhesive | World Precision Instruments, Inc. | KWIK SIL | |
| Imaging Set-up | TILL Photonics | ||
| CCD camera | Imago | ||
| CED | Texas Instruments |
Riferimenti
- Joerges, J., Küttner, A., Galizia, C. G., Menzel, R. Representations of odors and odor mixtures visualized in the honeybee brain. Nature. 387 (6630), 285-288 (1997).
- Rehder, V. Quantification of the honeybee's proboscis reflex by electromyiographic recordings. J. Insect Physiol. 33, 501-507 (1987).
- Galizia, C. G., Vetter, R. S., Christensen, T. A. Optical Methods for Analyzing Odor-Evoked Activity in the Insect Brain. Methods in Insect Sensory Neuroscience. , 345-388 (2004).
- Mauelshagen, J. Neural correlates of olfactory learning paradigms in an identified neuron in the honeybee brain. J Neurophysiol. 69 (2), 609-625 (1993).
- Kuwabara, M. Bildung des bedingten Reflexes von Pavlovs Typus bei der Honigbiene Apis mellifica, Hokaido Univ. Zool. J. Sci. 13, 458-464 (1957).
- Bitterman, M. E., Menzel, R., Fietz, A., Schafer, S. Classical conditioning of proboscis extension in honeybees (Apis mellifera. Journal of Comparative Psychology. 97 (2), 107-119 (1983).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon