È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Etichette fluorescenti di Drosophila Cuore Strutture
In questo articolo
Riepilogo
Qui si descrive un protocollo di base per la marcatura fluorescente di elementi diversi di tubi cuore da larve e adulti Drosophila melanogaster. Questi esemplari sono particolarmente adatti per l'imaging mediante microscopia a fluorescenza o confocale. Questa tecnica permette una dettagliata analisi strutturale delle caratteristiche del cuore di un organismo modello potente.
Abstract
Il
Protocollo
Prima di iniziare
- Preparare le seguenti soluzioni:
- tampone rilassante (artificiale Drosophila emolinfa (ADH) (vedere "Visualizzare il cuore pulsante in Drosophila") che contiene 10 mM EGTA)
- fissativo (4% di formaldeide in 1x PBS)
- PBSTx (PBS contenente 0,1% Triton X-100)
- Opportunamente diluita anticorpi fluorescente primaria e secondaria specie-specifiche in PBSTx
- Sezionare Drosophila per esporre i tubi cardiaci (di mosche adulte e / o larve) a seguito di
- il semi-intatta Drosophila preparazione protocollo cuore "Visualizzare il cuore pulsante in Drosophila", o
- Drosophila larvale NMJ Dissezione protocollo 1 con le seguenti modifiche: Utilizzare ossigenata ADH durante la dissezione larvale e spostare il perno posteriore leggermente dalla linea mediana ventrale. Le larve sono tagliati lungo la linea mediana ventrale. Non rimuovere i tessuti prima di fissazione.
La colorazione fluorescente
- Controllare che tutti i cuori sono ritmicamente battendo in ossigenato ADH. Sostituire rapidamente ADH con rilassanti buffer. Esaminare ogni tubo cardiaco per assicurare le contrazioni sono inibiti.
- Fissare il cuore, sostituendo il buffer di relax con fissativo. Incubare a temperatura ambiente per 20 minuti agitando delicatamente. (Per agitazione preparazione larvale non è necessario in ogni passo, e può essere considerato dannoso per l'integrità del tessuto cardiaco).
- Lavare i campioni per tre volte per dieci minuti con PBSTx a temperatura ambiente con agitazione continua.
- Per gli adulti, con attenzione tagliare di nuovo i bordi ventrale della cuticola addominale in modo che ciò che rimane è più ellittica e meno arrotondata. Inoltre, con un taglio unico tra l'addome e il torace, attento e pulito separato da entrambi i segmenti del corpo e garantire il minimo danno alla regione anteriore del cuore. Per i cuori larvale, rimuovere con attenzione il grasso corporeo con una pinza sottile. La rimozione del grasso deve essere eseguito con estrema cautela, poiché il cuore larvale è particolarmente fragile e ha un supporto molto poco da altri muscoli o del tessuto connettivo. Non rimuovere i rami tracheali in quanto ciò potrebbe danneggiare il cuore.
- Trasferire la regione tagliata dorsale della cuticola addominale per i bordi, evitando il contatto con il tubo in posizione centrale cardiaco, in una piastra da 96 pozzetti con pozzi che contengono 50-100 ml di anticorpo primario diluito in PBSTx. Luogo non più di 12 esemplari per bene. Incubare a temperatura ambiente per 2 ore con agitazione continua. L'incubazione può essere effettuata anche durante la notte a 4 ° C.
- Rimuovere la soluzione primaria di anticorpi. Lavare i cuori per tre volte per dieci minuti con 100 microlitri PBSTx a temperatura ambiente con agitazione continua.
- Dopo la rimozione di tampone di lavaggio finale, aggiungere 100 ml di anticorpo secondario in PBSTx, integrato con Alexa594-falloidina (1:1000). Incubare per un'ora con agitazione continua a temperatura ambiente. Conservare i campioni coperti per evitare fluoroforo sbiancamento.
- Dopo l'incubazione secondaria, lavare i cuori per tre volte per dieci minuti con 100 ml di PBSTx a temperatura ambiente con agitazione continua. Mantenere i campioni coperto per tutta la fasi di lavaggio.
- Per la rimozione di Triton X-100, lavare i cuori un'ultima volta in 100 ml di PBS per 10 minuti. I campioni possono essere conservati al buio a 4 ° C per diversi giorni prima del montaggio.
Cuori di montaggio per adulti
- Rispettare due 18 x 18 mm per coprire scivola un vetrino da microscopio con 10 l di media Vectashield montaggio. I coprioggetti devono essere distanziati ~ 10-15 mm. Mettere una piccola goccia terzo di montaggio di medie-tra le due lamelle.
- Mettere 20 ml di Vectashield al centro di un vetrino coprioggetto terzo.
- Rimuovere con attenzione ciascuno dei cuori dalla soluzione di lavaggio PBS dai bordi estremi della cuticola, e delicatamente metterli cuore rivolto verso il basso sulla goccia di mezzo di montaggio sul vetrino terzo. Luogo non più di cinque cuori per goccia sul vetrino.
- Controllare al microscopio per garantire che tutti i cuori sono rivolti verso il basso.
- Con attenzione invertire il vetrino che contiene il cuore e rapidamente posto sulla diapositiva che contiene la coppia di coprioggetto in modo che la goccia con tubi cardiaci fonde con la goccia Vectashield tra la coppia coprioggetto. Un "ponte" dovrebbe essere formata da i coprioggetti. I cuori saranno sospesi tra un vetrino e il vetrino da microscopio.
- Controllare al microscopio per garantire che i cuori sono ora rivolte verso l'alto.
- Fissare coprioggetto ai bordi con smalto.
- I cuori sono ora pronti per essere ripreso mediante microscopia a fluorescenza o confocale.
montaggio per Hearts larvali
- Mettere una goccia (~ 20 l) Vectashield su un vetrino da microscopio.
- Cura di trasferimento fino a due esemplari larvali nel loro lato Vectashield e orientare dorsale giù usando aghi di tungsteno.
- Individualmente trascinare i campioni fuori dal mezzo di montaggio e allineare ciascuno in parallelo.
- Mettere un coprioggetti ai lati opposti del campione. Utilizzando pinze, mettere un coprioggetto terza cima, prima che un lato del vetrino posteriore e abbassandolo fino al coprioggetto anteriore in modo da formare un ponte. Forze capillari causerà un flusso di Vectashield da anteriore a posteriore che aiuta il corretto allineamento del cuore larvale.
- Sistemare tutti coprioggetto in posizione, ai bordi, con smalto e con attenzione riempire lo spazio tra i coprioggetti con 20-30 Vectashield microlitri.
- Sigillare con smalto e conservare a 4 ° C, o per la conservazione a lungo termine a -20 ° C.
Rappresentante Risultati
Quando viene eseguito correttamente, tutti i componenti e dei relativi tessuti del vaso dorsale deve rimanere intatto ed essere facilmente visualizzati. La fluorescenza di fondo dovrebbe essere minimo. Per gli adulti, la ventrale longitudinale macchie strato muscolare molto bene e produce un segnale di sostanziale (Figura 1 e Figura 2). I cardiomiociti base circolare tuttavia, tendono a non produrre come un segnale forte come quella dello strato sovrastante ventrale. I miociti del anteriore "camera conica" del cuore adulto contengono una notevole quantità di materiale contrattile e, di conseguenza, questa regione appare come il parente più robusto per il resto del tubo cardiaco. Il cuore larvale presenta una disposizione a spirale miofibrillare simile a quella dei cardiomiociti adulti contrattile (Figura 3).
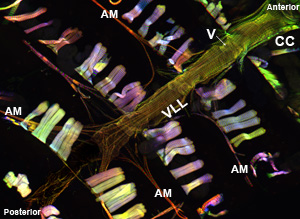
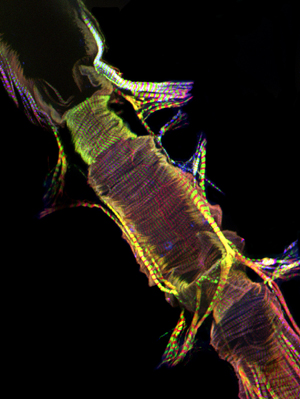
Figura 1: Inizio. Un microscopio a fluorescenza che mostra il tubo intero cardiaca di un adulto Drosophila melanogaster che esprime miosina-GFP. L'immagine è stata scattata con un microscopio a fluorescenza Zeiss Z1 Imager dotato di un modulo Apotome scorrevole. Miosina-GFP viene evidenziato in verde, actina è macchiata di AlexaFluor ® 594 falloidina (rosso) e α-actinina è etichettato con anti-α-actinina anticorpo (blu). Si noti la procedura preparativa permetta il recupero di campioni di cuore con strutture ben conservate. CC = camera conica; AM = muscolo Alary; V = valvola interna; VLL = ventrale strato muscolare longitudinale. Fondo. Una regione del tubo cardiaco adulto dal CC attraverso il terzo segmento addominale del cuore appena sotto lo strato ventrale longitudinale che mostra la disposizione a spirale miofibrilla dei cardiomiociti contrattile. Si prega di cliccare qui per una versione più grande di Figura 1a, e qui per una versione più grande di figura 1b
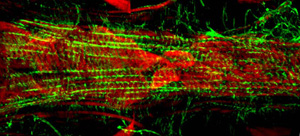
Figura 2: Rappresentante pile confocale di una porzione anteriore del cuore adulto colorate con AlexaFluor ® 594 falloidina (rosso) e un anti-Pericardin (collagene di tipo IV) (verde) di anticorpi. Pericardin è associato con il cuore lungo la superficie ventrale, probabilmente provenienti dalla miofibrille longitudinalmente orientata dello strato muscolare ventrale. Si prega di cliccare qui per una versione più grande della figura 2.

Figura 3: Un microscopio a fluorescenza del segmento A7 del cuore corretta di una larva di terza fase Drosophila. L'immagine è stata scattata con un microscopio a fluorescenza Zeiss Z1 Imager dotato di un modulo Apotome scorrevole. Actina è etichettato con AlexaFluor ® 594 falloidina (verde) e α-actinina è macchiato con anti-α-actinina anticorpi (rosso). Si prega di cliccare qui per una versione più grande di figura 3.
Discussione
Qui vi presentiamo un protocollo utile per la preparazione e la colorazione dorsale Drosophila melanogaster nave e dei relativi tessuti per l'imaging tramite microscopia a fluorescenza o confocale. Forniamo un resoconto sintetico dei passi da raffinate e comunemente impiegati nel nostro laboratorio per la colorazione efficace che permette ben risolta nella diagnostica per immagini in situ di larve e adulti tubi cuore Drosophila. Altri hanno descritto metodi simili in forma abbrevi...
Riconoscimenti
Gli autori ringraziano SI Bernstein (San Diego State University) per la lettura critica e utili suggerimenti per quanto riguarda la preparazione di questo manoscritto. Questo lavoro è stato sostenuto dalle concessioni di NIH SI Bernstein, SDSU, e di R. Bodmer, BIMR, e da un post-dottorato dal Affiliato occidentale Stati della American Heart Association a G. Vogler e ad A. Cammarato.
Materiali
| Name | Company | Catalog Number | Comments | |
| Ethylene glycol-bis (2-amino-ethylether) -N,N,N’,N’-tetra-acetic acid (EGTA) | Reagent | Sigma-Aldrich | E4378 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Reagent | Polysciences, Inc. | 50-00-0 | |
| Triton-X-100 | Reagent | Sigma-Aldrich | 9002-93-1 | |
| Alexa Fluor® 594 phalloidin | Reagent | Invitrogen | A12381 | |
| Vectashield® Mounting Medium for Fluorescence with DAPI | Reagent | Vector Laboratories | H-1200 | |
| Tungsten pins | Reagent | Fine Science Tools | 26002-10 | |
| Pin holder | Reagent | Fine Science Tools | 26018-17 |
Riferimenti
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Molina, M. R., Cripps, R. M. Ostia, the inflow tracts of the Drosophila heart, develop from a genetically distinct subset of cardial cells. Mech Dev. 1, 51-59 (2001).
- Dulcis, D., Levine, R. B. Glutamatergic innervation of the heart initiates retrograde contractions in adult Drosophila melanogaster. J Neurosci. 2, 271-280 (2005).
- Zeitouni, B. Signalling pathways involved in adult heart formation revealed by gene expression profiling in Drosophila. PLoS Genet. 10, 1907-1921 (2007).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological change. J. Morphol. 2, 351-399 (1936).
- Miller, A. . The internal anatomy and histology of the imago of Drosophila melanogaster. , (1950).
- Rizki, T. M. The circulatory system and associated cells and tissues. , (1978).
- Cammarato, A. Myosin transducer mutations differentially affect motor function, myofibril structure, and the performance of skeletal and cardiac muscles. Mol Biol Cell. 2, 553-562 (2008).
- Taghli-Lamallem, O. Dystrophin deficiency in Drosophila reduces lifespan and causes a dilated cardiomyopathy phenotype. Aging Cell. 2, 237-249 (2008).
- Kelso, R. J. a database documenting a GFP protein-trap insertion screen in Drosophila melanogaster. Nucleic Acids Res. 32, D418-D420 (2004).
- Dietzl, G. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 7150, 151-156 (2007).
- Mery, A. The Drosophila muscle LIM protein, Mlp84B, is essential for cardiac function. J Exp Biol. 211, 15-23 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon