Method Article
Dissezione di organi dal Zebrafish adulti
In questo articolo
Riepilogo
Questo protocollo descrive una procedura per l'individuazione e organi da sezionare il pesce zebra adulto.
Abstract
Negli ultimi 20 anni, il pesce zebra è diventato un organismo modello potente per la comprensione dello sviluppo dei vertebrati e le malattie. Anche se l'analisi sperimentale degli embrioni e larve è ampia e la morfologia è stato ben documentato, descrizioni di anatomia zebrafish adulti e studi di sviluppo delle strutture per adulti e degli organi, insieme alle tecniche per lavorare con gli adulti sono carenti. Gli organi della larva subire importanti cambiamenti nella loro struttura complessiva, la morfologia e la posizione anatomica durante le larve di transizione per adulti. Esternamente, la larva trasparente sviluppa il suo modello caratteristico pigmento strisce adulti e coppie pinne pelviche, mentre internamente, gli organi subiscono un'enorme crescita e rimodellamento. Inoltre, il primordio bipotential gonade si sviluppa in entrambi i testicoli o ovaie. Questo protocollo identifica molti degli organi degli adulti e vengono utilizzati dei metodi per la dissezione del cervello, gonadi, apparato gastrointestinale, cuore, reni e del pesce zebra adulto. Gli organi sezionati può essere utilizzato per l'ibridazione in situ, tecniche di immunoistochimica, istologia, estrazione di RNA, analisi delle proteine, e altri molecolare. Questo protocollo aiuterà a l'ampliamento di studi nel zebrafish per includere la ristrutturazione degli organi larvali, la morfogenesi degli organi specifici per le indagini adulti e altri sistemi di organi adulti.
Protocollo
- Un pesce zebra maschio sarà sezionato per primo, seguito da un pesce femmina. Prima di iniziare la dissezione, anestetizzare un pesce nello 0,2% Tricaine e poi l'eutanasia dalla incubazione in acqua ghiacciata per 15 minuti.
- Iniziare con una leggera accarezzando il pesce secco su un tovagliolo di carta e posizionarlo su una stuoia dissezione. Esternamente, pesce zebra hanno un'unica dorsale, pinna caudale e anale e associato pinne pettorali e pelviche (Figura 1).
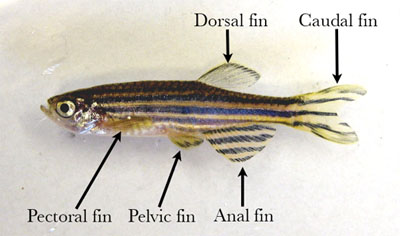
Figura 1. Adulto pesci di sesso maschile con le pinne etichettati. - Pin il pesce al tappeto dissezione attraverso la parte carnosa della coda e la parte ventrale della cavità oculare.
- Tagliare la pelle del ventre del pesce appena anteriormente alla pinna anale. Tagliare la pelle e il muscolo sottostante lungo il ventre dalla pinna anale per l'opercolo (il rivestimento duro sopra la branchia) (Figura 2, punto 1).

Figura 2. Passi nella rimozione della pelle e la parete muscolare del corpo per esporre gli organi interni. - Quindi, rimuovere l'opercolo e la pinna pettorale, tra cui la cintura pettorale (la spessa, regione ossea alla base della pinna) (Figura 2, punto 2). Tagliare la pelle e l'inizio del muscolo sottostante dall'alto del ora esposti branchie posteriormente lungo il lato del pesce e poi giù per la pinna anale (Figura 2, punto 3).
- Rimuovere con cura la pelle e muscolo sottostante dal lato del pesce. Molti degli organi interni sono ora visibili (Figura 3).
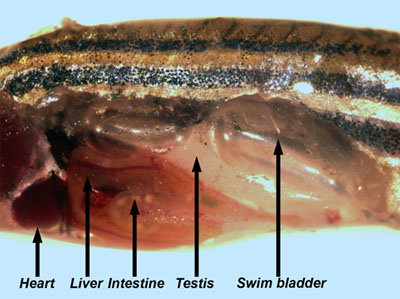
Figura 3. Pesci adulti di sesso maschile con la parete del corpo e dei muscoli rimossi permettendo la visualizzazione degli organi interni. - I testicoli sono lunghe, bianche, organi accoppiati che sono attaccate alla parete dorsale del corpo. Rimuovere un testicolo e mettetelo in un piatto di PBS. Esaminare il testicolo di luce riflessa di visualizzare i tubuli seminiferi (Figura 4), che contengono le cisti con varie fasi di sviluppo di cellule germinali da spermatagonia a spermatidi (Leal et al., 2009).
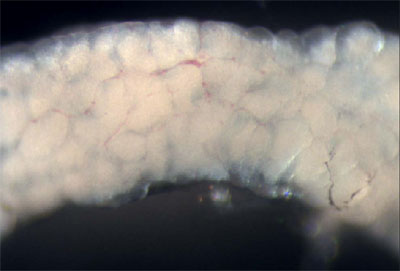
Figura 4. Dissezione di un testicolo. Le strutture bianche tondeggianti sono i tubuli seminiferi. - Quindi, rimuovere il sistema gastrointestinale dalla cavità del corpo del pesce. Il fegato può essere identificato per le grandi dimensioni, morfologia lobi, colore tannish, e la vascolarizzazione estesa. La colecisti, un verde traslucido sacco pieno di liquido, e la milza, che appare rosso vivo, si trovano all'interno del viscere.
- Separare l'intestino dal resto degli organi e tratto fuori. L'anteriore, le regioni a metà, e posteriore dell'intestino sono definiti da l'altezza delle pieghe epiteliali (Wallace et al., 2005).
- Posizionare un pezzo di intestino in PBS e osservare le pieghe epiteliali a luce trasmessa.
- Successivamente, esaminare la vescica natatoria. La vescica natatoria è costituito da una camera posteriore, che è collegato all'esofago attraverso il dotto pneumatico, e una camera anteriore, che è collegata all'orecchio interno attraverso l'apparato weberiano (Finney et al., 2006).
- Rimuovere e gettare la vescica natatoria. Sblocca il pesce e ri-pin che lato ventrale fino a sezionare il rene, che si trova lungo la parete del corpo dorsale. Il rene è una struttura trasparente rosa, associata con l'aorta dorsale e cellule pigmentate. Il rene è suddiviso in regioni della testa, corpo e coda (Figura 5). Sezionare un pezzo del rene e metterlo in PBS. Prendere in giro a parte il tessuto renale per rivelare i tubuli renali.
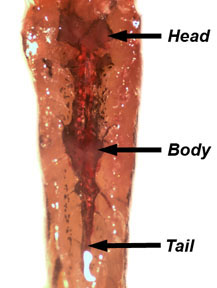
Figura 5. Posizione testa, corpo, e rene coda lungo la parete dorsale del corpo. - Sezionare un pesce femmina. Come descritto in precedenza, l'eutanasia il pesce in acqua ghiacciata e pat asciugare prima di pinning al tappeto dissezione. Togliere la pelle dal lato del pesce come precedentemente dimostrato. L'ovaio è una struttura bilobata che è sospeso nella cavità del corpo da un mesovarium vascolarizzato.
- Rimuovere un lobo delle ovaie, è posto in PBS, ed esaminarlo con luce trasmessa. Gli ovociti possono essere presi in giro a parte utilizzando aghi sottili e poi messo in scena (Figura 6, Selman et al., 1993). Stadio I ovociti sono circa 10 - 150 micron di dimensione e traslucido. Ovociti fase II sono circa 150 - 350 micron nel formato e definito dalla comparsa di granuli corticali. Ovociti stadio III sono 350-750 micron e sono opachi a causa dell'accumulo di tuorlo. Ovociti maturi stadio IV e V sono trasparenti e generalmente non si trovano nelle ovaie delle femmine che hanno recentemente accoppiato.
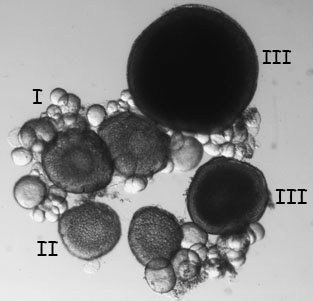
Figura 6. Palco dal vivo I, II, III e ovociti osservati sotto undissezione microscopio a luce trasmessa. - Successivamente, sezionare il cuore dal pesce. Il cuore si trova posteriore e ventrale alla branchia. Iniziate tagliando fuori il cuore e tutto il tessuto circostante e mettendolo in PBS. Con attenzione sezionare via il tessuto che circonda il cuore, facendo attenzione a non danneggiare l'atrio delicato.
- Mettere il cuore sezionato in soluzione di Ringer per osservare il battito cardiaco.
Identificare l'atrio, ventricolo e bulbo arterioso (Figura 7, Hu et al., 2001).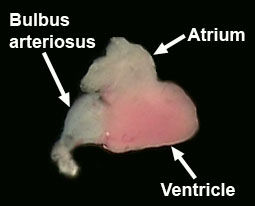
Figura 7. Dissected cuore adulto. - Completa la dissezione rimuovendo il cervello dal pesce. Inizia unpinning il pesce e la rimozione della testa con una lama di rasoio. Rimuovere il più possibile i tessuti molli dal lato ventrale del cranio con una pinza. Rimuovere gli occhi con le forbici piccola sorgente. Rompere il cranio e togliere l'osso dalla parte ventrale del cervello. Ora posto la testa in un piatto di PBS e togliere la pelle e le ossa del cranio dal lato dorsale del cervello.
- Identificare i bulbi olfattivi, telencefalo, habenula, tetto ottico, cervelletto e midollo (Figura 8, Wullimann et al, 1996;. Schilling, 2002).
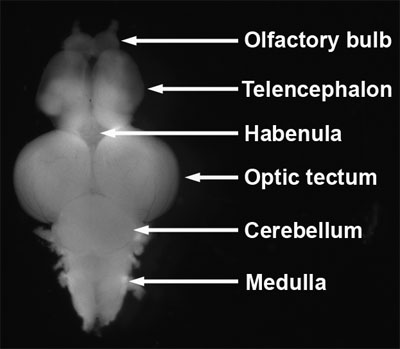
Figura 8. Dissected zebrafish cervello adulto. Vista dorsale, anteriore verso l'alto.
Divulgazioni
Riconoscimenti
Questo lavoro è stato sostenuto da NIH concedere R01 HD050901 di MCM e americana Cancer Society Postdoctoral Fellowship # PF-05-041-01-DDC al TG.
Materiali
Reagenti:
0,2% Tricaine (3-etil aminobenzoate)
200 mg polvere tricaine
97,9 ml di acqua DD
~ 1 ml di 1 M Tris (pH 9)
Regolare il pH a 7,0
Tampone fosfato (PBS)
4,0 g di NaCl
0,1 g KCl
100 ml PO 4 0,1 M tampone, pH 7,3
150 ml di dH 2 O
Soluzione di Ringer
6.7g di NaCl
0,2 g KCl
0,2 g CaCl 2
1.2g Hepes
1 LH 2 O
Regolare il pH a 7,2
Attrezzatura:
Dissezione piatto con tappetino
Electron Microscopy Sciences
Catalogo # 70540
Vännäs primavera forbici
Strumenti Scienza multa
Catalogo # 91500-09
Riferimenti
- Finney, J. L., Robertson, G. N., McGee, C. A., Smith, F. M., Croll, R. P. Structure and Autonomic Innervation of the Swim Bladder in the Zebrafish (Danio rerio). J Comp Neurol. 495, 587-606 (2006).
- Hu, N., Yost, H. J., Clark, E. B. Cardiac morphology and blood pressure in the adult zebrafish. Anat Rec. 264, 1-12 (2001).
- Leal, M. C., Cardoso, E. R., Nóbrega, R. H., Batlouni, S. R., Bogerd, J., França, L. R., Schulz, R. W. Histological and stereological evaluation of zebrafish (Danio rerio) spermatogenesis with an emphasis on spermatogonial generations. Biol Reprod. 81, 177-187 (2009).
- Schilling, T. F., Nusslein-Volhard, C., Dahm, R. The morphology of larval and adult zebrafish. Zebrafish: A Practical Approach (The Practical Approach Series). , (2002).
- Selman, K., Wallace, R., Sarka, A., Qi, X. Stages of oocyte development in the Zebrafish, Brachydanio rerio. J. Morphol. 218, 203-224 (1993).
- Wallace, K. N., Akhter, S., Smith, E. M., Lorent, K., Pack, M. Intestinal growth and differentiation in zebrafish. Mech Dev. 122, 157-173 (2005).
- Wullimann, M. F., Rupp, B., Reichert, H. . Neuroanatomy of the zebrafish brain : a topological atlas. , (1996).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon