È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un reversibile, metodo non invasivo per le misure di resistenza delle vie aeree e liquido di lavaggio broncoalveolare di campionamento nei topi
In questo articolo
Riepilogo
Ripetute misurazioni della fisiologia respiratoria e roditori di campionamento di cellule infiammatorie delle vie aeree sono auspicabili, ma generalmente non realizzabili. Qui si descrive un metodo ripetibile per l'intubazione per via orale nei topi che permette misurazioni ripetute di iperreattività delle vie aeree e il campionamento di cellule infiammatorie delle vie aeree.
Abstract
Iperreattività delle vie aeree (AHR) misurazioni e lavaggio broncoalveolare (BAL) campionamento dei fluidi sono essenziali per modelli sperimentali di asma, ma le procedure ripetute per ottenere tali misurazioni nello stesso animale in genere non sono fattibili. In questo studio dimostriamo protocolli per ottenere da topi ripetute misurazioni di AHR e campioni di liquido di lavaggio broncoalveolare. Topi sono stati inoculati per via intranasale sette volte di più di 14 giorni con un potente allergene o sham trattati. Prima della sfida iniziale, ed entro 24 ore dopo ogni sfida intranasale, gli stessi animali sono stati anestetizzati, per via orale intubati e ventilati meccanicamente. AHR, valutata confrontando le curve dose-risposta di resistenza del sistema respiratorio (RRS) indotta da dosi crescenti per via endovenosa di acetilcolina (Ach) cloruro tra finzione e allergene-sfidato gli animali, sono stati determinati. Successivamente, e attraverso l'intubazione stesso, il polmone sinistro era lavaged in modo che conteggio differenziale delle cellule delle vie aeree potrebbe essere eseguita. Questi studi rivelano che le misurazioni ripetute di AHR e la raccolta BAL sono possibili dagli animali stessi e che l'iperresponsività delle vie aeree e la massima eosinofilia delle vie aeree sono raggiunti entro 7-10 giorni dall'inizio della sfida allergene. Questa nuova tecnica riduce significativamente il numero di topi richiesto per la sperimentazione longitudinale ed è applicabile a diverse specie di roditori, modelli di malattia delle vie aeree e strumenti di fisiologia.
Protocollo
Allergene sfida:
- Topi C57BL / 6, 4-8 settimane di età, sono anestetizzati in una camera di plexiglass a tenuta d'aria pulita con un 3,2% isofluorano in miscela di ossigeno al vapore per 10 minuti per raggiungere in profondità l'anestesia generale.
- Sfide allergene intranasale (45μL OVA (22,5 mg) e 7μL A. oryzae (7 mg), in PBS) sono amministrati, ogni Martedì, Giovedi e Domenica, per un totale di sette applicazioni consecutive.
Anestesia:
- Prima di ogni sfida allergene, e seguendo la sfida 7, i topi vengono somministrati un'iniezione intraperitoneale di 48 mg / kg etomidate (2 mg / ml), prima di essere collocati in una luce-ad esclusione presa.
- Soggetto rimane in presa fino a quando la mancanza di osservabile risposta neurologica viene rilevato a richiesta di pressione per le zampe posteriori (5-10 minuti).
Intubazione:
- Una lampada calore radiante, mantenuto ad una distanza di assicurare il mantenimento di circa 37 ° C la temperatura interna del corpo, dovrebbe essere incentrata sul tema durante tutta la procedura per evitare l'ipotermia. Un termometro rettale deve essere utilizzato, almeno inizialmente, per confermare euthermia indipendentemente dalla fonte di calore utilizzata.
Passaggi critici Tutti i fluidi e gli strumenti ricevuti da animali da laboratorio devono essere sterili; procedure devono essere eseguite in condizioni strettamente asettiche. Ipotermia prolungata mentre sotto anestesia porterà a dati aberranti e / o morte di animali. Competenza con tutte le procedure invasive dovrebbero essere sviluppati utilizzando animali da cadavere prima di lavorare su animali vivi. Oftalmica lubrificante deve essere usato per prevenire abrasioni corneali di animali in anestesia generale. - Topi anestetizzati vengono rimossi dal recipiente e posizionato nella posizione sdraiata (fino lato ventrale), sul tavolo pletismografo, regolata ad un angolo di 45 °.
- Un elastico che circonda la tabella viene inserita dietro la fila superiore degli incisivi in modo di garantire il soggetto in posizione. Con le pinzette a mano destra, presa, estendere e sollevare la lingua dalla bocca prima di fissare in posizione con un metallo depressore nella mano sinistra, permettendo così una via aerea senza ostacoli per l'intubazione.
- Un diametro 0,8 mm, Filetto a fibre ottiche, collegato ad una sorgente luminosa, viene inserito attraverso la angiocatheter ed esteso 10 mm rispetto alla punta. Il depressore è stabilizzò con la mano sinistra, alla fine illuminato del filo a fibre ottiche è guidato attraverso la cavità orale e faringe per la mano destra fino a quando le corde vocali sono visualizzati. Il filo viene fatto passare sotto visualizzazione diretta attraverso le corde vocali in movimento e nella trachea, tempo che si verificano quando le corde sono aperte al massimo.
- Il angiocatheter è poi passata sopra il filo a fibre ottiche nella trachea fino alla punta del catetere si trova all'interno della metà porzione della trachea. 17-22 grammi per i topi, questo corrisponde a un segmento di catetere 10 millimetri ancora visibili tra il connettore e l'estremo craniale della mandibola del soggetto s. L'importo effettivo con il quale viene passato il catetere dovrebbe essere determinato dal controllo diretto della trachea di 2-3 topi cateterizzati delle dimensioni rilevanti e background genetico.
- Il filo a fibre ottiche viene rimosso e l'intubazione di successo è confermato dall'osservazione regolari respiri profondi (escursioni ritmiche del torace e dell'addome) che risolvere immediatamente dopo l'occlusione del connettore con il pollice. Una risposta soffocamento, a prescindere dal pollice-occlusione, respiro irregolare, o altri segni di difficoltà respiratorie sono indicativi di angiocatheter malposizionamento e di solito indicano l'intubazione esofagea.
Il mancato passaggio critico per invertire rapidamente una intubazione esofagea può essere letale. Se si sospetta l'intubazione esofagea, il catetere dovrebbe essere rapidamente rimossa e reinserita una volta che l'animale ha ripreso un andamento normale respirazione. Etomidate è l'anestetico di scelta, di tutti gli anestetici roditori disponibile, questo agente provoca la minima tossicità cardiovascolare (ipotensione, aritmie, arresto cardiaco). - Tabella pletismografo inferiore fino parallelo con il banco di lavoro e girare a 180 ° fino a soggetto di fronte porta ventilatore dell'aria. Girare animale su un fianco prima di connettersi al ventilatore.
- Un successo l'intubazione è ulteriormente confermata quando, dopo essersi assicurato ermeticamente connessione e attivare il ventilatore (funzionamento a 150 respiri / minuto, 9 ml / g del volume corrente, 100% di ossigeno), escursione toraco-addominale è visto il passo con il ventilatore.
Linea endovenosa:
- A 10 mm, ago 27ga viene rimosso dalla sua siringa connettore per mezzo di fusione è gratuito, e piega a 90 ° ago nel punto mediano con pinza emostatica sterile e in modo che la smussatura affronta in angolo. Il non smussato estremità è collegata al tubo PE10 che conduce al porto di iniezione IV.
- Per evitare che potenzialmenteembolizzazione aria fatale, il tubo e ago sono eliminati con 37 ° C, 0.9% NaCl attraverso la siringa da 1 ml. La porta è composta da un ago 27ga, spinto attraverso un foro nel tappo di un tubo da centrifuga 15 ml. Il tappo è pieno di tale soluzione salina che l'estremità dell'ago è costantemente sommerso, riducendo così la probabilità che l'aria sarà trascinato in l'ago e iniettato per via endovenosa.
- Con il mouse rimanendo sotto la lampada di calore, l'ago è allineato in estremo caudale del parallelo coda e sopra la vena laterale. L'ago è gestito un po 'sotto la pelle, mentre la regia cranialmente lungo la lunghezza della vena s e spinto via sottocutanea alla curva. Il posizionamento di successo IV è confermata osservando riflusso del sangue nel tubo IV con trazione leggera lo stantuffo della siringa. Inoltre, ci dovrebbe essere libero flusso attraverso la linea IV a seguito di iniezione di 50-100 microlitri soluzione salina nella vena della coda. Vene coda occasionali non possono essere stabilmente cannulata. In questi casi, il mouse può essere ruotato di 180 gradi verso l'altro lato e la coda di altri IV accede generalmente senza difficoltà.
- Dopo aver rimosso la lampada di calore dal setup, il soggetto è racchiusa nel pletismografo, successivamente assicurato come l'aria a tenuta con l'applicazione di 4 morsetti.
PUNTO CRITICO Permettere la lampada di calore di rimanere sul scalderà l'aria nella camera di pletismografo e potenzialmente alterare le misurazioni successive di Sterilità R RS di aghi iv e le soluzioni devono essere mantenuti. Sterilizzazione degli aghi si ottiene immergendo e lavaggio con etanolo al 70% seguito da risciacquo e lavaggio con soluzione salina sterile prima iv inserimento. Inoltre, la coda deve essere pulita con il 70% di etanolo o alcool isopropilico prima dell'inserimento iv.
Misure di resistenza delle vie aeree:
- Resistenza di picco è determinata dalla quantificazione continuo del quoziente DPt / V (dove DPt è la variazione della pressione tracheale e V è il flusso d'aria) nei punti di volume polmonare pari (70% del volume corrente). DPt viene determinato utilizzando un trasduttore di pressione collegato al angiocatheter tracheale. Per determinare V, variazioni di pressione pletismografo sono calibrati per le variazioni di volume oltre i range fisiologico studiato. Il differenziale del volume pletismografo nel tempo, come calcolato dal modulo preamplificatore, è V. Dopo aver stabilito una linea di base stabile R RS (variazione <5% nei 3 minuti), cinque dosi successive (volume = 2 microlitri / g di peso corporeo) di aumentare Le concentrazioni di cloruro di acetilcolina (0,058, 0,18, 0,59, 1,58 e 5,8 mg / kg di peso corporeo, in soluzione salina 0,9% a pH 7,4, mantenuto su ghiaccio e mano-riscaldata prima di ogni iniezione) vengono iniettate oltre un secondo via iv, con ogni dose successiva somministrazione al ritorno di R RS alla linea di base, fino a triplicare la resistenza di base (circa 12 cm H 2 O x ml -1 x sec, cioè un aumento del 200% della resistenza delle vie aeree al di sopra della linea di base tipici di circa 4 cm H 2 O x ml -1 x sec) è raggiunto. La concentrazione di Ach provocatori, in mg / g di peso corporeo, che provoca un aumento del 200% in R RS da valori di base (chiamato PC 200), viene calcolata per interpolazione matematica del Ach-R RS curve dose-risposta.
- Una volta che PC 200 i valori sono stati raggiunti, di fissaggio a sgancio, e smontare il pletismografo. Un massimo di 5 dosi crescenti di Ach è dato. L'intervallo di concentrazione Ach di cui sopra è atto a conseguire PC 200 valori di ceppi di topi più ingenuo.
PUNTO CRITICO Quando una base di circa 4 cm H 2 O x ml -1 x sec è stabilito sul monitor resistenza per 30 secondi, 60 ml di soluzione fisiologica può essere somministrato per via endovenosa per confermare che il piano adeguato di anestesia è stato raggiunto. Con l'anestesia completa, non ci sarà alcun cambiamento significativo nella resistenza, un aumento della resistenza o del movimento degli arti o la coda rappresenta un segno di disagio fisico e indica la necessità di ulteriori anestetico. - Rimuovere IV dalla vena della coda e poi staccare l'animale dal ventilatore, mantenendo una pervietà delle vie aeree, mantenendo la cannula tracheale in posizione. Animali occasionali non riescono a riprendere la respirazione spontanea immediatamente. In questi casi, la respirazione può essere incoraggiato con un leggero massaggio al torace.
Respirazione spontanea passo fondamentale deve essere stabilito prima del trasferimento alla camera di recupero, altrimenti decessi si verificherà. - Alla ripresa della respirazione spontanea, i topi vengono trasferite con cannula tracheale in atto, di una camera pulita con il 100% O 2 e il mantenimento a 37 ° C utilizzando una lampada di calore. All'interno di 15-20 minuti, i topi sono respirando forte e cominciando a spostare le loro estremità, a questo punto il catetere tracheale può essere rimosso e gli animali safely trasferiti nelle loro gabbie regolari.
PUNTO CRITICO La vie aeree è facilmente ostruite nel topo inconscio a causa di acetilcolina indotta iper-salivazione ed è la ragione principale per asfissia morte correlata in topi anestetizzati seguenti misure fisiologiche delle vie aeree. Per questo motivo, la cannula tracheale deve rimanere al loro posto, anche nei topi non sottoposti a lavaggio broncoalveolare, fino a quando sono arousable e non deve essere rimosso fino iper-salivaton è cessata.
Lavaggio broncoalveolare:
- Raccolta di liquido di lavaggio broncoalveolare è sicuro quando i topi di recuperare a sufficienza la loro gag reflex (~ 20 minuti dopo il posizionamento in camera di recupero). Il riflesso del vomito è valutata facendo scorrere delicatamente la angiocatheter interiore ed esteriore, tosse o difficoltà evidenti indicano che il riflesso del vomito è tornato.
PUNTO CRITICO Permettere troppo prolungato un tempo di recupero diminuisce notevolmente l'efficienza del ritorno BAL dai topi individuali, così, il riflesso del vomito devono essere monitorati ogni pochi minuti, seguendo le suggerì periodo di 20 minuti di riposo. Se i topi sono in grado di tollerare la procedura di lavaggio a causa di risveglio parziale, del 3,2% l'anestesia isoflurano vapore può essere utilizzato. - Un filo guida metallico intubazione (0.5mm OD), con una curva continua di ~ 30 ° diretti al lobo sinistro del polmone, viene inserito nel angiocatheter. Il filo guida e angiocatheter sono avanzati insieme nel lobo sinistro del polmone, in modo che il catetere (hub esclusa) si estende oltre i denti anteriori con solo 1 mm.
Il mancato passaggio critico per isolare polmone sinistro ridurrà di molto rendimento, migliorando nel contempo la probabilità di morte degli animali. La cura deve essere adottate per assicurare che la punta del filo guida non passa attraverso l'estremità aperta del angiocatheter. Avanzamento della angiocathether con la punta metallica sporgente potrebbe portare una lacerazione della trachea e la morte a causa della rottura tracheale. - Mantenere la angiocatheter in atto, il filo guida viene rimosso e 300 ml di PBS (pH 7,4, sterile) viene lavata nel polmone sinistro con una siringa da 1 ml. Subito dopo, mentre stesura lo stantuffo della siringa per creare pressione negativa, la angiocatheter sta lentamente (3 s) rimossa mentre massaggia intensamente il polmone. Un ritorno BAL di 100-200 microlitri è previsto.
- Restituire immediatamente i topi lavaged ai 37 ° C, 100% O 2 da camera, mentre continua massaggiare il torace. Topi posto sul lato sinistro fino alla completa guarigione (~ 20 min). Gli animali vengono poi rimessi nelle loro gabbie.
TEMPISTICA:
Per il mouse, l'intera procedura non dovrebbe richiedere più di 1 ora per realizzare: Step 3-4, 5-10 min; Passi 5-21, 10 min; Passo 22, 20-30 min; Passi 23-24,... 10 min. Con una conoscenza maggiore e da soggetti sconcertante nel protocollo, fino a 3 topi / ora possono essere trattati.
Rappresentante dei risultati:
Iperreattività delle vie aeree nei topi, come determinato da misure di PC 200 valori, è una conseguenza di attivazione e reclutamento nei polmoni di cellule T e la secrezione delle citochine IL-135-7. Così, iperreattività delle vie aeree non è la conseguenza inevitabile della sfida delle vie aeree con allergene, ma dipende piuttosto da una eventuale cella intatto immunitaria delle cellule T e il tempo necessario per le risposte delle cellule T di sviluppare nel contesto della ripetuta esposizione agli allergeni. Come mostrato in fig. 2a, iperreattività delle vie aeree, definita come PC 200 valori significativamente più bassi rispetto ai valori basali, sviluppato dopo 5 sfide allergene, senza ulteriore aumento significativo dopo la sfida sesto. Per motivi che non sono pienamente compresi, reattività delle vie aeree sono diminuiti (PC 200 valori aumentati) dopo la sfida allergene prima (Fig. 2a). Tendenze analoghe sono evidenti confrontando Ach curve dose-risposta per i topi stessi (Fig. 2b). Tuttavia, è evidente qui che l'iperreattività delle vie aeree pieno sviluppa bruscamente dopo la sfida allergene quinto, in modo tale che i topi diventano più di 30 volte più sensibile di Ach tra le sfide quarto e il sesto. Insieme, questi risultati indicano che le misure più affidabili di AHR si ottengono dopo sei sfide allergene (12 giorni); misurazioni timepoints precedenti sono atte a produrre dati altamente variabile. I topi ripetutamente sfidato con veicolo intranasale (soluzione fisiologica) non sviluppano l'iperreattività delle vie aeree, e, a tutti i dosaggi di Ach dato, R misure RS non variano in modo significativo dai valori basali (Fig. 3 e dati non riportati).
Prima della nascita di AHR robusto, il tipo di cellula dominante delle vie respiratorie indotta da allergene è stato il neutrofili (Fig. 4). Simile all'andamento di AHR, tuttavia, eosinofilia gradualmente rafforzato con la sfida allergene ripetute e il eosinofili divenne il tipo di cellula numericamente dominante nel liquido af BALter la sfida sesto, coincidente con un marcato declino nei numeri neutrophis (Fig. 4). Macrofagi inizialmente aumentano di numero con le prime sfide allergene pochi e oscillato in abbondanza in seguito. Abbondanza di linfociti non è cambiata significativamente, indipendentemente dal numero di sfide allergeni e, paradossalmente, vista la loro importanza primaria per il modello, sono in genere la cellula meno numerosi nel BAL.
Misure di resistenza delle vie aeree nei topi ricevere né allergeni né campionamento BAL non sono variati nel corso degli 17 giorni di sperimentazione. Ripetuti campionamenti BAL, in assenza di misure di fisiologia delle vie aeree o allergeni sono stati eseguiti, e ha mostrato solo una maggiore neutrofili e macrofagi di reclutamento per le vie aeree che non perdura oltre 5 giorni (dati non riportati). Questi risultati dimostrano che il rilievo neutrofilia osservato nei topi allergene sfidato è in gran parte il risultato della procedura e non l'antigene.
Nel controllo, PBS-sfidato topi, misure di resistenza delle vie aeree anche non variano in modo significativo nel corso del tempo. Maggiore macrofagi e neutrofili, ma non degli eosinofili, le assunzioni a BAL è stato visto anche in questi topi, simili a quelle cambiamenti osservati nei topi ricevuto solo campionamento ripetuto BAL (Fig. 4 b, d). Insieme, questi dati sottolineano l'importanza del allergene, e non le manipolazioni varie delle vie aeree, per l'induzione di entrambi allergici (eosinofila), infiammazione delle vie aeree e AHR.
Risultati simili si può aspettare con allergeni intranasale analoga alla proteinasi che abbiamo usato qui. Tuttavia, molti ricercatori utilizzano ovalbumina per indurre la malattia allergica ai polmoni. Dopo un adeguato periodo di adescamento intradermica o intraperitoneale (1-2 settimane) con ovalbumina precipitati in un sale di alluminio, un fenotipo asma robusto, tra cui l'iperreattività delle vie aeree, può essere previsto entro 24 ore dopo una sfida singola intranasale con ovalbumina solubile.
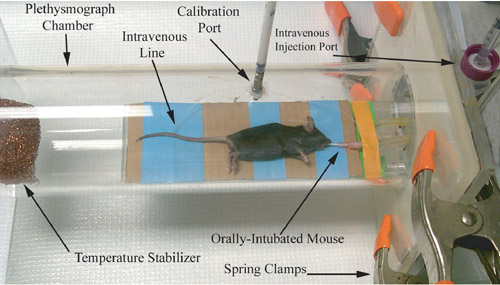
Figura 1. Rappresentazione fotografica di un pletismografo roditore, subito prima della registrazione delle vie aeree misura fisiologia.

Figura 2. Resistenza delle vie aeree misurazioni. A) Ai fini statistici, antilog PC 200 sono riportati i valori. Si noti il forte aumento del PC antilog 200 dopo la prima sfida e la conseguente diminuzione seguenti ulteriori sfide. B) la resistenza del sistema respiratorio (RRS): Nota la pendenza del Ach-RRS curve dose-risposta dopo le sfide sesto e settimo. Barre di errore rappresentano SEM.
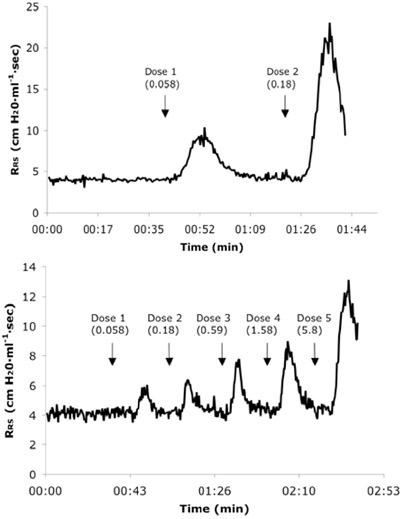
Figura 3. Rappresentante in tempo reale la resistenza del sistema respiratorio (R RS) tracciati da un allergene naïve (A) e 6X sfidato mouse (B) che ricevevano dosi consecutive IV di Ach. I valori di dose sono presentati in mg / kg unità.

Figura 4. Differenziale conta delle cellule immunitarie nei campioni di lavaggio broncoalveolare deriva dai polmoni sinistra di topi trattati con 7 sfide consecutive intranasale. Percentuale (%) abbondanza di cellule immunitarie nei topi trattati con allergene (A) o PBS (B). Numero totale delle cellule del sistema immunitario di topi trattati con allergene (C) o PBS (D). Valori rappresentati come media + / - sem.
Discussione
Lo studio di asma, e varie altre malattie ostruttive delle vie aeree, costituisce un campo attivo e in espansione della ricerca biomedica. Una componente importante di asma-correlati ricerca sperimentale è la capacità di misurare i cambiamenti nelle dimensioni delle vie aeree in condizioni variabili. Eccessivo restringimento delle vie aeree in risposta alla sfida provocatoria, una funzione canonica di asma e malattie polmonari connesse e una proprietà della iperreattività bronchiale definito delle vie aeree, è una ...
Riconoscimenti
Ringraziamo il Dott. W. Mintzer per il suggerimento di eseguire l'intubazione orotracheale a fibre ottiche. Supportato da sovvenzioni U19AI070973, R01AI057696, K02HL75243 e R01HL082487 dal National Institutes of Health.
Materiali
Fisiologia delle vie aeree di misurazione del software (Rescomp) è stata preparata su ordinazione (Millennium Premier Gruppo; 415-519-4371).
I dati sono stati analizzati utilizzando un PC con Windows XP dotato di un Pentium III CPU (Intel, Inc. Santa Clara, CA) e un 17-pin convertitore di segnale da analogico a digitale (National Instruments, # PC-LPM16).
Una piccola stazione di lavoro delle vie aeree fisiologia animale è stato assemblato su ordinazione (Millennium Premier Group) con trasduttori di pressione disponibili in commercio (parte # TRD5700 e TRD4510), moduli di preamplificatore (parte # MAX2270), telaio (parte # MAX1320, tutti da Buxco, Inc. Wilmington, NC ) e di un pletismografo personalizzato piccolo animale.
0,5 millimetri di diametro esterno in fibra ottica filo, collegato alla sorgente luminosa (Cole Illuminatore Palmer, serie 41722)
Ventilatore (Harvard Apparatus mouse Ventilatore, # 687)
10 mm, ago 27ga (BD Biosciences, cat. No. 309602)
Calore lampada
1 ml siringa (BD Biosciences, cat. No. 305109)
4 morsetti (Pony 3200 morsetto a molla)
0.5 mm esterno per la guida intubazione
Emocitometro
Superfrost / più microscopio diapositive (cat Fisher. No. 12-550-15)
Shandon Filtro Cards (Thermo cat. No. 5991022)
Cellula scivolo differenziale macchia (cat Fisher. No. 122911)
Microscopio ottico (Leica)
Cytospin 3 (Shandon)
20 ga, 1,25 pollici ProtectIV cateteri per via endovenosa (Smith Medical)
0,5 mm ottico in fibra di polimero (Edmund Optics # NT02-532).
Riferimenti
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Adler, A., Cieslewicz, G., Irvin, C. G. Unrestrained plethysmography is an unreliable measure of airway responsiveness in BALB/c and C57BL/6 mice. J. Appl. Physiol. 97, 286-292 (2004).
- Bates, J. The use and misuse of penh in animal models of lung disease. Am. J. Respir. Cell Mol. Biol. 31, 373-374 (2004).
- Lundblad, L. K., Irvin, C. G., Adler, A., Bates, J. H. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Grunig, G. Requirement for IL-13 independently of IL-4 in experimental asthma. Science. 282, 2261-2263 (1998).
- Corry, D. B. Requirements for allergen-induced airway hyperreactivity in T and B cell-deficient mice. Mol. Med. 4, 344-355 (1998).
- Corry, D. B. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J. Exp. Med. 183, 109-117 (1996).
- Amdur, M. O., Mead, J. Mechanics of respiration in unanesthetized guinea pigs. Am J Physiol. 192, 364-368 (1958).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon