È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Fotoconversione di proteine purificate fluorescenti ed evidenziazione ottica dual-sonda in cellule vive
In questo articolo
Riepilogo
Questo protocollo descrive un approccio generale per eseguire fotoconversione di proteine fluorescenti su un microscopio confocale a scansione laser. Si descrivono le modalità per la fotoconversione di campioni di proteine puried, nonché per evidenziare ottici a doppia sonda in cellule vive con mOrange2 e Dronpa.
Abstract
Photoconvertible proteine fluorescenti (pc-PQ) sono una classe di proteine fluorescenti con "ottica evidenziatore" capacità, il che significa che il colore della fluorescenza può essere cambiato l'esposizione alla luce di una specifica lunghezza d'onda. Evidenziando ottico permette la marcatura non invasiva di una sottopopolazione di molecole fluorescenti, ed è quindi ideale per il monitoraggio singole cellule o organuli.
Parametri critici per fotoconversione efficiente sono l'intensità e il tempo di esposizione della luce fotoconversione. Se l'intensità è troppo bassa, fotoconversione sarà lenta o non verificarsi affatto. D'altra parte, l'intensità troppo o troppo a lungo possibile l'esposizione photobleach la proteina e quindi ridurre l'efficienza della fotoconversione.
Questo protocollo descrive un approccio generale come impostare un microscopio confocale a scansione laser per pc-FP applicazioni fotoconversione. In primo luogo, si descrive una procedura per la preparazione di campioni di gocce di proteine purificate. Questo formato campione è molto conveniente per lo studio del comportamento fotofisiche di proteine fluorescenti al microscopio. In secondo luogo, useremo il campione goccia proteina per mostrare come configurare il microscopio per fotoconversione. E, infine, mostreremo come di evidenziare la ottici in cellule vive, inclusa l'evidenziazione ottica dual-sonda con mOrange2 e Dronpa.
Protocollo
1. Preparazione dei campioni goccia proteina fluorescente
Una goccia proteina fluorescente del campione è costituito da una emulsione 1-octanol/water con la proteina fluorescente che risiedono nella fase acquosa. Questa emulsione è inserita tra un vetrino da microscopio e un quadrato 22 mm di vetro di copertura per le applicazioni di microscopia.
- Prima di effettuare campioni goccia proteina fluorescente il vetrini e vetri di copertura devono essere puliti e rivestiti con un agente idrofobo.
- Pulire vetro lavando 5 minuti con acetone e lasciare asciugare per via aerea. (In alternativa, dopo aver pulito il vetro può essere trattato per 30 secondi e un detersivo plasma per ottenere risultati ottimali rivestimento).
- Preparare una soluzione al 2% metiltrimetossisilano in acetone e rivestire il vetro durante una incubazione di 2 minuti in questa soluzione. Dopo il rivestimento rimuovere il vetro dalla soluzione e lasciare asciugare per via aerea. Poi risciacquare con etanolo al 70% da una bottiglia spray e lasciare asciugare di nuovo. (In alternativa, a questo punto il vetro può essere cotto al forno per 1 ora a 80 ° C per collegare covalentemente il rivestimento per il vetro). Vetro rivestito può essere conservato per almeno un mese.
- Proteine fluorescenti sono purificati come Suo proteine 6-tag da E. Coli 1. Misurare lo spettro di assorbimento delle proteine purificate e preparare una diluizione stock con una densità ottica di circa 0,1 nel STE tampone (150 mM NaCl, 10 mM Tris-HCl pH 8, 1 mM EDTA), contenente 0,1% di albumina sierica bovina (BSA) . Inoltre preparare 10 ml di una miscela 1:1 di buffer di 1-ottanolo e STE in un tubo da 15 ml e mescolare energicamente. Dopo il congedo mescolando fino a quando la separazione di fase è completa. La fase superiore è l'1-ottanolo. (Attenzione: poiché 1-ottanolo ha un odore forte, è importante usare un contenitore chiuso dei rifiuti per tutto ciò che viene a contatto con l'1-ottanolo.)
- Per rendere l'emulsione pipetta 45 microlitri 1-ottanolo e 5 microlitri proteina fluorescente in una provetta per microcentrifuga. Toccare il tubo di un paio di volte con il dito per avviare la formazione di emulsione e poi sonicare il tubo per 30 secondi in un bagno di sonicazione. Nel frattempo ottiene un vetrino da microscopio rivestito e copertura in vetro pronto. Dopo sonicazione l'emulsione deve essere completamente coperto. Immediatamente dopo la sonicazione pipetta 4 emulsione microlitri a partire dalla metà del tubo su un vetrino da microscopio ricoperto e coprire con un coperchio di vetro rivestito.
- Se la procedura viene effettuata correttamente l'emulsione deve diffondersi in modo uniforme tra il vetrino da microscopio e il vetro dell'oggetto. In pochi minuti il campione deve essere stabile, composto da circa 10 micron di spessore gocce fluorescenti con diametro variabile. La più grande goccioline sono vicino al centro del campione e le più piccole sono situate più verso i bordi.
2. Impostazione di un esperimento fotoconversione
La procedura che segue è una strategia generale per la creazione di un esperimento fotoconversione proteina fluorescente. Questa procedura può essere applicata per le proteine purificate così come per le cellule vive.
- I parametri che seguono forniscono un punto di partenza generale per impostare l'esperimento fotoconversione:
40x 1.3NA olio obiettivo ad immersione
Dimensione immagine = 512 x 512 pixel
Scansione zoom = 4
Pixel tempo di permanenza = 6 msec.
Z-risoluzione (dimensione del foro stenopeico) = 3 micron - Configurare due canali di rilevazione per la fluorescenza iniziale e photoconverted, così come un "canale fotoconversione". In questo esempio useremo purificati mOrange2 proteina, che è un arancione-rosso photoconvertible proteina fluorescente. La specie arancione viene rilevato utilizzando 561 nm di eccitazione e la fluorescenza viene raccolto tra 570 nm e 630 nm. La specie photoconverted rosso viene rilevato utilizzando 633 nm di eccitazione e la fluorescenza viene raccolto tra 640 nm e 700 nm. Per il "canale fotoconversione" seleziona 488 nm di eccitazione e raccogliere la fluorescenza tra 490 nm e 540 nm. (Nota:. Immagini del canale fotoconversione non è strettamente necessario)
- Utilizzare il canale per l'imaging di fluorescenza iniziale con scansione continua per regolare la potenza del laser e rivelatore di guadagno per una qualità ottimale delle immagini.
- Attivare il canale fotoconversione e selezionare un laser a bassa potenza. Avviare una serie di immagini lasso di tempo e di aumentare gradualmente il laser fotoconversione fino significativo sbiancamento della fluorescenza iniziale si osserva. Continuare la scansione fino a quando la fluorescenza iniziale è circa il 75% sbiancato.
- Disattivare il canale fotoconversione e attivare il canale di rilevazione per la fluorescenza photoconverted. Avvio di imaging con un guadagno del rivelatore alta e potenza del laser a bassa e aumentare gradualmente la potenza del laser fino a quando la fluorescenza photoconverted viene rilevato. Una volta rilevare la fluorescenza photoconverted è possibile regolare la potenza del laser e rivelatore di guadagno per una qualità ottimale delle immagini.
- Infine, la potenza del laser utilizzatoper fotoconversione così come la durata della fotoconversione bisogno di essere ottimizzato. Aumentare la potenza del laser fotoconversione accelererà la velocità di fotoconversione, potenza del laser però troppa photobleach la proteina.
- Una volta che la potenza del laser fotoconversione ottimale e la durata sono stati determinati, questi parametri possono essere utilizzati per configurare una photobleaching standard o modulo FRAP e il "canale fotoconversione" non è più necessaria.
3. Evidenziando ottico a doppia sonda con mOrange2 e Dronpa
A causa del rosso-spostato proprietà spettrali, mOrange2 può essere utilizzato in combinazione con il verde Dronpa photoswitchable proteina fluorescente per evidenziare ottici a doppia sonda per consentire l'evidenziazione selettiva di 4 celle singole (organello) popolazioni.
- Le cellule sono coltivate in piatti con fondo trasparente MatTek e transfettate 24 ore prima immagine che utilizzano standard di trasfezione Lipofectamine2000 1.
- Impostare il microscopio per mOrange2 fotoconversione come descritto nella sezione 2.
- Configurare il microscopio per photoswitching Dronpa. Dronpa fluorescenza può essere ripreso con il mOrange2 "canale fotoconversione" (vedi punto 2.2). (Nota: Ridurre al minimo la potenza del laser utilizzato per l'imaging Dronpa, perché troppa potenza del laser provoca l'inattivazione di Dronpa.) Aggiungere un canale per fotoattivazione Dronpa. Utilizziamo 800 nm a due fotoni di eccitazione per fotoattivazione, ma in alternativa questo può essere realizzato utilizzando 405 nm di eccitazione. Determinare la potenza del laser necessaria per l'imaging, fotoattivazione e photoinactivation di Dronpa fluorescenza.
- Attenzione: fotoconversione di mOrange2 e inattivazione di Dronpa sia insorgere a seguito di eccitazione 488 nm. A causa della potenza del laser ad alta richiesta per mOrange2 fotoconversione questo sarà anche inattivare Dronpa fluorescenza. D'altra parte, l'inattivazione Dronpa avviene già in potenza del laser molto più basso e può essere eseguito senza significativi fotoconversione mOrange2.
- Una volta che i parametri per fotoconversione mOrange2 e photoswitching Dronpa sono impostati, evidenziando sonda a doppia ottica si realizza attraverso i seguenti passaggi. In primo luogo, inattivare Dronpa fluorescenza in tutto il campo di vista con bassa potenza di eccitazione 488 nm. In secondo luogo, selezionare una regione di interesse e mOrange2 photoconvert ad alto potere di eccitazione 488 nm. Infine, selezionare una regione di interesse per attivare Dronpa fluorescenza.
4. Rappresentante Risultati
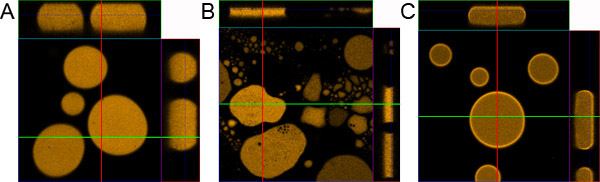
Figura 1. Droplet preparazione del campione. A) campione goccia correttamente preparati. B) del campione preparato senza rivestimento del vetrino da microscopio e vetro di copertura. C) del campione preparato senza l'aggiunta di 0,1% BSA.
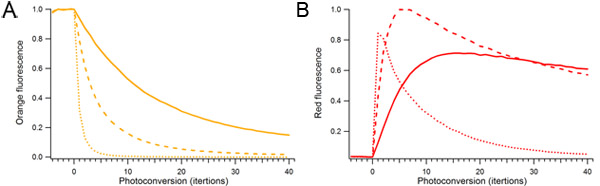
Figura 2. Effetto della potenza fotoconversione laser e la durata in mOrange2 fotoconversione. Goccioline contenenti mOrange2 singola proteina sono stati continuamente photoconverted utilizzando diverse quantità di potenza di 488 nm laser. Potenza del laser utilizzato per fotoconversione relativa era del 10% (solido), il 25% (tratteggiata), e 100% (tratteggiata). A) specie arancio fluorescente. B) Photoconverted specie rosso fluorescente.
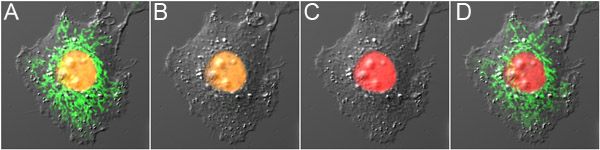
Figura 3. Evidenziando ottico a doppia sonda con mOrange2 e Dronpa. A) la cellula che esprime mOrange2-istoni H2B e Dronpa-Mito prima fotoconversione, mostrando fluorescenza arancione nel nucleo e fluorescenza verde nei mitocondri. B) Dronpa fluorescenza è stato spento con bassa potenza di eccitazione 488 nm, causando fotoconversione minimo di mOrange2. C) mOrange2 era photoconverted al rosso ad alto potere di eccitazione 488 nm. D) Dronpa fluorescenza è stata riattivata con 800 nm 2-fotone di eccitazione. I pannelli sono sovrapposizioni delle immagini a fluorescenza con l'immagine di contrasto differenziale di interferenza.
Discussione
Il campione purificato goccia proteina fluorescente è un formato di campione molto comodo per la caratterizzazione fotofisiche di proteine fluorescenti, ad esempio per studiare photobleaching cinetica e cinetica fotoconversione. Il volume delle gocce estremamente piccole (~ 20 picolitri) facilita photobleaching ed esperimenti fotoconversione, che può essere difficile da eseguire in sistemi basati cuvetta. Inoltre, come mostrato qui il campione goccia è ideale per la creazione di un microscopio confocale per le ...
Divulgazioni
Riconoscimenti
Ringraziamo Mike W. Davidson (Florida State University) per aver fornito il DNA plasmide codifica proteine fluorescenti. Questo lavoro è stato sostenuto dal National Institutes of Health concedere GM72048 (a DWP).
Materiali
| Name | Company | Catalog Number | Comments |
| Microsope slides | VWR international | 48312-003 | |
| 22 mm cover glass | Corning | 2940-245 | |
| 1-octanol | Sigma-Aldrich | O4500 | |
| methyltrimethoxysilane | Sigma-Aldrich | M6420 | |
| MatTek dishes | MatTek Corp. | P35G-1.5-14-C | |
| Lipofectamine2000 | Invitrogen | 11668-019 |
Riferimenti
- Kremers, G. J., Hazelwood, K. L., Murphy, C. S., Davidson, M. W., Piston, D. W. Photoconversion in orange and red fluorescent proteins. Nature Methods. 6, 355-358 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon