È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Produzione di transgenici Xenopus laevis Integrazione mediata da enzima di restrizione e trapianto nucleare
In questo articolo
Riepilogo
Questo protocollo video illustra un metodo per la generazione di transgenico Xenopus laevis Da introduzione di transgeni in nuclei degli spermatozoi seguita da trapianto nucleare in uova non fecondate.
Abstract
Integrazione stabile dei prodotti gene clonato nel genoma Xenopus è necessario controllare il tempo e il luogo di espressione, di esprimere i geni in fasi successive dello sviluppo embrionale, e di definire come esaltatori e promotori regolare l'espressione genica all'interno dell'embrione. Il protocollo ha dimostrato qui può essere usata per produrre in modo efficiente gli embrioni transgenici Xenopus laevis. Questo approccio transgenesi coinvolge tre parti: 1. Nuclei degli spermatozoi sono isolati da adulti X. testicolo laevis da un trattamento con lisolecitina, che permeabilizes la membrana plasmatica degli spermatozoi. 2. Estratto di uovo viene preparato mediante centrifugazione a bassa velocità, l'aggiunta di calcio a causare l'estratto per passare al interfase del ciclo cellulare, e una centrifugazione ad alta velocità per isolare citosol interfase. 3. Trapianto nucleare: i nuclei ed estrarre sono combinati con il DNA plasmidico linearizzato per essere introdotto come il transgene e una piccola quantità di enzima di restrizione. Durante una reazione di breve, estratto di uovo decondenses parzialmente la cromatina spermatica e l'enzima di restrizione genera rotture cromosomiche che promuovono ricombinazione del transgene nel genoma. I nuclei degli spermatozoi trattati vengono poi trapiantate in uova non fecondate. L'integrazione del transgene avviene di solito prima della scissione primo embrionale in modo tale che gli embrioni risultanti non sono chimerici. Questi embrioni possono essere analizzati senza necessità di allevare alla prossima generazione, permettendo per la generazione efficiente e rapido di embrioni transgenici per la ricerca di promotore e funzione del gene. Adulti X. laevis risultante da questa procedura anche propagare il transgene attraverso la linea germinale e può essere utilizzato per generare linee di animali transgenici ai fini multipli.
Protocollo
Versioni modificate di questo approccio sono stati inizialmente transgenesi cui ai punti 1 e 2.
A. sperma preparazione nuclei
Questo metodo di preparazione dei nuclei è adattato da Murray 3, ma gli inibitori della proteasi sono stati omessi in quanto interferiscono con conseguente sviluppo di uova trapiantati con i nuclei degli spermatozoi. Aliquote sono congelati a -80 ° C e può essere utilizzato per trapianti per circa 6 mesi.
Tutte le soluzioni devono essere preparati ed immessi sul ghiaccio prima di iniziare la preparazione.
- Anestetizzare 1-2 maschio adulto X. laevis per immersione in Tricaine per almeno 20 minuti seguita da enervazione; rimuovere i testicoli.
- Lancia i testicoli su un tovagliolo di carta per rimuovere il sangue, i vasi sanguigni e del grasso corporeo, lavarli brevemente in un piatto 60 millimetri Petri contenenti 1XMMR, e rimuovere eventuali ulteriori pezzi di grasso corporeo. Fare attenzione a non forare i testicoli, in quanto questo rilascia lo sperma.
- Trasferimento testicoli ad una secca di 60 mm piastra di Petri e testicoli macerare con le pinze fino a quando non ci sono pezzi visibili. Macerazione dovrebbe essere fatto nel miglior modo possibile ottenere rendimenti elevati dei nuclei.
- Aggiungi 2mLs tampone a freddo preparazione nucleare (NPB; 1X a magazzino) per il macerato e delicatamente pipetta su e giù.
- Macerare Bagnate con circa 4 spessori di garza in un imbuto, raccogliendo in un tubo da 15 ml (per esempio Falcon 2059); Sciacquare piatto con 8mLs di NPB e mettere questo risciacquare attraverso la garza, raccogliendola in tubo. Con le mani guantate spremere la garza per raccogliere il liquido restante nel tubo.
- Pellet lo sperma a 3000 rpm per 10 min. a 4 ° C in un rotore oscillante (1480g per esempio in un HB-4 rotore Sorvall o equivalente) con le schede tubo appropriato. Decantare il surnatante, aggiungere NPB 8ml di questo tubo e la pipetta su e giù con una pipetta 10 ml per sospendere di nuovo pellet; Spin di nuovo come sopra e decantare il surnatante. Equilibrare 1 ml di NPB a temperatura ambiente durante la centrifuga.
- Risospendere il pellet in 1 ml NPB temperatura ambiente con un 1 mL pipetteman punta, aggiungere 50μl di lisolecitina 10mg/ml appena fatto, mescolare delicatamente e incubare per 5 minuti. a temperatura ambiente.
- Aggiungere 10 ml di BSA freddo 1XNPB +3% per il tubo per fermare la reazione lisolecitina, mescolare delicatamente e spin down per 10 min a 3000 rpm in un rotore oscillante. Decantare il surnatante. Il lisolecitina trattati con pellet dovrebbe guardare un po 'più trasparenti (meno bianco opaco) di quanto abbia fatto prima del trattamento lisolecitina.
- Decantare il surnatante e risospendere pellet in 5 ml freddo NPB +0,3% BSA, mescolare delicatamente con una pipetta da 10 mL e spin giù per 10 minuti a 3000rpm come sopra.
- Decantare il surnatante e risospendere pellet in 500μl di tampone sperma memorizzazione e il trasferimento in una provetta da 1,5 ml. Questo è ora il tuo magazzino nuclei. Memorizzare sul ghiaccio mentre si controlla la resa dei nuclei.
- Per controllare il rendimento dei nuclei, posto 98 ml di tampone di diluizione dello sperma (SDB), 1 l di stock nucleare e 1ml della diluizione 1:100 dello stock Hoechst in un tubo Eppendorf 1,5 ml. Mescolate il brodo nucleare molto bene con un rasoio-tagliata (o grande apertura) puntale poco prima di rimuovere il 1 ml. Mescolare il diluito SDB / Hoechst / nuclei molto bene e lasciare una piccola quantità di flusso nella camera di un emocitometro migliorato Neubauer per azione capillare. Contare i nuclei in una piazza del emocitometro sotto un microscopio composto. Da un maschio, si dovrebbe ottenere conteggi di almeno 100-200 (X10 4 cellule / ml) per questa diluizione 1:100 dello stock di magazzino non diluito una concentrazione di 1-2X10 5 cellule / ml. Se il titolo è meno concentrato, lascia i nuclei accontentarsi di diverse ore, rimuovere alcune delle surnatante, e raccontare. Lasciare i nuclei a 4 ° C durante la notte per permettere al glicerolo di penetrare per una migliore crioconservazione, poi mescolare il brodo nucleare e con una punta grande orifizio pipetta, preparare aliquote di 20μl, e congelare in azoto liquido.
B. Preparazione di estratto di High Speed
Questo metodo è adattato da Murray 3 e produce un estratto citosolico interfase che promuoverà decondensazione cromatina gonfiore e parziale dei nuclei degli spermatozoi aggiunto. Estratto può essere congelata in piccole aliquote a -80 ° C e scongelato prima dell'uso.
- 3-5 giorni prima iniezione di HCG, primo 8-12 femmina adulta X. laevis iniettando 50 U di PMSG nel sacco linfatico dorsale. La sera prima della preparazione estrarre, iniettare ogni rana con 500 unità di HCG e posto 2 rane / recipiente in 2 1XMMR litri. Dal momento che una rana con lisi o attivando le uova possono compromettere la preparazione dell'estratto, si consiglia di separare le rane in coppie per l'ovulazione.
- La mattina dopo, preparare e chill tutte le soluzioni prima di iniziare la preparazione. Delicatamente, manualmente espellere uova di rana in ogni b grandeeakers contenente 1X MMR. Schermo le uova di ciascun serbatoio e omettere qualsiasi lotti di uova con segni di chiazzatura, lisi o l'attivazione (visualizzati mediante contrazione di pigmentazione nell'emisfero animale) dalla procedura. Raccogliere uova ininterrotta anche con pigmentazione. Uova bene può anche essere raccolti presso l'MMR 1X nei secchi rana. Il volume totale delle uova dovrebbero essere> 100 ml dal 8-12 femmine.
- De-gelatina le uova. Per fare questo, MMR rimuovere il più possibile, aggiungere una piccola quantità di soluzione di cisteina, e agitare le uova. Sostituire con una soluzione cisteina fresca più volte nel corso de-gelificante. De-gelatina per ogni partita di uova a parte ed eliminare i lotti con la rottura o l'attivazione uovo. Combina il resto delle uova.
- Lavare le uova quattro volte in ~ 35 mL di tampone estratto (XB), e poi due volte in 25 ml di CSF-XB con inibitori della proteasi.
- Per imballare le uova: trasferire le uova in Beckman tubi UltraClear. Lasciare le uova di stabilirsi. Rimuovere il più CSF-XB possibile. Centrifugare le uova con un Beckman SW 40 Ti rotore (rotore o simili) a 1000 giri (150 g) per ~ 60 sec a 4 ° C. Rimuovere la soluzione in eccesso dalla parte superiore delle uova imballate.
- Di schiacciare le uova e generare estratti citoplasmatici: centrifuga le uova a 10.000 giri (16.000 g) per 10 minuti a 4 ° C. Le uova devono essere separati in tre strati: lipidico (in alto), citoplasma (al centro), e il tuorlo (in basso). Raccogliere lo strato citoplasmatico da ciascuna provetta con un ago calibro 18 inserendo l'ago attraverso il tubo alla base dello strato di citoplasma. Trasferire il citoplasma di un nuovo tubo UltraClear Beckman sul ghiaccio.
- Aggiungi inibitori della proteasi al citoplasma isolati ad una concentrazione finale di 1X. Recentrifuge il citoplasma a 16.000 g per 10 minuti a 4 ° C. Raccogliere il citoplasma ha chiarito come descritto sopra. Si aspettano di ottenere 0,75-1 citoplasma ml / rana.
- Aggiungere 1 / 20 del volume estratto del mix energetico per il campione. Trasferire il citoplasma in parete spessa tubi in policarbonato per il TL-100 Beckman ultracentrifuga. Tubi di contenere circa 3 ml ciascuna e dovrebbero essere almeno mezzo pieno.
- Aggiungere 1 M CaCl 2 a ciascun tubo per una concentrazione finale di 0,4 mm. Incubare le provette per 15 minuti a temperatura ambiente. Questo inattiva CSF e spinge l'estratto in interfase.
- Equilibrio i tubi e centrifuga in un TL-100 Beckman ultracentrifuga con un 100,3 TLA-rotore di 70.000 giri al minuto (200.000 g) per 1,5 ore a 4 ° C. Il citoplasma si frazionano in quattro strati, dall'alto verso il basso: lipidi, citosol, membrana / mitocondri, glicogeno e / ribosomi.
- Rimuovere lo strato citosolico da ogni tubo (~ 1 mL se 2-3 mL è stato caricato nel tubo) con l'inserimento di una siringa nella parte superiore del tubo attraverso lo strato lipidico. Trasferire la frazione citosolica ai tubi fresco e recentrifuge i campioni di 70.000 giri al minuto (200.000 g) per 20 minuti a 4 ° C.
- Aliquota del supernatante in 25 microlitri aliquote di 0,5 mL tubi. Quick-congelare le aliquote in azoto liquido e conservare a -80 ° C fino al momento dell'uso. Per determinare se l'estratto è efficace, i nuclei degli spermatozoi può essere incubate in estratto e colorati con Hoechst per determinare se i nuclei visibilmente gonfia (addensare e allungare) entro 10 min Oltre a temperatura ambiente.
C. reazione Transgenesi e trasferimento nucleare
Importante: Verificare che le soluzioni, le attrezzature e le rane sono tutte pronte prima di iniziare una reazione. Una volta iniziato, è necessario procedere con la reazione con il calendario approssimativo descritto di seguito, dal momento che molti componenti non rimangono stabili per> 30 minuti. Mentre lo stock nuclei degli spermatozoi è tenuta in ghiaccio, reazioni transgenesi (sia diluito e concentrato), deve essere conservato a temperatura ambiente.
- Primo rane femminile. La sera prima transgenesi, iniettare diversi (3-5) rana femmine adulte con 800 unità di HCG nel sacco linfatico dorsale di ottenere appena uova deposte a partire dal giorno successivo.
- Il giorno della procedura di transgenesi, preparare o portare a temperatura le soluzioni necessarie per la transgenesi:
- Cisteina appena fatto (2,5% nel 1XMMR, pH8.0). Avrete bisogno di diverse centinaia di millilitri per essere utilizzato in quel giorno.
- 0.2XMMR Ficoll +6% per i piatti trapianto e recupero degli embrioni transgenici e 0.2XMMR 100 mg / mL di gentamicina (senza Ficoll) per la raccolta embrioni. Le soluzioni non dovrebbero essere più caldo di 18-21 ° C e gli embrioni transgenici dovrebbe essere raccolto attraverso spaccature primi a temperature tra i 16 ei 21 ° C, in quanto temperature più elevate influenzare negativamente sia la frequenza di transgenesi e di sviluppo embrionale.
- Scongelare e portare a temperatura ambiente aliquote congelate di SDB (tampone di diluizione dello sperma) per trapianti del giorno, scongelare l'estratto ad alta velocità e posizione sul ghiaccio, e preparare una soluzione 100mM MgCl 2.
- Uscire °e piatti di iniezione agarosio e riempire con MMR / Ficoll soluzione, e impostare e pre-far funzionare la pompa di infusione per stabilizzare il flusso.
- Controllare che le rane femmine sono posa e le uova sono di alta qualità. In modo ottimale, le uova devono avere una corteccia ditta (mantenere la forma dopo la de-gelificante).
- Impostare una reazione transgenesi:
- Molto delicatamente (utilizzando un puntale spuntati), mescolare lo stock di nuclei e si combinano in un tubo Eppendorf 1,5 ml:
Nuclei 4μl (~ 4-8X10 5 nuclei)
2μl plasmide linearizzato (100ng/μl)
Incubare 5 minuti a temperatura ambiente. - mentre l'incubazione sta procedendo, diluire 0.5μl di enzima di restrizione in 4.5μl H 2 O e aggiungere 1ml di enzima diluito a 18μl di SDB, 2μl di MgCl 2 e 2μl di estratto ad alta velocità. Aggiungere questa miscela ai nuclei-plasmide reazione. Incubare 10 minuti a gonfiare i nuclei.
- Durante questa incubazione, spremere le uova 2-3 rane e de-gelatina in soluzione cisteina. Lavare bene (5X) con 1XMMR, e utilizzare una pipetta ampio foro di trasferire 400-500 uova per ogni piatto dejellied agarosio contenente ben 0,2 X Ficoll MMR +4%. Questo richiede di solito circa 10 minuti, così una volta base di uova sono preparati la reazione di solito è pronta a diluire.
- Circa 15-20 minuti dopo l'inizio del passaggio a, mescolare delicatamente la reazione (nuclei / estratto / DNA) con una punta tagliata e aggiungere circa 5μl a 150 microlitri SDB a temperatura ambiente. Nuclei in questa miscela diluita è stabile per circa 1 ora., Mentre non mantengono la capacità di trapianto del tempo se lasciati nella miscela concentrata.
- Molto delicatamente (utilizzando un puntale spuntati), mescolare lo stock di nuclei e si combinano in un tubo Eppendorf 1,5 ml:
- Caricare l'ago: Mescolare la reazione diluita, preparata in precedenza molto delicatamente con una punta larga pipetta orifizio, quindi caricare l'ago tempestivamente, come nuclei si depositerà rapidamente nel tubo. A ritardare l'ago, inserire un pezzo di tubo Tygon bene alla fine di una punta tagliata pipetta 200μl. Aspirare la soluzione nella punta della pipetta, quindi collegare il tubo per l'ago e lasciare la soluzione di inserire l'ago per gravità o delicatamente lo stantuffo della pipetta.
- Collegare l'ago a pompa tubi e iniziare a trapianti di nuclei. Le iniezioni devono essere rapido, poco profondo e approssimativamente perpendicolare alla membrana plasmatica dell'uovo per evitare di fare danni. Al ritmo del flusso suggerito (10nl/sec), tenere l'ago nell'uovo per ~ 0,5 secondi. È necessario completare 1-2 piatti di trapianti in 20-30 minuti.
Dopo le iniezioni, lasciare i piatti a 16-20 ° C fino a quando gli embrioni hanno raggiunto la fase delle cellule 4-8. Ordina gli embrioni scissione lontano dai loro vicini non-scissione con il trasferimento (con una pipetta Pasteur di vetro con una punta approssimativamente lo stesso diametro di un uovo) per un piatto fresco grande di Ficoll 0.2XMMR +4%. Suddividere gli embrioni scissione in piccoli gruppi (10-15 embrioni / pozzetto di una piastra ben 6) e la cultura in 0.2XMMR (non Ficoll) 100 mg / mL di gentamicina attraverso lo sviluppo precoce. Gli embrioni devono essere controllati durante la gastrulazione con tutti gli embrioni muoiono rimosso prontamente e dei media cambiato, se necessario.
Risoluzione dei problemi:
- Ago è bloccato: soluzione di flusso da l'ago dovrebbe essere evidente durante il trapianto. Se l'ago viene bloccato da particelle visibili, modificare aghi o tenta di rimuovere i detriti dal taglio della punta con una pinza e spingendo la soluzione attraverso l'ago.
- Senza uova scissione si ottengono: controllare che diluizioni dei nuclei degli spermatozoi e del volume di iniezione sono appropriati e che l'ago non è stato bloccato durante il trapianto. Se il volume di iniezione è troppo alto, le uova possono anche non aderire e mostrare invece pigmentazione scolorita o danni.
- Molti embrioni muoiono durante gastrulazione. Diversi fattori possono aumentare la sopravvivenza dell'embrione:
- prendersi cura con i nuclei durante la preparazione e la reazione enzimatica. Nuclei Decondensed sono fragili e devono essere trapiantate con gli orari di cui sopra. Non disporli sul ghiaccio.
- Il danno cromosomico sostenuti dai nuclei degli spermatozoi durante la reazione enzimatica e trasferimento nucleare riguarda sia la frequenza di transgenesi e il normale sviluppo degli embrioni. Danno cromosomico ai nuclei migliora l'efficienza della transgenesi, ma influenza negativamente la sopravvivenza / sviluppo normale. Diminuzione o omettendo enzima di restrizione durante l'incubazione enzima può aumentare il tasso di sviluppo normale, ma può diminuire la frequenza della transgenesi o del numero di copie plasmide introdotto nel genoma dell'embrione.
- Se in ritardo blastula attraverso embrioni gastrula mostrare segni di scolorimento o morte cellulare è anche possibile che un reagente utilizzato per il trapianto è tossico per le uova. Inoltre, se uovos non hanno una corteccia ferma, essi possono sottoporsi exogastrulation e non riescono a generare normale post-gastrula embrioni.
- Il numero di embrioni che esprimono il transgene è basso. Aumentare la quantità di enzima di restrizione.
Risultati rappresentante degli embrioni transgenici
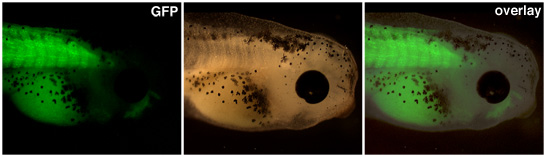
Embrioni transgenici in seguito a trasferimenti nucleari dovrebbe essere sollevata fino a quando l'espressione dal promotore di interesse è visibile. Nella Figura 1, un promotore actina muscolo unità espressione della proteina fluorescente verde in somiti di questo girino transgenici.
Access restricted. Please log in or start a trial to view this content.
Discussione
Per ciascun costrutto transgenico da testare, in genere trapianto nuclei in 500-1000 uova; a questa scala, possiamo generare embrioni transgenici che esprimono fino a 10 diversi costrutti al giorno, a seconda di quante donne sono indotte a deporre le uova. Di questi trapianti, circa un terzo dei fendere uova e 60-80% di questi embrioni scissione procedere attraverso gastrulazione normalmente. A seconda delle condizioni di reazione utilizzate, tra 10-50% di questi embrioni esprimono il transgene di interesse. Pertanto, u...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli esperimenti sugli animali sono stati eseguiti secondo le linee guida e regolamenti stabiliti dalla cura degli animali e utilizzo Comitato presso la Washington University School of Medicine.
Riconoscimenti
Finanziamenti per il nostro lavoro è fornito dalla NIH, il March of Dimes, e l'American Cancer Society.
Access restricted. Please log in or start a trial to view this content.
Materiali
A. sperma preparazione nuclei
Reagenti:
- 1X MMR (2mm CaCl 2, HEPES 5mm, pH7.5, 2mM KCl, 1 mM MgCl 2, 100mM NaCl).
- 0,1% Tricaine metanosolfonato (MS222, aminobenzoico di etile, Sigma A-5040), bicarbonato di sodio 0,1%. Sciogliere in acqua.
- 2X Burro Preparazione nucleare (NPB). Il giorno della preparazione nuclei degli spermatozoi, costituiscono il 30 ml di NPB 2X parti aliquote delle soluzioni madre conservati congelati: 500 mM saccarosio (1,5 stock M), 30 mM HEPES (stock 1M, titolare con KOH in modo che il pH 7.7 è in 15 mm), 1 mM spermidina trihydrochloride (Sigma S-2501, 10 magazzino mM), 0,4 mM tetraidrocloruro spermina (Sigma S-1141, 10 magazzino mm), 2 mM ditiotreitolo (Sigma D-0632; magazzino 100 mm), 2 mM EDTA (500 mM EDTA, pH 8,0).
- Utilizzare il 2XNPB fare a. 30ml 1X NPB, b. 10ml 1XNPB +3% BSA (frazione V, Sigma A-7906), c. 5ml 1XNPB BSA +0,3%.
- Lysolecithin: 100 ml di 10 mg / ml L-α-LYSO-lecitina, tuorlo d'uovo (Calbiochem, 440154); sciogliere a temperatura ambiente prima dell'uso. Conservare magazzino solido a 20 ° C. Eliminare la polvere di magazzino se diventa appiccicoso.
- Albumina sierica bovina (BSA): 10% (w / v) di BSA (frazione V, Sigma A-7906) Portare 5 ml di acqua il giorno della preparazione nuclei degli spermatozoi.
- Spermatozoi di accumulo (1ml) 1X NPB, 30% glicerolo, 0.3% BSA.
- Spermatozoi tampone di diluizione: 250 mM saccarosio, 75 mM KCl, 0,5 trihydrochloride spermidina mM, 0,2 mM tetraidrocloruro spermina. Titolare a pH 7,3-7,5 e memorizzare 0,5-1 aliquote ml a 20 ° C.
- Hoechst n. 33342 (Sigma B-2261): 10 mg / ml di brodo in dH 2 O, conservare in un recipiente stretto luce a 20 ° C.
Attrezzatura:
- Rotore oscillante e centrifuga
- buratto
- strumenti di dissezione (pinze e forbici)
- microscopio a fluorescenza
- imbuto
- guanti
- emocitometro
- aghi (26 gauge)
- asciugamani di carta
- capsule di Petri (60 mm)
- pipette
- plastica (5 e 10 ml)
- Pipetman punte (1 ml e 200μl)
- Siringhe (1 ml)
- Tubi (14 ml, Falcon, 2059)
- Tubi
- microcentrifuga (1,5 ml)
B. Preparazione di estratto di High Speed
Reagenti:
- 1X Marc modificato Ringer (MMR): 100 mM NaCl, 2 mM KCl, 1 mM MgCl 2, 2 mM CaCl 2, 5 HEPES mM, pH 7,5. Preparare uno stock 10X, e regolare il pH con NaOH a 7,5.
- 20X tampone Estratto (XB) magazzino di sale: 2 M KCl, 20 mM MgCl 2, 2 mM CaCl 2, filtro-sterilizzare e conservare a 4 ° C.
- Estratto di buffer (XB, appena preparato e memorizzato sul ghiaccio): 1X sali XB, 50 mM saccarosio, HEPES 10mM (1 magazzino M, titolato con KOH in modo che il pH è di 7,7 se diluito a 15 mm, filtro-sterilizzare e conservare in aliquote a 20 ° C). Preparare circa 100 ml.
- 2% (w / v) L-cisteina cloridrato 1-idrato: Made in 1X sali XB prima dell'uso e titolata a pH 7.8 con NaOH. Preparare circa 300 ml.
- CSF-XB: 1X sali XB, 1 mM MgCl 2 (oltre a MgCl 2 presente nel sali XB; concentrazione finale di 2 mm), 10 HEPES mM, pH 7,7, 50 mM saccarosio, 5 mM EGTA, pH 7.7. Preparare 50 ml.
- Inibitori della proteasi: Miscela di leupeptina, chimostatina, e pepstatina, ogni sciolto a una concentrazione finale di 10 mg / ml in dimetilsolfossido (DMSO). Conservare in piccole aliquote a 20 ° C.
- 1 M CaCl 2.
- Mix energetico: 150 creatina fosfato mm, 20 mm ATP, 20 mM MgCl 2.
- Incinta Mare Serum gonadotropina (PMSG): 100 U / ml PMSG (PG600 ®, Intervet, Inc., 021.825). Sciogliere in acqua e conservate a 20 ° C.
- Gonadotropina corionica umana (HCG): 1000 U / ml HCG (CHORULON ®, Intervet, Inc., 057.176). Sciogliere in acqua e conservato a 4 ° C.
Attrezzatura:
- Xenopus laevis femmine
- Aghi (18 e 26 gauge)
- Pipetta Pasteur
- ampio foro
- Siringhe (1 ml)
- Tubi, microcentrifuga (0,5 ml)
- Tubi, pareti spesse policarbonato (Beckman, 349622)
- Tubi, UltraClear (14 x 95 mm; Beckman, 344060)
- Ultracentrifuga e rotori (ad esempio, Beckman TL-100 con rotore SW 40 TLA-Ti e 100,3)
- Bicchieri per la raccolta delle uova
- Secchi o contenitori per lo svolgimento di rane femmine (ad esempio, 4-L bicchieri di plastica con coperchi a rete).
C. nucleare trapianto.
Reagenti:
- 2,5% di agarosio in 0.1XMMR (per fare i piatti iniezione)
- 2,5% cisteina in 1XMMR, PH8.0, preparato nel giorno di utilizzo
- Ficoll
- 10 mg / ml di gentamicina (stock 1000X)
- alta uovo estratto di velocità (vedi sopra)
- 100 MgCl 2
- MMR 10X (vedi sopra)
- Restrizione enzimatica (ad es Noti dal New England Biolabs)
- Tampone di diluizione dello sperma (SDB, vedi sopra) e nuclei degli spermatozoi (vedi sopra)
- Gonadotropina corionica umana (HCG) come sopra
- olio minerale (Sigma, M8410)
- Plasmide linearizzato per essere introdotto come il transgene: Preparare plasmide linearizzato ad una concentrazione di circa 100 ng / mL in sterili, acqua priva di nucleasi (evitiamo di Tris ed EDTA contenenti buffer, che sono un po 'tossico per gli embrioni). L'enzima di restrizione utilizzato per linearizzare il plasmide non deve essere lo stesso di quello utilizzato nella reazione di trasferimento nucleare. Noi di solito utilizzare Noti per tutte le reazioni, indipendentemente da ciò che è plasmide linearizzato con. Alcuni di calibrazione della diluizione degli enzimi utilizzati nella reazione può essere necessario, enzimi come troppo può causare effetti negativi sulla post-gastrula sviluppo. Plasmide può essere purificato in diversi modi: siamo soliti utilizzare il kit di purificazione QIAquick Qiagen PCR secondo le indicazioni fabbricanti; purificazione di una singola banda da un gel non è necessario. Se il plasmide viene potabilizzata con fenolo / estrazioni cloroformio e precipitazione in etanolo, essere certi di rimuovere tutte le tracce di sostanze organiche ed etanolo.
Attrezzatura:
Piatti agarosio iniettabile: In un piatto di plastica 60 millimetri di Petri, giaceva un piccolo 35mmX35mm pesano in barca sul fuso 2,5% di agarosio in 0.1XMMR acqua per creare una depressione con un agarosio rivestite fondo per il riempimento con le uova. Una volta agarosio si è solidificato, avvolgere in parafilm e conservare a 4 ° C fino all'uso. Fanno 2-3 piatti in anticipo per ogni reazione transgenici avete intenzione di fare.
Pompa di infusione: Usiamo un solo pompa per infusione siringa da Harvard Apparatus, dotato di una siringa da 3 cc / ago riempito con olio minerale (Sigma M-8410). Smussato la punta dell'ago della siringa (per evitare che la perforazione del tubo) e collegare il tubo Tygon multa. Funzionare la pompa a ~ 10nl/sec, questo presuppone che il tempo l'ago è in ogni uovo sarà non superiore a 1 sec. Pompa deve essere pre-corsa per diversi minuti prima di transgenesi di partenza per il giorno per assicurare che il pistone per la siringa è a filo con il pistone e questo flusso costante positiva di olio dal tubo è in corso.
Aghi per i trasferimenti nucleari. Con un estrattore micropipetta, generare con aghi lunghi, punte inclinata. Clip di questi con una pinza sotto un microscopio da dissezione dotato di un micrometro oculare per ottenere l'apertura di 80 micron ~ con una forma smussata.
Altre dotazioni: Xenopus laevis femmine, stereomicroscopio, incubatore, micromanipolatore, l'ago estrattore microiniezione (es. modello P-87, Sutter), aghi di siringa (26 gauge), aghi microiniezione di vetro, micrometro oculare per il clipping calibrata di punte ad ago microiniezione di diametro 80μm, capsule di Petri, pesare barche 35mm, tubi Tygon (ID = 1 / 32 pollici, OD = 3 / 32 pollici)
Riferimenti
- Kroll, K. L., Amaya, E. Transgenic Xenopus embryos from sperm nuclear transplantations reveal FGF signaling requirements during gastrulation. Development. 122, 3173-3183 (1996).
- Amaya, E., Kroll, K. L. A method for generating transgenic frog embryos. Methods Mol Biol. 97, 393-414 (1999).
- Murray, A. W. Cell cycle extracts. Methods Cell Biol. 36, 581-605 (1991).
- Hartley, K. O., Hardcastle, Z., Friday, R. V., Amaya, E., Papalopulu, N. Transgenic Xenopus embryos reveal that anterior neural development requires continued suppression of BMP signaling after gastrulation. Developmental Biology. 238, 168-184 (2001).
- Karaulanov, E., Knöchel, W., Niehrs, C. Transcriptional regulation of BMP4 synexpression in transgenic Xenopus. EMBO J. 23, 844-856 (2004).
- Ogino, H., Fisher, M., Grainger, R. M. Convergence of a head-field selector Otx2 and Notch signaling: a mechanism for lens specification. Development. 135, 249-2458 (2008).
- Taylor, J. J., Wang, T., Kroll, K. L. Tcf- and Vent-binding sites regulate neural-specific geminin expression in the gastrula embryo. Developmental Biology. 289, 494-506 (2006).
- Marsh-Armstrong, N., Huang, H., Berry, D. L., Brown, D. D. Germ-line transmission of transgenes in Xenopus laevis. Proceedings of the National Academy of Sciences of the United States of America. 96, 14389-14393 (1999).
- Offield, M. F., Hirsch, N., Grainger, R. M. The development of Xenopus tropicalis transgenic lines and their use in studying lens developmental timing in living embryos. Development. 127, 1789-1797 (2000).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon