Method Article
Visualizzazione e quantificazione delle interazioni intracellulari di Neisseria meningitidis E umano α-actinina da Imaging confocale
In questo articolo
Riepilogo
Neisseria meningitidis (Nm), un grammo negativo umano-specifici patogeni respiratori, possono legarsi ai umano α-actinina. Qui vi presentiamo un protocollo per la visualizzazione di colocalisation del batterio intracellulare con α-actinina dopo l'entrata batteriche nelle cellule umane endoteliali microvascolari cerebrali (HBMECs).
Abstract
La proteina Opc di Neisseria meningitidis (Nm, meningococco) è una superficie espressa proteina integrale della membrana esterna, che può agire come adesina e un invasin efficace per cellule epiteliali ed endoteliali. Abbiamo identificato endoteliali superficie situata integrine come recettori importanti per Opc, un processo che richiede Opc di legarsi prima a ligandi dell'integrina come vitronectina e tramite questi alla cella-espresso recettori 1. Questo processo porta ad invasione batterica delle cellule endoteliali 2. Più di recente, abbiamo osservato una interazione di Opc con una proteina 100kDa trovato nei lisati cellulari totali di cellule umane 3. Inizialmente abbiamo osservato questa interazione quando le proteine della cellula ospite separati mediante elettroforesi e cancellati a nitrocellulosa sono stati sovrapposti con Opc che esprimono Nm. L'interazione è diretta e non coinvolgono le molecole intermedie. Mediante spettrometria di massa, abbiamo stabilito l'identità della proteina α-actinina. Poiché non sono superficie espressa α-actinina è stato trovato su una delle linee di cellule otto esaminati, Opc e le interazioni con le cellule endoteliali in presenza di piombo nel siero all'ingresso batteriche nelle cellule bersaglio, abbiamo esaminato la possibilità che le due proteine interagiscono intracellulare. Per questo, colta cervello umano le cellule endoteliali microvascolari (HBMECs) sono stati infettati con Opc, che esprimono Nm per lunghi periodi e le località di batteri internalizzati e α-actinina sono stati esaminati al microscopio confocale. Abbiamo osservato tempo-dipendente aumento della colocalisation Nm con le proteine del citoscheletro, che è stato notevole dopo un periodo di otto ore di internalizzazione batterica. Inoltre, l'uso di software di imaging quantitativa ci ha permesso di ottenere una misura relativa della colocalisation di Nm con α-actinina e di altre proteine del citoscheletro. Qui vi presentiamo un protocollo per la visualizzazione e la quantificazione delle colocalisation del batterio con le proteine intracellulari dopo l'entrata batterica in cellule endoteliali umane, anche se la procedura è applicabile anche alle cellule epiteliali umane.
Protocollo
1. Immunofluorescenza protocollo
Semina, infezione e immuno-colorazione
Le seguenti procedure richiedono idoneo livello di cultura della sicurezza dei tessuti e le strutture di laboratorio microbiologico.
GIORNO 1
A. Preparazione delle cellule bersaglio per l'infezione
- HBMECs seme al 50% confluenza (~ 1.5x10 4 celle / cm 2) sul vetro coprioggetto (16 mm di diametro) inserito in un 12-pozzetti (3,8 cm 2 area di crescita / pozzetto).
Terreno di crescita: RPMI 1640 integrato con il 15% di siero (56 ° C, 30 min) FBS, 2 mM glutamina, 1 mM sodio piruvato, 100 U / mL di penicillina / streptomicina, 1% (v / v) MEM aminoacidi non essenziali acidi soluzione e l'1% MEM soluzione di vitamine. - Cultura per tutta la notte (O / N) a 37 ° C, in un 5% di CO 2 incubatore.
B. coltura batterica
- Crescere il ceppo di interesse di O / N (16-18 h) sul richiesto Infusion ad esempio Cuore medio Cervello (BHI) piastre di agar integrato con il 10% sangue di cavallo riscaldata a 37 ° C in 5% CO 2 nell'atmosfera 4.
2 ° GIORNO
Preparazione A. Di batterica (N. meningitidis) Sospensione
- Utilizzando un loop 10 microlitri cultura, fare una sospensione della cultura durante la notte batterica in 2 ml generiche su baja california (PBS con calcio e magnesio).
- Consentire grossi aggregati batterici per risolvere lasciando la sospensione per 5 minuti a temperatura ambiente (RT).
- Senza disturbare il pellet, trasferire l'1 ml della sospensione (stock inoculo) in una provetta sterile.
- Per stimare i numeri batterica dell'inoculo magazzino, aggiungere aliquote (20-50 mL) di provette contenenti volumi di 1 ml di 1% SDS a 0,1 M NaOH e mescolare delicatamente per solubilizzare.
- Misurare il contenuto di acido nucleico della soluzione determinando l'assorbanza a 260 nm (A260). Nelle nostre mani, A260 di 1 corrisponde a 5x10 8 unità formanti colonie / ml (ufc / ml). Questo può essere verificato preparando una serie di diluizioni del inoculo stock in generiche su baja california, placcatura su piastre di agar e il conteggio colonie dopo O / N incubazione.
- Diluire una parte dell'inoculo magazzino nel medio infezione [(M199 integrata con il 2% decomplemented (56 ° C, 30 min) nel siero umano normale (SSN)] per ottenere la densità richiesta per l'infezione batterica delle cellule bersaglio.
- Nel nostro laboratorio, un rapporto di infezione di 200-300 batteri per cella di destinazione viene utilizzato di routine.
B. infezione delle cellule Cultura
- Lavare i coprioggetti in coltura con cellule bersaglio tre volte con mezzo di Hank per rimuovere ogni traccia di antibiotici.
- Infettare le cellule preparati al momento con sospensioni batteriche (descritto sopra) per 3 ore a 8 ore a 37 ° C, nel 5% di CO 2.
- Al termine del periodo di infezione, le cellule lavare tre volte con PBS e fissare in 500 ml di 2% paraformaldeide (PFA) per 30-45 minuti a temperatura ambiente o O / N a 4 ° C.
- Fissazione paraformaldeide alla concentrazione e il tempo sopra indicato è stato ritenuto idoneo per la conservazione della morfologia batterica e cellulare.
- Dopo il lavaggio off paraformaldeide, permeabilise la paraformaldeide-cellule fissate incubando a 0,1% Triton X-100 diluito in PBS per 10 min.
- Lavare i campioni 3 volte con PBS.
- Procedere alla colorazione immuno-o, in alternativa, lasciare i campioni in 500 ml di 1% BSA / PBST O / N a 4 ° C.
3 ° GIORNO
Immuno-colorazione
Colorazione dei batteri intracellulari e α-actinina possono essere eseguite in sequenza o simultaneamente con l'uso di appropriati anticorpi primari e secondari come segue: tutte le procedure possono essere eseguite in 12-pozzetti.
- Blocca i coprioggetti contenente le cellule permeabilised con 500 ml di 3% BSA / PBST (PBS contenente 0,05% Triton X-100) per 30-60 min a RT
- Dopo il lavaggio con PBS, il trasferimento di ogni coprioggetto di un nuovo pozzo secco in 12-pozzetti.
- Aggiungere gli anticorpi primari contro i batteri e α-actinina; ottanta a 100 l di anticorpi per coprioggetto è sufficiente aggiunto attentamente per coprire la superficie del vetrino. Incubare per 1 ora a temperatura ambiente.
- Abbiamo usato antisiero policlonale di coniglio contro la Neisseria meningitidis (laboratorio-raise) e anticorpi murini monoclonali (mAb) contro α-actinina (Abcam) contemporaneamente. In alcuni esperimenti, al posto di anti α-actinina, anticorpi monoclonali contro l'actina e vimentina sono stati utilizzati (Sigma).
- Al termine della incubazione, aggiungere 200 ml di PBS al pozzo, sollevare il coprioggetti e posto in un nuovo pozzo contenente 500 microlitri di PBS.
- Dopo 5 minuti, togliere PBS pipettando e quindi aggiungere PBS fresco. Ripetere due volte. Trasferimento ad un coprioggettinuovo pozzo asciutto.
- Aggiungere gli anticorpi adeguati secondari coniugati con fluorocromi diversi diluito in 1% BSA / PBST; incubare a temperatura ambiente per 1 ora al buio.
- Per il rilevamento di batteri, abbiamo usato anti-coniglio coniugato con TRITC Ig e per α-actinina e altri rilevazione delle proteine del citoscheletro, abbiamo usato Ig anti-topo coniugato con FITC o-(Sigma) o Alexa Fluor 488 - (Invitrogen).
- Al termine della incubazione, lavare come nei passaggi 4 e 5.
- Contatore macchia con 0,6 mg / ml DAPI in PBS (DNA macchia) per 5 min a RT al buio.
- Risciacquare con PBS.
- Monte coprioggetti (cellule rivolto verso il basso) su vetrini con una goccia di mezzo di montaggio (e, g. Mowiol o Vectashield)
- Conservare al buio a 4 ° C.
- I campioni sono pronti per l'osservazione al microscopio.
2. Microscopia confocale a scansione laser (CLSM)
Di osservare e catturare le immagini di batteri intracellulari e degli elementi del citoscheletro, abbiamo utilizzato campioni immunolabelled e immagini catturate con una SP5-AOBS Leica microscopio confocale a scansione laser collegato a un Leica DM i6000 microscopio invertito epifluorescenza. Tutte le immagini sono stati raccolti utilizzando un NA 63x 1,4 obiettivo ad immersione olio e di processo con il software Leica.
CLSM procedura:
- Per iniziare la procedura di CLSM, aggiungere una goccia di olio di immersione per l'obiettivo e mettere il vetrino, coprioggetto rivolto verso il basso, sul palco microscopio.
- Impostare il microscopio ad un modo visuale e trovare l'area di interesse utilizzando i pezzi occhio del microscopio.
- Utilizzo del software Leica, selezionare la modalità di acquisizione xyz.
- Selezionare il formato 512 x 512 (dimensioni del fotogramma). Per gli studi colocalisation, la risoluzione più alta, la più accurata dell'immagine, tenendo presente il limite di risoluzione del microscopio. Quindi selezionare la modalità bidirezionale X, che aumenterà la velocità di scansione e contribuire a ridurre fotometabolismo.
- Configurare le impostazioni di scansione sequenziale. Fare clic sulla funzione "seq" e scegliere una delle modalità di scansione. Usiamo "tra le righe" modalità.
- Fasci laser selezionare in base al fluorocromi coniugati agli anticorpi secondari: 405 nm per DAPI (blu), 488 nm per Alexa Fluor 488 (verde) e 561 nm per TRITC (rosso). Attivare tubo fotomoltiplicatore (PMT) 1, 2 e 3, rispettivamente. Regolare le impostazioni PMT di rilevare la lunghezza d'onda corretta emissione.
- Impostare superiore ("inizio") e inferiore ("fine") di z-stack o serie. Successivamente, regolare la richiesta "z-step size".
- Neisseria meningitidis è un diplococco (Figura 1G) e dal momento che ogni cocchi ha un diametro approssimativo di 0,5 micron, lo z-step dimensioni di 0,20 micron è stato scelto per aumentare le probabilità di scansione di ogni coccus almeno due volte. E 'anche all'interno della dimensione del passo per la risoluzione ottimale di 0,1-0,2 micron.
- Impostare i parametri di scansione finale, selezionando la linea media del 3 per migliorare il rapporto segnale-rumore.
- Facendo clic su "start" delle immagini a doppia o tripla macchiati sono ottenuti mediante la scansione sequenziale a diverse lunghezze d'onda per eliminare cross-talk tra cromofori diversi.
- Per avere un'indicazione della colocalisation di due fluorocromi, selezionare la funzione "overlay" per unire i canali selezionati in una singola immagine, ad esempio, quando entrambi Alexa 488 (verde) e TRITC (rosso) fluorocromi colocalise, colore giallo apparirà l'immagine sovrapposta .
- Compila z-stack o serie con il "massimo proiezione" la funzione per la costruzione di un'immagine 2D richiesto per la visualizzazione colocalisation possibile. Un'analisi più dettagliata dei colocalisation può essere ottenuta con l'analisi di ogni sezione ottica.
- Dopo aver acquisito lo z-stack o una serie, i vostri dati per ottenere un'immagine ortogonale per la visualizzazione della localizzazione intracellulare di vari elementi (figura 1E).
3. Quantificazione del Colocalisation
L'analisi statistica delle immagini microscopio confocale a scansione vengono eseguite con il software Volocity (improvvisazione, PerkinElmer). Questo software fornisce uno strumento progettato specificamente per l'analisi colocalisation come descritto da Manders et al. (1993) 5. Colocalisation nel contesto del digital imaging di fluorescenza può essere descritto come il rilevamento di un segnale alla stessa voxel (volume pixel) in posizione di ogni canale. I due canali sono costituiti da immagini di due fluorocromi diversi presi dalla zona stesso campione (guida Volocity). Le analisi statistiche sono eseguite con il software Volocity (improvvisazione, PerkinElmer), utilizzando l'analisi quantitativa Colocalisation descritto di seguito.
Colocalisation analisi quantitativa
- Creare una libreria con le immagini CLSM usando il software Volocity.
- Seleziona "focus esteso" dall'immagine nella barra in alto. Questo strumento verrà compilato z-stack in un'immagine 2D da analizzare.
- Selezionare lo strumento "colocalizzazione". I due canali da analizzare deve avere la stessa profondità di colore.
- Selezionare l'area che sta per essere quantificato. Impostare la soglia di rimuovere qualsiasi sfondo.
- Creare l'uscita colocalisation selezionando "Genera colocalizzazione". Statistiche Colocalisation sono generati per le regioni di interesse selezionati in precedenza.
- Seleziona Manders 'coefficienti R (coefficiente di sovrapposizione) e My (coefficiente colocalisation).
- Manders 'coefficienti non sono sensibili all'intensità della colorazione in quanto sono normalizzati contro l'intensità dei pixel totali; quindi possono essere impiegati quando la colorazione di un antigene è più forte rispetto agli altri.
- Sovrapposizione R coefficiente secondo Manders 5,6 rappresenta il vero grado di colocalisation, cioè il numero di pixel che colocalise rispetto al numero totale di pixel.
- D'altra parte, il coefficiente di colocalisation, My, descrive il contributo fluorescenza della frazione più abbondante (in questo caso α-actinina, verde) per la frazione meno abbondante (in questo caso i batteri, rosso), cioè il numero di pixel rossi che si sovrappongono con pixel verdi rispetto al numero totale di pixel rossi.
- Manders 'coefficienti compresi tra 1 e 0, dove 1 colocalisation alta, 0 non essere, ma che può essere espresso come percentuale per una più facile interpretazione.
- Statistiche di esportare i valori di un documento di Excel per la presentazione dei dati.
4. Rappresentante Risultati
Localizzazione intracellulare di Opc che esprimono Neisseria meningitidis e α-actinina
Confocale di cellule cerebrali umane microvascolari endoteliali infettate con Nm per 3 e 8 ore come sopra indicato colocalisation di α-actinina e Nm che sembrava essere meno frequenti in 3 esperimenti di infezione h (non mostrato) in confronto con culture infetti per 8 ore ( Figura 1 AF). Un colocalisation dimostrabili di α-actinina con Opc che esprimono meningococchi è stata osservata ogni volta in> 5 esperimenti di replicare. L'analisi statistica dei colocalisation utilizzando diverse immagini confocale è stata effettuata come descritto sopra. Complessivamente, nel HBMEC infettati con Opc che esprimono meningococchi,> sovrapposizione del 25% del verde (α-actinina) e rosso (Nm) è stato ottenuto pixel (Figura 2B, Overlap coefficiente R). In contrasto con α-actinina, esperimenti in cui è stata effettuata l'etichettatura di batteri e interiorizzato sia actina e vimentina, colocalisation occasionalmente è stata osservata con l'actina, ma che con vimentina era rara (Figure. 2B).
I dati sono stati analizzati utilizzando il coefficiente di mio, che prende in considerazione l'abbondanza relativa di ogni porzione. La mia è una misura della frequenza di occorrenza del segnale più abbondante (in questo caso verde, α-actinina) ogni volta che il segnale meno abbondanti (in questo caso rosso, batteri) si verifica. Questa misura mostra un livello notevole di presenza di α-actinina nelle vicinanze di interiorizzate meningococchi (Figura 2 A e C).
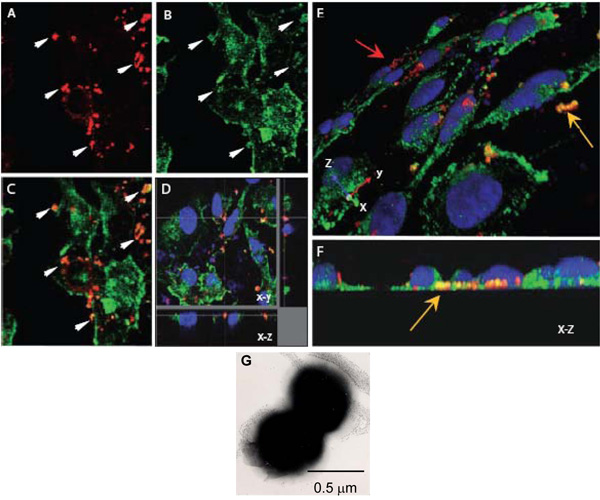
Figura 1. Microscopia confocale a scansione laser per valutare le interazioni intracellulari di N. meningitidis con α-actinina. AH. Monostrati confluenti endoteliali coltivate su vetrini sono stati infettati con il Opc che esprimono (AF) N. meningitidis. Dopo 8 ore, non aderente batteri sono stati lavati via, cellule fissate con paraformaldeide e permeabilised con 0,1% Triton X-100. Successivamente, i batteri e α-actinina sono state colorate come descritto in precedenza (α-actinina, verde, batteri, rosso).
AC. Un campo che mostra le immagini xy della posizione del Nm (A) o α-actinina (B). L'immagine in sovrapposizione (C) indica diverse regioni in cui colore giallo-arancio sembra suggerire colocalisation. Frecce (A) e (B) mostrano regioni in cui un alto grado di α-actinina accumulo sembra essere avvenuto intorno batteri.
D. dissezione ottica di un infetto colocalisation monostrato HBMEC indicando intorno batteri intracellulari trova alla base di una cella.
Di nuovo, questo colocalisation non è dovuto alla vicinanza accidentale di α-actinina, come il generale macchia di α-actinina in questa regione è basso.
E e F. immagini tridimensionali di monostrati infettati HBMEC trattati come sopra. Una visione obliqua della superficie apicale (E) mostra i batteri aderenti macchiato di rosso (freccia rossa), mentre diversi batteri trova verso la superficie basale delle cellule endoteliali (freccia gialla) sono nettamente arancione / giallo a colori. Posizione basale può essere più chiaramente in (F), che è un fine-on XZ sezione trasversale.
G. Un negativamente macchiato l'immagine al microscopio elettronico di N. meningitidis mostrando il suodiplococcal predominante da. Ogni cocco è di circa 0,5 micron di diametro.
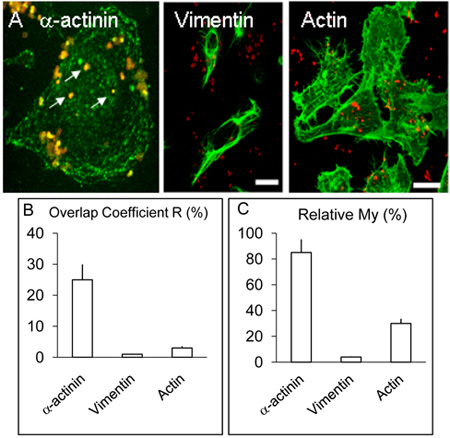
Figura 2. Localizzazione e distribuzione di α-actinina, actina e vimentina nelle cellule HBMEC.
Monostrati A. infetti di HBMEC sono stati trattati come descritto nella leggenda sopra, ma in aggiunta a α-actinina, alcune lamelle sono stati utilizzati per la rilevazione di actina e vimentina con procedura analoga a quella di α-actinina. Come sopra, α-actinina concentrata intorno ad alcuni batteri interiorizzato (frecce bianche). Vimentina e actina non colocalise con i batteri a livelli apprezzabili. Bar rappresenta il 20 micron.
B. & C. I valori per i coefficienti di R e I miei sono stati ottenuti da più di tre esperimenti utilizzando il software Volocity come descritto sopra.
Discussione
La possibilità di legame di interiorizzate Opc che esprimono Neisseria meningitidis di α-actinina è stata esplorata utilizzando HBMEC per l'esame della colocalisation di batteri e le proteine del citoscheletro nelle cellule infette dopo 3 e 8 periodo di incubazione. Mediante microscopia confocale, colocalisation di Neisseria meningitidis con α-actinina potrebbe essere dimostrata. In particolare, anche se i batteri sono stati internalizzati in 3 ore, c'era colocalisation po 'con α-actinina a questo punto del tempo. Associazione batterica con la proteina del citoscheletro hanno richiesto un lungo periodo di residenza intracellulare come dopo 8 h periodo di infezione, un numero significativo di batteri aveva α-actinina apparentemente in stretta associazione. Alfa-actinina è una proteina multifunzionale, e le interazioni batteriche con l'elemento del citoscheletro potrebbe avere un'influenza significativa sulla funzione delle cellule bersaglio, che è un oggetto di studi in corso.
Quantificazione dei colocalisation come sopra descritto richiede una meticolosa preparazione del campione. Particolare attenzione dovrebbe essere data alla fissazione del campione, il blocco diluizioni periodo e anticorpi. Per il miglior rapporto segnale rumore, ogni anticorpo primario e secondario devono essere titolati in esperimenti preliminari per determinare le concentrazioni ottimali. Nella nostra esperienza, il Mowiol mezzo di montaggio prodotta immagini migliori.
Divulgazioni
Riconoscimenti
Gli studi sono stati finanziati dal Wellcome Trust e meningite nel Regno Unito. HBMEC linea cellulare è stata fornita dal dottor KS Kim. L'imaging confocale e microscopia elettronica sono stati eseguiti nel Fondo per Bioimmagini Wolfson, Università di Bristol. Vorremmo anche ringraziare l'onorevole Alan Leard, Dr. Mark Jepson (Università di Bristol), e il signor Alan Tilley (PerkinElmer) per il loro aiuto e consigli.
Materiali
1. Microscopia confocale a scansione laser (CLSM):
Leica SP5 confocale sistema di imaging: Questo sistema, utilizzando una combinazione di AOTF (acusto-ottico filtro sintonizzabile) e un AOBS (acusto-ottico divisore di fascio), semplifica l'eccitazione con lunghezze d'onda specifiche.
2-Software:
Leica confocale software LCS, Leica Microsystems, in Germania.
Volocity 5, improvvisazione, PerkinElmer, USA.
Riferimenti
- Virji, M., Makepeace, K., Moxon, E. R. Distinct mechanisms of interactions of Opc-expressing meningococci at apical and basolateral surfaces of human endothelial cells; the role of integrins in apical interactions. Molecular Microbiology. 14, 173-184 (1994).
- Virji, M., Makepeace, K., Peak, I. R., Ferguson, D. J., Jennings, M. P., Moxon, E. R. Opc- and pilus- dependent interactions of meningococci with human endothelial cells: molecular mechanisms and modulation by surface polysaccharides. Molecular Microbiology. 18, 741-754 (1995).
- Sa E Cunha, C., Griffiths, N. J., Murillo, I., Virji, M. Neisseria meningitidis Opc invasin binds to the cytoskeletal protein alpha-actinin. Cellular Microbiology. 11, 384-405 (2009).
- Virji, M., Kayhty, H., Ferguson, D. J., Alexandrescu, C., Alexandrescu, J. E., Heckels, E. R. The role of pili in the interactions of pathogenic Neisseria with cultured human endothelial cells. Molecular Microbiology. 5, 1831-1841 (1991).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of colocalization of objects in dual color confocal images. Journal of Microscopy. 6, 357-382 (1993).
- Zinchuk, V., Zinchuk, O., Okada, T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena. Acta Histochemica et Cytochemica. 40, 101-111 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon