Method Article
Adulte e embrionali muscolo scheletrico Microexplant Cultura e isolamento di cellule staminali del muscolo scheletrico
In questo articolo
Riepilogo
Il micro-dissezionato tecnica espianti è un metodo robusto e affidabile per isolare proliferativa delle cellule del muscolo scheletrico da giovani, adulte o embrionali muscoli come fonte di cellule staminali del muscolo scheletrico. Unicamente, queste cellule sono state derivate clonazione per la produzione di muscolo scheletrico linee di cellule staminali utilizzate per trapianto in vivo.
Abstract
Colture di cellule embrionali e adulte del muscolo scheletrico hanno un numero di usi differenti. Il micro-dissezionato espianti tecnica descritta in questo capitolo è un metodo robusto e affidabile per isolare un numero relativamente alto di proliferativa delle cellule del muscolo scheletrico da giovani, adulte o embrionali muscoli come fonte di cellule staminali del muscolo scheletrico. Gli autori hanno usato micro-sezionato culture espianto di analizzare le caratteristiche di crescita delle cellule del muscolo scheletrico nei muscoli wild-type e distrofiche. Ognuno dei componenti della crescita dei tessuti, vale a dire la sopravvivenza delle cellule, la proliferazione, senescenza e differenziazione possono essere analizzati separatamente utilizzando i metodi descritti qui. L'effetto netto di tutte le componenti della crescita può essere stabilita per mezzo di misurare i tassi escrescenza espianto. Il micro-espianto metodo può essere utilizzato per stabilire colture primarie da una vasta gamma di tipi di muscoli ed epoche diverse e, come descritto qui, è stato adattato dagli autori per permettere l'isolamento di precursori embrionale del muscolo scheletrico.
Unicamente, micro-culture espianto sono stati utilizzati per ricavare clonale (origine singola cellula) delle cellule staminali del muscolo scheletrico (SMSC), linee che possono essere espanse e utilizzate per il trapianto in vivo. SMSC nel vivo trapiantato si comportano come funzionale, tessuto-specifici, le cellule satellite che contribuiscono alla rigenerazione delle fibre muscolari scheletriche, ma che sono anche conservate (nella nicchia delle cellule satellite) come un piccolo pool di cellule staminali indifferenziate che possono essere re-isolato nella cultura utilizzando il micro-espianto metodo.
Protocollo
Due approcci possono essere impiegati per isolare proliferativa delle cellule del muscolo scheletrico. Nei tessuti muscolari primi sono digeriti enzimaticamente per isolare singole cellule prima della placcatura in 1. Il secondo metodo è quello di espianto pezzi di tessuto muscolare in cultura per permettere alle cellule di crescere fuori durante l'incubazione 2, 3. Il secondo metodo è descritto in questo protocollo. La cultura del tessuto stesso ha le sue radici nella cultura espianto. Il 2007 è stato il 100 ° anniversario degli esperimenti classici di Harrison nel quale ha acquisito escrescenze neurone incubando espianti nervose appeso gocce di linfa 4. Tecniche di coltura espianto sono stati utilizzati e raffinato in una varietà di contesti diversi nel corso dei successivi 100 anni come mezzo per generare proliferativa colture primarie di cellule embrionali adulte e 4, 5. Il principio alla base della tecnica di espianto, tuttavia, rimane lo stesso, di ridurre al minimo il trauma di isolamento delle cellule primarie, mantenendo la struttura tridimensionale del tessuto genitore durante le prime fasi cruciali della crescita degli cellula, fornendo le cellule superando con un rich media nutritivi in cui a proliferare. Nel muscolo scheletrico c'è un ulteriore vantaggio di utilizzare la cultura espianto perché l'atto di tagliare il tessuto muscolare imita fibra traumi muscolari, il grilletto al solito per l'attivazione delle cellule satelliti, la migrazione e la proliferazione 3, 6. Scheletrico adulto cellule satelliti muscolari (chiamato anche mioblasti) sono i proliferativa popolazione di cellule staminali responsabili della riparazione del muscolo e la crescita delle fibre 7.
Espianti muscolo scheletrico così a imitare l'ambiente vivo del muscolo rigenerante e stimolare la migrazione delle cellule staminali e la divisione. Nell'embrione, la maggior parte dei vertebrati muscolo scheletrico (muscoli del tronco e degli arti) deriva dal somiti, anche se somitomeres e archi branchiali dar luogo alla muscolatura del capo 8, 9. Il myotome possono essere identificati come due distinti gruppi di Myf-5 cellule staminali che esprimono situato nei bordi dorsale, mediale e laterale del somite differenziare, rispettivamente. Rispettivamente, queste cellule generano epaxial i muscoli della schiena, che differenziano in situ, e la muscolatura ventrale e laterale hypaxial (arti, addome e muscoli respiratori) che richiedono la migrazione delle cellule muscolari staminali dal somite 10. Staminali embrionali la migrazione delle cellule muscolari è sotto il controllo di Pax 3 11. Myf-5 di espressione è essenziale per la costituzione della muscolatura embrionale e questa importanza persiste ai muscoli post-natale, dove oltre il 98% delle cellule satelliti attivate esprimere Myf-5 12. Myf-5 è quindi un marker affidabile e specifico della proliferazione delle cellule muscolari scheletriche popolazione di staminali nei tessuti sia adulte che embrionali. Cellule embrionali staminali muscolari (chiamato anche progenitori delle cellule muscolari, precursori del muscolo scheletrico, mioblasti o cellule satellite addirittura embrionale) può essere isolato dal somiti fase di avviamento embrioni di topo, pulcino e ranocchio 13. Al fine di isolare le colture miogenici dai muscoli scheletrici embrionale dei vecchi embrioni gli autori hanno adattato la tecnica di espianto microdissezionate per i tessuti embrionali. Un approccio simile è usato da Cossu et al. 14 a generare popolazioni di cellule clonali dal embrionale somite 14.
1. Coltura cellulare in vitro di cellule staminali del muscolo scheletrico (SMSC)
SMSC sono linee cellulari di origine singola cellula che sono stati clonale derivati da colture primarie del muscolo scheletrico espianto. Possono essere coltivate utilizzando le normali metodologie coltura dei tessuti, se la cura adeguata considerazione. Si noti che, se non diversamente indicato, tutte le manipolazioni descritte sono effettuate in condizioni asettiche con una cappa a flusso laminare (Classe 1 e Classe 2 armadio sterile) e tutti i reagenti cultura sono riscaldate a 37 ° C in un bagno d'acqua prima dell'uso.
- Per portare SMSC dallo stoccaggio di azoto liquido (vedi Sezione 1.2 per il congelamento giù metodo) cryovials dovrebbero essere scongelati rapidamente e il contenuto trasferito in 5 ml preriscaldata (37 ° C) DF10 terreno di coltura per centrifugazione immediata (1.000 g per 3 minuti) per rimuovere DMSO . Il metodo migliore per scongelare le cellule avviene per mezzo di pipettamento ripetizione di piccole quantità di pre-riscaldato terreno di coltura nel flaconcino prima del trasferimento alla provetta. Il processo di scongelamento cellule deve essere effettuata molto rapidamente poiché le cellule crioconservate contenere il 10% di DMSO, che è tossico per le cellule a temperatura ambiente (LD50 circa 2 min).
- In seguito a centrifugazione il surnatante viene rimosso e le cellule sono lavate da ri-sospendere il pellet cellulare in un ulteriore 5 ml DF10, quindi si centrifuga come prima.
- Il pellet cellulare viene poi miscelato per la seconda volta con 5 ml di DF10 e la sospensione cellulare risultante viene trasferito in una piccola 25 cm 2 ve cultura plasticaSsel.
- Le culture sono mantenuti a 37 ° C in un incubatore umidificato contenente il 5% di CO 2 in aria. A meno che navi vengano impiegate, con un cappuccio filtrata, il tappo del pallone deve essere leggermente allentato per diverse ore per consentire all'aria nel recipiente di coltura per equilibrare con l'incubatore e acidificare il terreno di coltura. pH del terreno è controllato per mezzo di rosso fenolo che incorpora un colorante indicatore di pH nel terreno di coltura.
- Cellule scongelato deve essere sempre monitorata 24 ore dopo la placcatura e ri-alimentato con nuovi DF10 medio per assicurare la rimozione dei detriti cellulari e le tossine residue (vedi note 1 e 2).
1.1. Subculture
Per stabilire le linee SMSC, quando le cellule raggiungono circa il 95% confluenza, devono essere rimossi dal loro recipiente di coltura, diluito e messo in un vaso fresco per permettere un'ulteriore crescita. Questa procedura subcultura può essere raggiunto attraverso una serie di diversi procedimenti enzimatici, tripsina / EDTA è il più frequente (vedi nota 3). E 'normale (e bene) la pratica di coltivare cellule a densità che richiedono loro di essere subcoltura il terzo giorno di crescita. Per la maggior parte di linee cellulari SMS ciò può essere raggiunto dalle cellule dividendo 1 / 10 in ciascuna sottocultura. Questo consente un attento monitoraggio delle cellule e consente alle persone di eseguire la coltura del tessuto di identificare immediatamente un comportamento insolito di crescita (per esempio una crescita più rapida), che potrebbe indicare i cambiamenti fenotipici per la linea cellulare come la trasformazione o riduzione di apoptosi causata da adattamento alle condizioni di coltura. Inoltre, una routine subcoltura coerente e attenta riduce notevolmente l'incidenza di tali eventi.
- Per sottocultura con tripsina (trypsinisation) navi sono ritirate dall 'incubatrice e la loro media scartato per aspirazione.
- Le cellule vengono poi lavate due volte con sterili di calcio e magnesio libero tampone fosfato salino (PBS), 10 ml per lavaggio, rimosso ogni volta per aspirazione.
- Dissociare il monostrato cellulare (25 mm 2 fiasco) 1 ml 1 tripsina / EDTA viene aggiunto e lasciato sulle celle a temperatura ambiente per 2 3 minuti fino a quando le cellule cominciano a staccarsi (vedi nota 4). Questo può essere visto dall'utente vissuta come piccoli fori che formano nel monostrato leggermente opaco quando il pallone è tenuto alla luce (vedi nota 5). Mentre le cellule dovrebbero essere trypsinised per un tempo sufficiente a garantire una sospensione singola cella, si deve prestare attenzione a non sovraesporre SMSC trypsinisation poiché questo si tradurrà in un elevato livello di morte cellulare e l'attaccamento poveri quando le cellule sono ri-plated.
- Per interrompere la reazione tripsina, il siero contenente medio (DF10) viene aggiunto ad un minimo di 2 volumi (cioè il doppio del volume della soluzione di tripsina). Quando subcolture a mm 25 2 fiasco è conveniente aggiungere 9 ml DF10 in questa fase. A dividere 1 / 10 di cellule possono quindi essere facilmente fatta diluendo 1 mL di sospensione cellulare risultante in un nuovo 25 mm 2 fiasco cultura insieme ad altri 9 ml di terreno fresco DF10. Le cellule rimanenti possono essere utilizzati per l'espansione cellulare (trasferimento in un vaso più grande), crioconservati (vedi Sezione 1.2) o contati e placcato in piatti sperimentali, pozzi o piastre per i test di proliferazione e sopravvivenza, differenziazione, terapia con fattori di crescita o per altri scopi (vedi di seguito).
1.2. Crioconservazione di linee cellulari e colture primarie
- Per le celle crioconservazione sono dissociate dalla loro monostrato per sottocultura (sezione 3.1.1) e pellet di centrifugazione (3 min a 1.000 g).
- Il surnatante tramite aspirazione e le cellule sono accuratamente e rapidamente risospese in 10 ml di congelare il mixing (10% DMSO in DF10) prima di essere ri-pellet per centrifugazione.
- Questa volta il pellet è risospeso in congelare sufficiente fino mix per consentire 0,5 ml di sospensione cellulare per provetta Microbank ™ (vedi tabella 1) e subito collocato in 80 ° C durante la notte.
- Cryovials vengono trasferiti in azoto liquido il giorno successivo per la conservazione a lungo termine (vedi nota 6). Come per lo scongelamento di cellule, questo processo di crioconservazione deve essere effettuata rapidamente. Mentre DMSO è protettivo per le membrane delle cellule durante il congelamento è molto tossico per le cellule a non congelare temperature.
1.3. Determinazione numero di cellule
- Per determinare la concentrazione cellulare di una sospensione singola cellula (sottocultura seguito) un emocitometro Neubauer può essere utilizzato. Per garantire la precisione di conteggio del coprioggetto deve essere fissato saldamente sulla base di emocitometro (vedi nota 7).
- Una piccola goccia di sospensione cellulare viene quindi posto vicino al bordo del vetrino e sarà ripresa per azione capillare.
- Le cellule sono poi conteggiati utilizzando un microscopio invertito con contrasto di fase illuminazione. Per aumentare la precisione della concentrazione cellulare finale, il cells nella camera di conteggio non devono sovrapporsi, se lo fanno la sospensione cellula originaria devono essere diluiti e le cellule ri-contati. Aggregazione dovrebbe essere evitato da dissociazione approfondita delle cellule durante trypsinisation e 100-200 cellule su una superficie nota dovrebbero essere calcolate per ottenere una stima precisa del numero di cellule. Un metodo comodo utilizzando il emocitometro Neubauer è quello di contare le celle in 2 o più set di 16 quadrati. Densità delle cellule per millilitro è ottenuta dividendo il totale per il numero di set contati (es. 2) e moltiplicando per 10 4. Ad esempio, 100 cellule contate più di 2 x 16 set quadrato = 100 / 2 = 5 x 10 5 cellule / ml.
2. Stabilire primaria del muscolo scheletrico Culture Microexplant
Primaria micro-espianto cultura può essere utilizzato per isolare SMSC accessibile da qualsiasi muscolo scheletrici compresi i singoli muscoli delle arti anteriori e posteriori, il diaframma, schiena e muscoli addominali. Il metodo per derivare le culture microexplant dai muscoli giovanile e adulto è descritto in dettaglio da Smith e Schofield 3 ed è stato successivamente utilizzato ampiamente per ottenere cellule SMS da giovani, i muscoli topo adulto e invecchiato. Il metodo può essere utilizzato anche per ricavare una coltura di cellule del muscolo scheletrico da pesce 24 e muscolo scheletrico umano (Rao e Smith, inedito). Conseguenza di SMSC da un microexplant muscolo del mouse è illustrato in Figura 1a, b. Il metodo è stato modificato per l'isolamento delle cellule embrionali precursori dei muscoli (vedi sezione 3). Il metodo di base è la seguente:
- Dissezione asettica del muscolo bersaglio (s) da un topo appena abbattuti è realizzato con strumenti sterili, una zona di lavoro pulito e libero uso di spray etanolo al 70%.
- Muscoli isolati sono lavato attraverso due cambi di DF20 medie e sono inseriti in medie DF20 fresco di 60 mm 2 piatto. Utilizzando un microscopio stereo muscoli dissezione sono accuratamente microdissezionate in condizioni sterili per escludere grasso, tessuto connettivo e osseo.
- Pezzi di muscolo pulito vengono poi tagliati in 400 micron 3 cubetti che, utilizzando pinze gioielliere s, sono collocati singolarmente in centro 60 pozzetti di una piastra a 96 pozzetti contenente 50 microlitri DF20 (vedi nota 8). Pozzi sono controllati al microscopio e posti nell'incubatrice. I pozzi esterna sono riempite con soluzione salina per evitare che si secchi di pozzetti contenenti espianti (3).
- Attaccamento Microexplant e escrescenza viene segnato dopo 24-48 ore di incubazione e successivamente ad intervalli di 48-72 ore (a seconda del tasso di crescita dei muscoli essere colto).
- Per l'espansione e l'isolamento di cellule SMS, culture escrescenza devono essere monitorati individualmente per le cellule con una morfologia prevalentemente SMSC, le cellule mononucleate cioè sferico con rifrazione elevato che crescono in gruppi di aggregazione (vedi Figura 3.1b).
- Una volta escrescenza espianto è stabilito singoli pozzi vengono alimentate (vedi nota 9) con l'aggiunta di incrementi di 50 l di media quando il mezzo acidifica a causa di una maggiore densità cellulare. Quando il bene è pieno e coltura cellulare quasi confluenti, i pozzi sono alimentati da sostituzione del 50% del mezzo di volta in volta per assicurare il mantenimento di "condizionamento" fattori secreti dalle cellule (vedi i commenti sul mezzo condizionato sotto la clonazione, Sezione 2.1). Per sopprimere la differenziazione, al 60-70% escrescenze espianto confluenza primaria sono attivati in calcio-medio impoverito sostituendo DF20 medio di calcio impoverito DMEM/F12 (tutti i supplementi rimangono le stesse) per l'alimentazione delle cellule 3.
- Espianto mezzo condizionato può essere preparato da culture in questa fase e memorizzati per l'utilizzo durante l'espansione e la clonazione di SMSC primaria (per il metodo di clonazione, vedere Sezione 2.1, Figura 1c f). Le culture sono subcoltura con il metodo dispasi (vedi Sezione 3.5).
- SMSC clonale derivata può essere analizzato in vivo per via intramuscolare (Figura 3.1 GK) 19.
- Cariotipo può essere effettuata su clonale derivata linee SMSC per confermare lo stato diploide (vedi Sezione 2.2, Figura 3.1 l) 25.
- Questo metodo può essere adattato per il muscolo coltura embrionale (sezione 3).
2.1. Derivazione clonale
Colture primarie di mioblasti espianto (Figura 1a, b) sono uno strumento utile e preciso per stabilire una serie di parametri di crescita diversi nei muscoli scheletrici wild-type e mutanti. Derivazione clonale, l'isolamento di una linea cellulare da una singola cellula, è un passo essenziale per l'isolamento delle cellule staminali del muscolo scheletrico e può anche essere utilizzato per linee di sottoclone SMSC transfettate con costrutti RNAi o transgeni. Fondata culture espianto SMSC e primario sono altamente densità dipendenti e volontà "agenzie di ratingh "(distaccarsi dal piatto e morire), se placcato presso troppo bassa densità cellulare. Questo perché i fattori di rilascio SMSC solubili, che sono tenuti a mantenere la crescita e la sopravvivenza cellulare. Per simulare un alta densità cultura e la fornitura di questi fattori durante l' processo di clonazione, SMSC sono clonati in auto climatizzate mezzo. L'aggiunta di mezzo condizionato è stato ritenuto essenziale per permettere le singole cellule a proliferare in un ambiente isolato.
- Mezzo condizionato è preparato da SMSC proliferazione in coltura per 48 ore tra il 33 e il 75% confluenza.
- I media in cui si coltivano queste cellule viene rimosso dopo 48 ore e filtrato con un filtro da 0,2 micron siringa: questo assicura sterilità del terreno condizionato e rimuove tutte le cellule residue e detriti.
- Questo mezzo condizionato è mescolato in rapporto 1:1 con il terreno di coltura fresco (medio clonazione, vedi nota 10) e viene utilizzato come terreno di coltura per la clonazione di cellule singole.
- Per ottenere un'unica cellula diluizioni cellule sono dissociate da una sospensione singola cella da trypsinisation attento (stabilito SMSC) o il trattamento dispasi (colture espianto primario) e diluito ad una concentrazione di una cella per 100 microlitri di media clonazione.
- 50 ml di questa sospensione cellulare può essere placcato in ciascuno dei 60 pozzi centro di una piastra da 96 pozzetti.
- Le cellule sono permesso di allegare tramite incubazione a 37 ° C in 5% di CO 2 per 6 ore e ogni bene è poi accuratamente segnato per la presenza di cellule. Pozzetti contenenti 0 o più celle sono attualizzati in questa fase.
- Pozzetti contenenti una sola cellula collegata sono accuratamente nota e la colonia deriva da questa singola cellula è attentamente monitorato (ogni giorno durante i primi giorni), per garantire che solo una colonia, derivati da una singola cellula, è presente. Linee cellulari erano solo derivate da pozzetti contenenti 1 cella. Figura 1c-e illustra l'espansione di tale colonia singola cellula derivata.
- Una volta che la colonia raggiunge confluenza nella piastra a 96 pozzetti può essere subcoltura in un pozzetto di un 48-pozzetti.
- Le linee cellulari clonate possono quindi essere attentamente espansa in 24 - e 6-pozzetti sufficiente fino a quando le cellule sono a disposizione per piatto in un centimetro 25 2 pallone.
- L'origine muscolo scheletrico di queste culture può essere dimostrata con l'espressione di Myf-5 (Figura 1f) o altro muscolo scheletrico-specifici marcatori come MyoD e Pax 7.
- In questa fase, le linee sono congelati giù prima espansione (vedi Tabella 1).
2.2. Cariotipo
Cariotipo è un metodo importante di monitoraggio delle cellule fenotipo. Linee cellulari derivate da derivazione clonale dovrebbe essere karyotyped per garantire che essi abbiano conservato un corredo cromosomico diploide senza lordo riarrangiamenti cromosomici che potrebbero influenzare il loro fenotipo.
- Per le cellule del cariotipo sono cresciuto fino a tarda fase esponenziale (80 confluenti%) in 25 cm 2 recipienti di coltura (2 giorni dopo subcoltura) per massimizzare la percentuale di cellule mitotiche nella cultura.
- Ventiquattro ore prima del cariotipo delle cellule vengono alimentati con 10 ml di terreno di coltura fresco. 0,2 mL di 10 mg / ml colchicina (vedi nota 11) viene quindi aggiunta alle cellule che sono incubate per un ulteriore 1 ora a 37 ° C.
- Dopo 1 ora, le cellule sono soggette alla procedura standard sottocultura trypsinisation tranne che sia il terreno di coltura e lavaggi PBS vengono conservati per massimizzare il numero di cellule mitotiche raccolte.
- Le cellule dissociate, mantenuto medie e lavaggi PBS sono filata a 1.000 g per 3 minuti per far sedimentare le cellule e del surnatante eliminato e scartato in candeggina.
- Il pellet cellulare viene risospeso in 5 ml di cloruro di potassio 0,0075 M esattamente per 4 minuti, prima che le cellule sono di nuovo pellet per centrifugazione.
- La maggior parte del sopranatante è aspirato, lasciando una piccola quantità (~ 50-100 mL) nel tubo per la ri-sospensione. Risospendere le cellule sfogliando la base del tubo falco fino a un impasto cella è raggiunto. Le cellule sono poi immessi sul ghiaccio e fissato in appena fatto ghiacciata fissativo (metanolo: acido acetico glaciale in un rapporto 3:1) come segue: 10 ml di fissativo viene aggiunto lentamente goccia a goccia per le cellule con un piccolo vetro pipetta Pasteur ( questo impedisce aggregazione delle cellule).
- Le cellule sono poste in ghiaccio per 30 minuti e poi pellet per centrifugazione dopo di che il pellet è risospeso in 0,5 ml di fissativo fresco.
- Diapositive vengono prodotti facendo cadere la sospensione fisso sul cellulare vetrini preparati (si veda la Sezione 3.2.2.1) terrà un angolo di 45 °. Per garantire ben distanziati metafase si diffonde la pipetta dovrebbe essere tenuto almeno 30 cm sopra il vetrino.
- Per visualizzare i cromosomi, gli scivoli sono macchiati per 2 minuti in Leishman Stain, diluito con tre volumi di tampone a pH 6,8 Gurr appena prima dell'uso.
- Le diapositive vengono essiccati a temperatura ambiente e montato in media DePex montaggio.
2.2.1. Preparazione di vetrini per cariotipo
- Vetrini (vetrini da microscopio Premium, VWR International, UK) sono predisposti per essere utilizzati nel protocollo del cariotipo mettendoli notte in una grande (vetro) contenitore di acido solforico.
- Le diapositive vengono poi poste sotto acqua corrente per 8 ore e sono poi conservati in etanolo al 70% fino al momento.
- Prima dell'uso, le diapositive devono essere risciacquati con acqua corrente per altri 30 minuti e con aria essiccata a temperatura ambiente per 1-2 h.
3. Stabilire primaria Micro-espianto Culture da embrioni
Tre ceppi di topi sono stati utilizzati per validare questo metodo, wild-type (C57BL/10) insieme mdx e CAV3KO (entrambi mutanti distrofiche). La distrofina-deficienti topo mdx nata spontaneamente in C57BL/10, questa linea è stata ottenuta dal laboratorio Bullfield nel 1991 e da allora è stato sempre mantenuto nella nostra colonia inbred 26. CAV3KO topi distrofici, che contengono una mutazione nel gene della caveolina-3, sono stati allevati sullo sfondo C57BL/10 per 10 generazioni prima di essere utilizzato in questo studio 27. Ogni linea del mouse generato un profilo robusto riproducibile escrescenza, la proliferazione e la sopravvivenza che è stato embrionale fase specifica e diversa per ogni ceppo. I seguenti protocolli sono stati adattati per gli embrioni da Smith e Schofield PN (1994) 3, essenzialmente come a Merrick 21.
3.1. Raccolta degli embrioni
- Per ottenere in scena gli embrioni, le coppie sono costituiti in forma naturale (1:1) accoppiamenti e le femmine controllato ogni mattina per tappi vaginali. Il giorno della rilevazione spina, gli embrioni sono contati come E0.5 giorni (12 ore dopo la fecondazione).
- Una volta prese vaginale sono stati individuati i maschi sono tolto dalla gabbia per garantire la precisione di messa in scena embrionale.
- Quando la fase embrionale desiderato è raggiunto (E11.5 E17.5 a) le madri vengono uccisi da dislocazione cervicale, l'addome è rasata, la pelle e le zone circostanti sono tamponate con alcool al 70% e l'utero viene rimosso attraverso un'incisione addominale orizzontale realizzato con strumenti sterili dissezione.
- L'utero è poi lavato una volta in mezzo principale coltura espianto (PECM) prima di essere immessi in un piccolo piatto contenente PECM fresca prima di dissezione.
- E11.5 E17.5 di embrioni vengono sezionati dall'utero utilizzando un microscopio da dissezione e collocati singolarmente in piastre di Petri contenenti PECM pronto per microdissezione dettagliata.
3.2. Embrione Microdissezione
- Embrioni individuale sono ulteriormente sezionati per isolare le aree ricche di muscolo scheletrico (vedi Figura 2a). Arti anteriori e posteriori (hypaxial muscoli scheletrici) sono sezionati fuori, così come la parete superiore e inferiore del corpo (muscoli scheletrici prevalentemente epaxial). Per fare questo un'incisione lungo tutta la lunghezza del torace, dell'addome e della pelvi è creato per consentire agli organi interni di un embrione da rimuovere.
- Per arricchire di cellule del muscolo scheletrico staminali embrionali (eSMSc), la testa, midollo spinale e tutti gli organi interni vengono rimossi.
- Nei vecchi embrioni (E15.5 E17.5-embrioni) è anche possibile rimuovere la pelle e cartilagine / osso di nuovo per aumentare la percentuale di cellule muscolari nelle culture.
3.3. Impostazione Culture Microexplant Embryo
- Una volta arti anteriori, arti posteriori e la parte superiore e le pareti inferiore del corpo sono stati sezionati fuori che sono inseriti in PECM fresco e ulteriori microdissezionate per produrre cubetti di tessuto di dimensioni uguali (~ 0.5 mm 3; Figura 2a).
- Queste microexplants sono poi messi in centro 60 pozzetti di una piastra a 96 pozzetti (un espianto per pozzetto) contenente PECM 50μL per bene. Un minimo di 60 pozzi contenente 1 espianto per pozzetto sono stabiliti, per ogni embrione studiato.
- Per la coltura degli embrioni 60 pozzi centro può essere suddiviso in regioni dove denota l'espianto è stato derivato da (Figura 2b). Questo design consente 15 pozzetti contenenti ciascuno, rispettivamente, zampa anteriore, parete superiore del corpo, degli arti posteriori e inferiori espianti parete del corpo 21.
3.4. Monitoraggio escrescenza
Tasso di escrescenza è una misura affidabile del tasso di crescita del muscolo scheletrico embrionale espianti e alle condizioni attentamente controllate qui descritto è altamente riproducibile.
- Espianti vengono incubate a 37 ° C e 5% di CO 2 per 3 settimane e ha segnato il giorno 3, 7, 14 e 21 di coltura utilizzando un microscopio invertito. Espianti sono segnati in base al livello di confluenza di cellule in ogni singolo bene (Figura 3a, e).
- Le immagini fotografiche di culture può essere preso, ad esempio, utilizzando una fotocamera reflex collegata al microscopio e 100 ASA Fuji (a colori) o Kodak TMAX (bianco e nero) pellicola professionale (Figura 3 septies).
- Un scheletricomuscolo-specifici anticorpi specifici per Myf-5 può essere usato per dimostrare l'origine muscolo scheletrico di eSMSc, a seconda del ceppo 80 95% di cellule isolate con questo metodo sono Myf-5 positive. Altri marcatori quali MyoD e Pax 7 può essere utilizzato anche per comprovare l'origine muscolo scheletrico di queste popolazioni cellulari. Mentre queste cellule contengono una percentuale molto alta di cellule del muscolo scheletrico staminali embrionali non può essere assunto (soprattutto per i più giovani embrioni) che sono tutti di origine muscolo scheletrico o che sono tutte le cellule staminali. Per isolare puro popolazioni di cellule staminali è necessario clonale derivare culture espianto primario come descritto nella Sezione 2.1.
3.5. Trapianto Espianti primaria embrionali
Una volta confluenti, culture espianto visualizzare le caratteristiche morfologiche di SMSC (Figura 3 septies) è possibile replicare i seguenti 3, 21:
- Terreno di coltura viene rimosso dai pozzi selezionati, filtrata con un 0,2 micron Acrodisc R_ siringa filtro e conservate per l'uso come mezzo condizionato. Il mezzo può essere conservato a 4 ° C per 1 settimana.
- 100 l di 1:10 dispasi diluito in PECM si aggiunge a ciascun pozzetto e piastre poi tornare ai 37 ° C incubatore per 20 min.
- Un puntale viene quindi utilizzato per raschiare delicatamente le cellule allentato dalla superficie del pozzo.
- La sospensione cellulare viene poi centrifugato a 1.000 g per 3 minuti per far sedimentare le cellule e il supernatante viene rimosso ed eliminato.
- Le cellule sono risospese in 200 ml di 1:01 mix di media condizionata e PECM.
- Il mix cella è trasferito a 48-pozzetti per un'ulteriore espansione.
- Per l'analisi delle cellule in vitro possono essere placcati con una densità di 5 x 10 3 cellule / cm 2 sia in 48 pozzetti (ciascuno contenente un millimetro 9 2 coprioggetti sterile di vetro) o di 8-ben vetro-camera di diapositive. Per le celle analisi differenziazione sono cresciuti durante la notte per il 50-60% confluenza prima di essere trasferita ad un mezzo di differenziazione permissivo (si veda la sezione 4 per in dettaglio metodo in vitro) per 3 giorni, prima di fissazione.
4. In Analisi in vitro di cellule staminali del muscolo scheletrico e colture primarie
4.1. Preparazione delle cellule
- Dispasi subcoltura (Sezione 3.3) colture primarie espianto embrionali sono placcati in media PECM / condizionato su coprioggetto a 48 pozzetti ad una densità di 3 x 10 3 cellule / cm 2 e ha permesso di attaccare.
- Per la valutazione della apoptosi e la proliferazione coprioggetto vengono lavati due volte in PBS, fissate in 4% paraformaldeide (vedere paragrafo 4.2) in PBS per 20 minuti a temperatura ambiente, seguito da un ulteriore 10 min PBS lavaggio.
- Coprioggetto preparato in questo modo può essere conservato a 4 ° C per un massimo di 1 settimana in PBS o PBS / glicina.
4.2. Preparazione di Fissativo paraformaldeide
- In una cappa aspirante, pesano 4 g di paraformaldeide (PFA, Sigma-Aldrich, UK) e aggiungere a una bottiglia di vetro da 100 ml di PBS sterile con un agitatore magnetico. Una maschera viso e guanti devono essere indossati per la protezione.
- In una cappa aspirante, la soluzione viene riscaldata e continuamente mescolato su piastra magnetica fino a quando la polvere si scioglie. Questa operazione richiede circa 5-10 minuti a 65 ° C. Bisogna fare attenzione a evitare che la temperatura in aumento superiore a 70 ° C, in quanto vi è il rischio che la soluzione che esplodono ad alte temperature.
4.3. Apoptosi e la proliferazione di analisi
- Coprioggetto fisso (preparato come nella sezione 4.1) sono macchiati con 10 mg / ml DAPI per 3 min.
- Coprioggetto vengono lavati una volta in PBS (5 a 10 min) e rovesciata su un punto di montaggio Vectashield medie su un vetrino 17, 18.
- I bordi del coprioggetto sono sigillati con smalto (vedi nota 12).
- Per lo stoccaggio, le diapositive sono avvolti in un foglio e messo a 20 ° C.
- Per il conteggio, le diapositive sono visualizzate in fluorescenza (filtro UV) su un microscopio in posizione verticale e ha segnato per le cellule apoptotiche e mitosi usando un reticolo oculare. Venti griglie distribuiti in modo casuale vengono conteggiati (in rappresentanza ~ 1.000 cellule), e le cellule sono morfologicamente caratterizzate come non-apoptotici, apoptotici o mitosi (Figura 3 g).
- Indici di mitosi e apoptosi sono calcolati come percentuale di cellule totali.
4.4. Immunoistochimica
Cellule fissate su coprioggetto può essere utilizzato anche per immunoistochimica. Per il recupero antigene con un coprioggetto pentola a pressione devono essere fissati solidamente vetrini usare graffette standard. Immunocolorazione può essere usata per identificare le cellule proliferanti, utilizzando un anticorpo per Ki67 (1 / 1, 000 diluizione), per stabilire l'identità, utilizzando un anticorpo per Myf-5 (1 / 1, 000 diluizione), o per studiare l'espressione genica (vediParagrafo 4.5). Immunocolorazione può essere raggiunto utilizzando una serie di metodi, i seguenti (descritti in (28, 29)) viene utilizzato abitualmente dagli autori:
- Citrato di sodio è pre-riscaldato nella pentola a pressione. Per il recupero dell'antigene, diapositive contenenti tessuto sezionato vengono inseriti nel buffer riscaldata e riscaldato sotto pressione per 2 minuti. Pressione si ottiene con fermezza il blocco del coperchio della pentola a pressione e l'immissione sul peso. Una volta che il tempo di recupero 2 min ha trascorso la pentola a pressione viene poi accuratamente messo sotto l'acqua fredda di rubinetto per ridurre la pressione. Per evitare che il buffer bollente in su, si deve prestare attenzione a non rimuovere il coperchio fino a quando la pressione ha pareggiato con la pressione atmosferica. La pressione è sufficientemente ridotto quando il peso può essere rimosso facilmente (senza forza) e il coperchio rimosso. Le diapositive vengono poi rimossi dal buffer e lavate in PBS temperatura ambiente per 10 min.
- Diapositive sono pre-bloccato da immergendoli nel 3% di perossido di idrogeno / acqua del rubinetto per 5 minuti e poi lavato per tre volte in PBS + 0,05% Tween 20 (10 minuti per lavaggio).
- Il blocco viene raggiunto da un incubazione 30 minuti a TNB tampone di bloccaggio (in dotazione nel kit TSA) a temperatura ambiente.
- Anticorpo primario è diluito in tampone TNB per la diluizione appropriata (arrivati con la titolazione, si veda la nota 12) e incubate overnight a 4 ° C (o in alternativa 1-2 ore a temperatura ambiente).
- Dopo tre lavaggi 10 min in PBS + 0,05% Tween 20, diapositive vengono incubate per 1 ora a temperatura ambiente appropriato anticorpo biotinilato secondo diluito in TNB buffer.
- A seguito di ulteriori tre lavaggi 10 min in PBS + 0,05% Tween 20, diapositive vengono incubate per 30 min in streptavidina-HRP (fornito nel kit TSA) diluito 1:100 in tampone di TNB e poi lavato per tre volte (10 min ciascuno) in PBS + 0,05% di Tween 20.
- Tyramide Biotinyl (reagente di amplificazione; TSA kit) viene quindi aggiunta a ciascuna sezione per i tra gli 8 ei 15 minuti (il tempo preciso dovrebbe essere ottenuto da esperimenti di ottimizzazione).
- A seguito di amplificazione, lavare i vetrini tre volte (10 min ciascuno) in PBS + 0,05% di Tween 20 e incubare per 30 min in SA-HRP.
- A seguito di ulteriori tre lavaggi (10 min ciascuno) in PBS + 0,05% Tween 20, visualizzare con 3,3 _-diaminobenzidina tetraidrocloruro cromogeno (DAB) per 5 a 10 min. Poi effettuare due lavaggi finale in acqua prima di contrasto diapositive in ematossilina e coprire i vetrini. DAB è un noto cancerogeno e deve essere maneggiato con cura (come per la Colchicina, Sezione 3.2.2).
4.5. Differenziazione
- SMSC placcato sul coprioggetto o diapositive da camera (vedi nota 13) possono anche essere differenziate entro la fissazione per l'analisi myotube.
- Per questi esperimenti le cellule sono placcati con una densità di 10 4 / cm 2 e ha permesso di attaccare da 6 a 8 ore
- Le cellule sono poi passato in condizioni di differenziazione permissiva per 3 giorni (vedi nota 14).
- Medio differenziazione è composto da DMEM + 0,5% FCS integrato con siero di cavallo 2% e 1% glutamina. Questo permissivo terreno di coltura differenziazione è sostituito a 48 intervalli di ore.
- Coprioggetto sono poi fissate in 4% paraformaldeide come sopra (sezioni 3.4.1 e 3.4.2).
4.6. Trasfezione di SMSC: espressione dei transgeni e costrutti shRNAi
Cellule staminali e colture primarie sono refrattari a trasfezione e con una maggioranza di metodi il tasso di trasfezione in SMSC primarie e cellule del muscolo scheletrico è molto basso (<10%), impedendo l'uso di metodi di trasfezione transiente. Per ovviare a questo è stata una pratica standard nel nostro laboratorio di isolare cloni derivati da transgene culture transfettate (cfr. sezione 3.2.1) dopo trasfezione con fosfato di calcio o Lipofectamine. In alternativa, le cellule possono essere efficientemente transfettate con infezione virale di costrutti confezionato. La figura mostra 1m espressione stabile di β-galattosidasi in PD50A, un derivato SMSC clonale isolati sotto infezione selezione G418 seguendo con pIRV, una replica difettoso retrovirus portando i geni per la resistenza e neo/G418 β-galattosidasi (19). Questa linea cellulare è stata utilizzata per dimostrare formalmente che SMSC comportarsi come cellule staminali funzionale in vivo (vedi Figura 3.1). Mentre la generazione di una linea cellulare stabile clonale esprimere un gene marcatore è auspicabile che in esperimenti di trapianto di cellule staminali in vivo, è un metodo lungo e insoddisfacente di analizzare la funzione dei geni in vitro. Per queste ragioni gli autori hanno recentemente sviluppato una modifica ottimizzata del Lipofectamine 2000 reagente di trasfezione che è in grado di fornire tassi di trasfezione di 60 a 70%. Questo permette l'analisi della funzione del gene utilizzando trasfezione transiente dei transgeni o RNAi costruisce in SMSc o culture espianto primario (figura 3 ore, i). Gli autori utilizzano un breve tornante RNAi vettore (pSHAG RNAi) (30) per generare costrutti shRNAi in grado di gene-targeting specifico di espressione dell'mRNA di SMSC. Il successo della tecnica shRNAi dipende da due elementi: (a) un metodo di trasfezione efficiente e (b) la progettazione di una sequenza di brevi tornanti che riconosce specificamente il gene bersaglio. Un shRNAi costruire diretto a eGFP può essere utilizzato per convalidare il metodo knockdown RNAi (Figura 3 undecies, m).
4.7. Ottimizzato LipofectamineTM 2000 protocollo Transfection per SMSC
- Le cellule sono placcati in 5-10 aprile cellule / cm 2 in diapositive da camera in 250 microlitri DF10 terreno di coltura e in coltura per 18 ore per raggiungere il 95% confluenza (confluenza ottimale per ogni linea cellulare è stata stabilita valutando i tassi di trasfezione a densità diverse).
- Per ogni bene, 0,5 mg di DNA (vettori shRNAi, transgeni) viene aggiunto a 33 ml di DMEM senza siero integrato con 2 mM glutamina e agitarli in un tubo Eppendorf sterile.
- Per ogni bene, 1,25 ml di Lipofectamine 2000 è separatamente diluito in un ulteriore 33 ml di mezzo privo di siero DMEM + glutammina, delicatamente mescolato e mantenuto a temperatura ambiente per 5 min
- Il mix di DNA e Lipofectamine sono poi rapidamente sommati insieme, mescolati con delicatezza per 60 s pipettando e quindi incubate a temperatura ambiente per 19 minuti per consentire DNA Lipofectamine 2000 per formare complessi.
- Per la trasfezione, 66 ml di mix complesso è inserito in ogni camera di bene e diapositive sono cullati per 10 s da garantire un'equa ripartizione dei complessi.
- Le cellule sono incubate per 24 a 72 ore a 37 ° C e 5% di CO 2. A seconda del costrutto, espressione genica funzionale o smontabile shRNAi è la prima volta individuato tra 8 e 24 ore dopo la trasfezione.
5. Rappresentante Risultati
Quando espianti sono accuratamente espiantati da adulto muscolo scheletrico o da embrioni il espianti inizierà a generare cellule in poche ore a 72 ore di incubazione a 37 ° C (5% di CO 2 / aria) (Figura 3A). Il tempo necessario perché ciò avvenga dipende dalla fonte di espianti: espianti embrionali troppo grande in modo più rapido rispetto ai vecchi espianti muscolo scheletrico adulto. Nella nostra esperienza i tempi di escrescenza è altamente riproducibile 3, 29. Espansione della popolazione di cellule si verifica in un periodo di giorni (espianti embrione) o settimane (più vecchio espianti muscolo scheletrico), ad alta densità di generare aggregazione colture cellulari primarie SMS (vedi Figura 3B-F per l'illustrazione di queste culture). Figure 1 e 3 mostrano risultati rappresentativi della derivazione di successo e la cultura del muscolo scheletrico e espianti embrionali, la derivazione clonale e in vivo trapianto del muscolo scheletrico derivate le cellule staminali adulte, β-galattosidasi etichettatura, cariotipo e Myf-5 immunoistochimica di SMSC embrionale per illustrare l'origine del muscolo scheletrico di . popolazioni cellulari Figura 3 mostra un risultato rappresentativo di segnare escrescenza (utilizzando Myf-5 immunoistochimica per visualizzare SMSC), la morfologia delle cellule muscolari embrionali primaria; colorazione DAPI per l'apoptosi e il protocollo di trasfezione shRNAi. Ulteriori dettagli possono essere trovati nelle leggende dato relativo a queste due figure. La figura 2 illustra la procedura da embrione micro-dissezione per generare popolazioni arricchite di cellule del muscolo scheletrico staminali embrionali.
Tabella 1: tabella di calcolo per stimare il numero di cryovials necessaria per la vitalità cellulare massimo durante il congelamento delle cellule verso il basso protocolli
| Piastra / Flask / camera di scorrimento | Volume del mezzo di cultura | PBS lava | Volume di tripsina | Numero di congelare le fiale (3.1.2) |
| 96-bene | 50 microlitri | 2 X 100 ul | 25 microlitri | N / A |
| 48-bene | 150 microlitri | 2 X 200 ul | 50 microlitri | N / A |
| 24-bene | 500 microlitri | 2 X 700 microlitri | 200 l | N / A |
| 6-bene | 3 ML | 2 X 3 ML | 500 microlitri | 1 |
| Piccola (25 cm 2) | 10 ml | 2 x 10 ml | 1 ml | 2 |
| Medio (80 cm 2) | 10 ml | 2 x 10 ml | 3 ML | 4 |
| Di grandi dimensioni (175 cm 2) | 10 ml | 2 x 10 ml | 5 ml | 8 |
| Camera ben | 500 microlitri | 2 X 500 microlitri | 100 ul | N / A |
N / A = non applicabile, numeri cellulari erano troppo bassi per congelare fino a meno che i pozzi sono stati congelati più giù insieme.
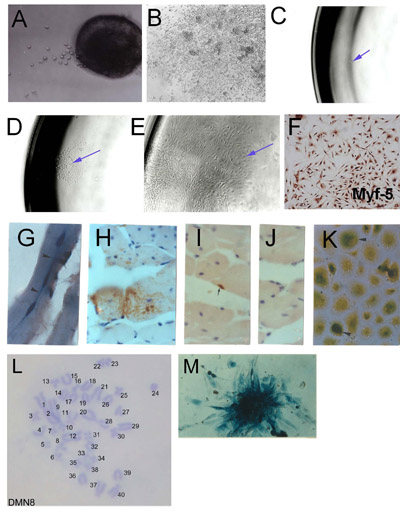
Figura 1. Isolamento di cellule staminali del muscolo scheletrico (SMSC) da microexplants: (A) escrescenza presto da espiantati muscolo scheletrico adulto (giorno 2) (B) escrescenza espianto Fondata mostrando culture aggregati e ad alta densità cellulare.. Derivazione clonale di SMSC. (C) delle cellule isolate in una singola piastra 96 pozzetti. (D) colonia di origine singola cellula. (E) Fondata popolazione clonale. (F) Verifica di identità SMSC con Myf-5 immunoistochimica. Cellule derivate da SMSC clone PD50A (che esprimono β-galattosidasi) nei topi ospite a 3 mesi (G) e (HJ) 14 mesi dopo l'iniezione di 2.000 cellule PD50A nel muscolo tibiale anteriore del mouse. (G) Tre recentemente fusa (nuclei in posizione centrale ) β-galattosidasi cellule positive (blu macchia) di fibre muscolari (sezione longitudinale). (H) contributo esteso di β-galattosidasi cellule positive (macchia marrone, rilevato da anti-β-galattosidasi anticorpi) nelle fibre muscolari (sezione trasversale ). (I) β-galattosidasi positivi cellule satellite (macchia marrone, rilevato da anti-β-galattosidasi anticorpi). (J) il controllo degli anticorpi secondari (senza colorazione). (K) β-galattosidasi cellule positive (blu macchia) proliferano nella cultura quando isolate da muscoli ospitare iniettato 12 mesi dopo l'iniezione. (L) Cariotipo di una linea clonale SMSC mouse (DMN8) che mostra Istochimica normale diploide cromosoma complemento. (M) che mostrano β-galattosidasi espressione in una colonia di cellule PD50A ( Figura 3.1 g, k, riprodotti con il permesso di AACR stampa, Smith e Schofield, 1997).
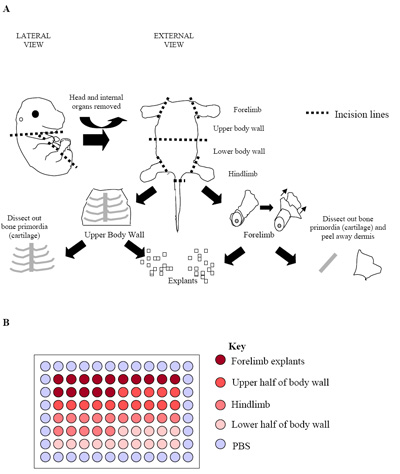
Figura 2. (A) Illustrazione del processo di dissezione dell'embrione. La figura rappresenta un E15.5 embrione primordiale in cui l'osso (cartilagine) potrebbe essere facilmente identificati e sezionato libero del tessuto circostante muscolo scheletrico. In questa fase, e in embrioni fase successiva (E15.5 E17.5), derma è stato rimosso anche per massimizzare la percentuale di cellule del muscolo scheletrico ottenuti. (B) L'installazione di culture espianto primario in una piastra da 96 pozzetti. Ogni embrione è stato utilizzato per produrre un piatto come visto sopra. Pratica usuale è alla piastra replicati di tre embrioni separati (tre piastre = 180 pozzi) per stabilire i tassi di escrescenza.
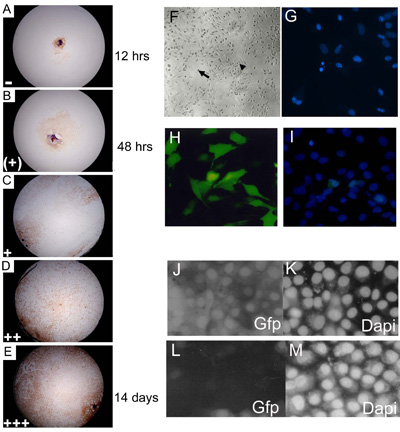
Figura 3. Embrionale culture espianto primario sono stati valutati a 3, 7, 14 e 21 giorni di cultura e assegnato un rappresentante livello conseguenza del livello di confluenza. (AE) C57BL10 E15.5 colture primarie espianto embrionale colorati con Myf-5 per illustrare 0 14% (); 15 24% (+); 25 49% (+); 50 74 75 100% (++);% ( + + +) i livelli di confluenza. La percentuale di pozzi che mostra ogni livello di escrescenza (per ogni giorno di punteggio) è stato moltiplicato per un numero arbitrario (= 1; (+) = 2; + = 3; + + = 4 e + + + = 5) prima di raffronto dei dati per dare un valore finale escrescenza. Circa il 85% delle wild-type (C57BL/10) eSMSc primaria macchia per il marcatore delle cellule muscolari scheletriche Myf-5. Ingrandimento è 10. (F) Fondata culture embrionali hanno le caratteristiche morfologiche degli adulti SMSC, cellule bipolari (freccia piccola) e sferica cellule monomorfa (freccia grande). (G) Identificazione di frammentazione dei nuclei apoptotici mediante colorazione DAPI. (HI) Alti livelli (~ 75%) di trasfezione di un costrutto GFP che esprimono in linee cellulari di SMS utilizzando il metodo ottimizzato Lipofectamine 2000 trasfezione. (I) Il conteggio del numero di cellule totale è aiutata da DAPI contrasto. RNAi utilizzando pSHAGshRNAigfp (JM) abolisce l'espressione GFP in SMSC (vedi (29) per un esempio di questo costrutto usato come controllo). (J) di controllo (trasfezione finto) che mostra l'espressione della GFP in una linea GFP SMSC. (K) DAPI controllo . (L) shRNAiGfp 24 ore dopo la trasfezione. (M) per le cellule di controllo DAPI shRNAiGfp transfettate in (L).
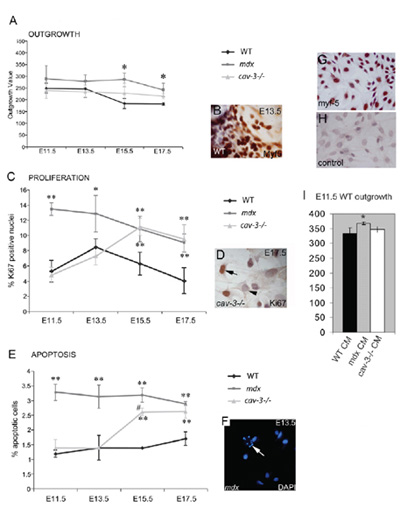
Figura 4. Distrofiche, embrionale Myf5-positivi mioblasti sono hyperproliferative e inclini alla apoptosi. (A) Il tasso di conseguenza di mioblasti embrionali da cultura espianto i muscolis un aumento sia in mutanti mdx da E11.5 e in cav-3 mutanti (-/-) a E15.5 e E17.5 se confrontato con espianti WT coltivate in parallelo. (B) Un Myf5-immunostained espianto. (C) iperproliferazione dei mioblasti embrionali in mutanti mdx da E11.5 e in CAV-3 mutanti (-/-) da E15.5, come determinato dal Ki67-positivi immunoreattività (D). (E) apoptosi elevati da embrioni a E11.5 mdx e da E15.5 in cav-3 embrioni (-/-), come dimostrato dalla colorazione DAPI (F), la freccia in F punti ad un cellulare per apoptosi. * P <0,05 rispetto al WT; ** p <0,01 rispetto al WT; * p <0,05 nel confronto con mdx CAV-3 (-/-) (G, H) E15.5 primaria mioblasti in coltura embrionale WT con Myf5 colorazione. (G) e un controllo secondo anticorpo (H). (I) Il tasso conseguenza di E11.5 espianti WT aumentata (* p <0,05) nel E11.5 mdx espianto condizionata medio (CM), ma non in cav-3 (-/-) o WT CM. Barre di errore indicano sd Questa figura è riprodotta sotto copyright autori e stato pubblicato dalla Società dei Biologi in Merrick et al., 2009.
6. Note: passaggi critici e possibili modifiche
- Quando le cellule scongelati hanno attaccato a bassissima densità cellulare è prudente sostituire solo la metà del mezzo per evitare crollo cultura.
- SMSC isolate dal muscolo distrofico sono suscettibili di apoptosi e devono essere trattati con particolare cura. SMSC distrofica (come il DFD-13 linea cellulare, che è stata istituita dal muscolo scheletrico ottenuto da 5 settimane di età distrofici (mdx) topi) dovrebbero essere coltivati a densità delle cellule più alta del solito per i mioblasti. Tali apoptosi sensibili linee cellulari sono anche crioconservati a densità più elevate (vedi punti 1.1 e 1.2) (19).
- Un metodo alternativo per rimuovere le cellule da un monostrato utilizza dispasi, che fornisce un metodo più dolce di dissociazione delle cellule, con il vantaggio che può essere effettuata in presenza di FCS e calcio (entrambi presenti in DF10). Dispase può quindi essere utilizzato per sottocultura e ampliare primario culture espianto del muscolo scheletrico e earlystage cloni SMSC (artt. 2 e 3).
- Per i più grandi fiaschi la quantità di tripsina / EDTA utilizzato deve essere scalati come segue: 75 mm 2 Pallone (3 ml tripsina) e 175 mm 2 fiasco (5 mL tripsina). Allo stesso modo per le superfici più piccole riducono la quantità di tripsina utilizzato (vedi tabella 1).
- In alternativa, la dissociazione può essere monitorato utilizzando un microscopio invertito, questo è raccomandato per i principianti.
- Crioconservazione di linee cellulari è di solito effettuata utilizzando una confluenza di grandi dimensioni (175 mm 2) bicchiere di plastica. Tra 7 e 9 cryovials può essere ottenuto da una nave così grande, a seconda del profilo sopravvivenza della linea cellulare di essere crioconservati. Colture primarie e linee cellulari di nuova costituzione sono spesso molto refrattari a congelare le procedure. Per migliorare il recupero e il successo di congelamento le cellule come due approcci possono essere utilizzati (singolarmente o in combinazione). (A) Il contenuto FCS del congelamento giù miscela può essere aumentato dal 10% (fino ad un massimo del 50%). (B) Il congelamento giù processo può essere rallentato mettendo cryovials in fase vapore di N2 per 12-24 ore prima del trasferimento fiale alla fase liquida.
- Un modo pratico per controllare fermo attaccamento del vetrino haemacytometer è quello di cercare Anelli di Newton (riflessi arcobaleno nel bicchiere) sul vetrino o, in alternativa, per tenere il haemacytometer a testa in giù su una mano aperta.
- Una variazione del metodo di espianto può essere impiegato per colture a breve termine per l'uso in test immunoistochimica, la proliferazione o l'apoptosi. Espianti microdissezionate sono immessi sul vetro con ben 8-diapositive da camera. Un metodo alternativo è usare 9 mm 2 coprioggetto posti in piastre da 24 pozzetti. In entrambi i casi due espianti sono trasferiti in ciascun pozzetto in 150 microlitri di media DF20. In alternativa, colture primarie possono essere sottocoltura con il metodo dispasi e placcato affacciano su coprioggetto posti in piastre da 24 pozzetti o direttamente in 8 pozzetti diapositive da camera.
- Per l'analisi quantitativa dei tassi di escrescenza un minimo di 60 pozzi contenente 1 espianto per pozzetto sono stabiliti, per ogni muscolo / ceppo di topi. Per stabilire i parametri di crescita per un ceppo di almeno tre animali separati devono essere utilizzati. Piatti e singoli pozzetti non sono alimentati, mentre escrescenza viene segnato.
- Per la clonazione di linee stabilite SMSC è sufficiente cellule singola cultura in un mix 1:1 di mezzo condizionato e DF10 media. Per espianti primari è necessario aumentare il contenuto di siero del terreno di coltura al 20%.
- Colchicina è altamente tossico e cancerogeno conosciuto e deve essere maneggiato con cure appropriate. Doppio guanto e lavorare entro i confini di un vassoio designato è essenziale. Tutti i prodotti monouso (es. Gilsonpunte) sono posti in un bicchiere di candeggina (ipoclorito di sodio al 5%) durante la notte prima dello smaltimento con abbondante acqua il suc-ala giorno.
- Al momento stiamo utilizzando anticorpi primari specifici per Ki67 e Myf-5 ciascuno a 1 / 1, 000 diluizione. La diluizione ottimale per anticorpi primari necessario stabilire empiricamente per ogni anticorpo da utilizzare e ideale anche per diversi lotti dello stesso anticorpo, anche se ottenuto dalla stessa fonte.
- Diapositive camera può anche essere usato per questo test. Prima di fissare le cellule nel 4% PFA, il terreno di coltura viene rimosso e le cellule lavate due volte con 37 ◦ C PBS sterile. Le camere bene, guarnizione e colla vengono rimossi e le diapositive di vetro collocato in un vaso di vetro da 50 ml Coplin contenenti preparati al momento paraformaldeide 4% a temperatura ambiente, che viene poi cullati su una Gyro-Rocker R_ shaker per 25 min. Le diapositive vengono poi lavate due volte in PBS (temperatura ambiente) e utilizzato immediatamente o conservato in PBS a 4 ◦ C (a breve termine; 1-2 settimane) per immunoistochimica (IHC) analisi.
- Se la formazione myotube più ampia è necessaria primario cellule del muscolo scheletrico può essere differenziata per un massimo di 8 giorni.
Discussione
Culture espianto microdissezionate può essere utilizzato per isolare in modo affidabile e riproducibile popolazioni di cellule che contiene una percentuale molto elevata (~ 85%) di proliferativa Myf-5 positive le cellule staminali del muscolo scheletrico (SMSC). Nelle condizioni cultura rigorosamente controllate qui descritto culture espianto primario può essere utilizzato per caratterizzare i comportamenti di crescita del topo mutante SMSC geneticamente e può essere usato come mezzo per produrre miotubi per dettagliata analisi in vitro dei processi di differenziazione. Accurata manutenzione e la manipolazione di queste culture permette a lungo termine cultura e di espansione. Utilizzando i metodi descritti qui è anche possibile derivare clonale muscolo scheletrico linee di cellule staminali provenienti da culture espianto mediante diluizione singola cellula. Per raggiungere la proliferazione di singole cellule isolate durante la procedura di clonazione, "medium condizionato" viene usato per mimare la condizione normale di queste cellule ad alta densità cultura. Il metodo è applicabile (con modifica) per embrionali, tessuti adulti e anziani, adulti e oltre a mouse può essere utilizzato per isolare le cellule dei muscoli scheletrici di altre specie tra cui umani (Rao e Smith, inedito), embrione di pollo e pesce ( salmone) 24. SMSC clonale derivata può essere analizzato in vivo per via intramuscolare trapianto e in queste condizioni iniettato SMSC si combinano con miotubi host per formare fibre muscolari ibrida. SMSC iniettata per via intramuscolare non si formano i tumori e sono stati trovati nei muscoli ospitare nella posizione delle cellule satellite più di un anno dopo l'iniezione, suggerendo che essi sono soggetti al controllo endogeno da parte delle cellule satelliti di cellule staminali niche.These può essere re-iniettato isolato da ospita come SMSC proliferativa più di 12 mesi dopo l'iniezione ospitare 19.
Divulgazioni
Riconoscimenti
Ringraziamo Patrick Paddison per il dono del vettore navetta shRNAi. Angela Sloan ha generato l'immagine GFP RNAi in Figura 3. Ringraziamo anche gli organi di finanziamento per il loro sostegno i seguenti:
Distrofia muscolare Campagna numero concedere RA2/592/2; SCINTILLE codice di autorizzazione 02BHM04, La Royal Society codice di autorizzazione 574006.G503/1948./JE e BBSRC codice di autorizzazione 6/SAG10077.
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
Riferimenti
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon