È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Formanti colonia cellulare (CFC) Analisi per cellule emopoietiche
In questo articolo
Riepilogo
La colonia di cellule che formano (CFC) test è un test in vitro in cui progenitori emopoietici formare colonie in terreno semisolido. Una combinazione di morfologia delle colonie, la morfologia delle cellule, e citometria a flusso sono utilizzati per valutare la capacità dei progenitori di proliferare e differenziarsi lungo le varie linee ematopoietiche.
Abstract
Umane ematopoietiche staminali / progenitrici sono solitamente ottenute da midollo osseo, sangue del cordone ombelicale, o dal sangue periferico e sono utilizzati per lo studio ematopoiesi e leucemogenesi. Hanno la capacità di differenziarsi in linee linfoidi e mieloidi. La colonia di cellule che formano (CFC) test è usato per studiare la proliferazione e la differenziazione modello di progenitori emopoietici con la loro capacità di formare colonie in un mezzo semisolido. Il numero e la morfologia delle colonie formate da un numero fisso di celle di input fornire informazioni preliminari circa la capacità dei progenitori di differenziarsi e proliferare. Le cellule possono essere raccolte da singole colonie o da tutta la piastra per valutare ulteriormente il loro numero e gli stati di differenziazione in citometria a flusso e la valutazione morfologica di Giemsa vetrini colorati. Questo test è utile per valutare la differenziazione mieloide, ma non linfoidi. Il mieloide termine in questo contesto è usato nel suo senso più ampio fino a comprendere lignaggi granulocitica, monociti, eritroide e megacariociti.
Abbiamo usato questo test per valutare gli effetti di oncogeni sulla differenziazione delle primarie umane cellule CD34 + derivate dal sangue periferico. Per questo scopo sono le cellule trasdotte con entrambi costruire controllo retrovirali o un costrutto che esprime l'oncogene di interesse, in questo caso NUP98-HOXA9. Ci avvaliamo di un vettore retrovirale comunemente usato, MSCV-IRES-GFP, che esprime un mRNA bicistronic che produce il gene di interesse e di un marcatore GFP. Le cellule sono pre-attivate crescendo in presenza di citochine per due giorni prima della trasduzione retrovirale. Dopo altri due giorni, le cellule GFP + sono isolate dalla fluorescenza-attivato cell sorting (FACS) e mescolato con un metilcellulosa mezzo contenente semisolido integrato con citochine e incubate fino colonie appaiono sulla superficie, in genere 14 giorni. Il numero e la morfologia delle colonie sono documentati. Le cellule vengono poi rimossi dalle piastre, lavato, contati, e sottoposti a citometria a flusso e l'esame morfologico. Citometria a flusso con anticorpi specifici marcatori di superficie della cellula espressi durante emopoiesi fornisce informazioni sulla genealogia e lo stadio di maturazione. Studi morfologici delle singole cellule al microscopio dopo la colorazione di Wright-Giemsa fornire ulteriori informazioni in materia di genealogia e di maturazione. Confronto di cellule trasdotte con controllo vettoriale vuoto a quelli trasdotte con un oncogene rivela gli effetti del oncogene sulla differenziazione ematopoietiche.
Protocollo
1. PREPARAZIONE DEI REAGENTI
- Preparare sterili soluzioni stock 1000x di Fms legati tirosin-chinasi 3 (FLT-3) ligando, granulociti / macrofagi colony-stimulating factor (GM-CSF), fattore della cellula staminale (SCF), trombopoietina (TPO), interleuchina (IL) -3 e IL-6 in base alle istruzioni del produttore. Preparare sterile soluzione madre Retronectin (1mg/ml) anche in base alle istruzioni del produttore. Dividere queste soluzioni madri in piccole aliquote e conservare a -20 ° C per evitare il ripetersi di congelamento e scongelamento.
- Preparare il 2% FBS in IMDM.
- Preparare terreno completo IMDM con concentrazioni finale del 20% FBS, 2 mM glutammina, 100 unità / ml di penicillina / streptomicina (PS). Aggiungere le seguenti citochine appena prima dell'uso: 100 ng / ml FLT-3 ligando, 20 ng / ml GM-CSF, 100 ng / ml SCF, 100 ng / ml TPO, 50 ng / ml IL-3, e 100 ng / ml IL-6.
- Preparare 1% BSA in HBSS (Ca e Mg-free, senza rosso fenolo) e 2% di BSA in D-PBS (Ca e Mg-free). Sterilizzare le soluzioni, passando attraverso i filtri siringa 0,22 micron e conservare a 4 ° C.
- Preparare 0,02% EDTA in HBSS e conservare a 4 ° C.
- Preparare GALV-pseudotyped retrovirus codifica del DNA di interesse e conservare in aliquote a -80 ° C. Questa procedura non rientra nell'ambito di questo articolo, ma è descritto altrove (1-3).
Per la colorazione Giemsa
- Appena prima dell'uso, filtrare l'Wright / Giemsa soluzione macchia due volte a 1 micron carta filtro in una bottiglia di vetro pulito.
- Immediatamente prima dell'uso, preparare Wright / Giemsa tampone pH 6,4, mescolando 50 ml del filtrato Wright / Giemsa soluzione macchia e 200 ml di soluzione tampone fosfato, pH 6,4 - Giordano formula.
- Preparare una soluzione tampone fosfato, pH 6.0 sciogliendo 27,3 g di KH 2 PO 4 e 4,62 g di Na 2 HPO 4 in 3,5 LH 2 O.
- Preparare metanolo al 50% in H 2 O.
2. PROCEDURA
Scongelamento e pre-attivazione delle cellule CD34 +
- Scongelare una fiala di cellule CD34 + congelato rapidamente a 37 ° C agitando delicatamente fino a quando un ultimo cristallo di ghiaccio piccolo a sinistra e trasferire la sospensione cellulare (1 ml) in una provetta da 50 ml. Delicatamente risciacquare le celle rimanenti dalla fiala con 1 ml di temperatura ambiente 2% FBS / IMDM e aggiungerlo goccia a goccia per il tubo da 50 ml, mentre agitando delicatamente. Attendere 3 minuti. Poi, lentamente, aggiungere 2 ml del 2% FBS / IMDM, mescolando delicatamente, e attendere 3 minuti. Ripetere la procedura con l'aggiunta di 2% FBS / IMDM che è lo stesso volume come la sospensione cellulare diluita ad intervalli di 3 minuti, mescolando delicatamente tra le aggiunte, fino al volume finale raggiunge i 32 ml.
- Centrifugare a 250 xg per 10 minuti a temperatura ambiente e rimuovere il surnatante lasciando circa 0,5 ml.
- Lavare il pellet con la sospensione in 20 ml al 2% FBS / IMDM e la centrifugazione a 200g per 8 minuti a temperatura ambiente.
- Rimuovere il supernatante e sospendere le cellule in terreno IMDM completo a circa 0,5 x 10 6 cellule / ml. Prendere 10 ml di sospensione cellulare in un mix microtubo, con lo stesso volume di soluzione di Blu tripano (0,4%) e contare con un emocitometro.
- Diluire le cellule a 0,1-0,15 X 10 6 cellule / ml con l'aggiunta di terreno completo IMDM integrato con citochine (vedi 1.3)
- Coltivare le cellule in una umidificata a 37 ° C incubatore con 5% di CO 2 per 2 giorni.
Trasduzione retrovirale da virus pre-caricamento
- Il giorno della trasduzione, contare le celle prima di iniziare virus precarico per determinare il numero di pozzi da preparare.
- Diluire la soluzione Retronectin magazzino a 25 mg / ml e aggiungere 400 microlitri di ciascun pozzetto di una 24-e non-trattati piastra di coltura. Incubare per 2 ore a temperatura ambiente nella cappa a flusso laminare biosicurezza di pre-coat.
- Rimuovere la soluzione Retronectin e aggiungere 400 ml di BSA al 2% in D-PBS in ciascun pozzetto. Incubare per 30 minuti a temperatura ambiente.
- Scongelare soluzioni madri virus e tenere in ghiaccio. Rimuovere la soluzione di BSA, aggiungere 0,5 ml di preparazione del virus in ciascun pozzetto e centrifugare a 2200 xg a 4 ° C per 15 minuti.
- Rimuovere la soluzione di virus da pozzi e ripetere il caricamento del virus descritto in 2,10 altre tre volte.
- Lavare ogni pozzetto con acqua fredda 0,5 ml HBSS (+ Ca e Mg) o IMDM.
- Raccogliere le pre-attivato cellule CD34 + per centrifugazione a 200 xg per 8 minuti a temperatura ambiente.
- Risospendere le cellule a 0,1-0,15 x 10 6 cellule per 1,5 ml in media IMDM completa di citochine.
- Aggiungere 1,5 ml di sospensione cellulare in ciascun pozzetto e incubare umidificata in un incubatore a 37 ° C con 5% di CO 2 per 2 giorni.
L'ordinamento delle cellule e la raccolta di cellule trasdotte
- Delicatamente ma accuratamente sospendere le cellule del virus sopra-caricata piastras e filtrare attraverso un filtro di 50 micron CellTrics cellule in una provetta conica. Prendere 10 ml di sospensione cellulare in un mix microtubo, con un uguale volume di soluzione di Blu tripano e contare con un emocitometro. Lavare ogni pozzetto con 0,8 ml di freddo 0,02% EDTA / HBSS (Ca e Mg-free senza rosso fenolo) e aggiungere al tubo stessa collezione attraverso un filtro di 50 micron cellule CellTrics.
- Centrifugare le cellule a 200g per 8 minuti a 4 ° C, e lavare il pellet con il freddo HBSS (Ca e Mg-free senza rosso fenolo) per centrifugazione a 200 xg per 8 minuti a 4 ° C.
- Risospendere il pellet in 1% BSA / HBSS (Ca e Mg-free senza fenolo rosso) ad una concentrazione di 15 X 10 6 / ml o un volume minimo di 0,250 ml per l'ordinamento delle cellule. Mantenere le cellule in ghiaccio nel buio. Preparare una provetta contenente 20% FBS freddo / IMDM / Glutammina / PS medio per la raccolta delle cellule ordinati. L'ordinamento viene eseguito presso il Nucleo sorter ad alta velocità cella del J. Alvin Siteman Cancer Center della Washington University School of Medicine con una alta velocità MoFlo selezionatore (Dako, Glostrup, Danimarca).
CFC test
- Scongelare il numero richiesto di 3 ml di mezzi di dosaggio CFC. Energicamente per mescolare e lasciare le provette in posizione almeno 5 minuti per consentire eventuali bolle presenti a salire in superficie prima di aggiungere le cellule.
- Per ottenere la concentrazione di cellule per ogni campione ordinati, dividere il numero di cellulare fornito dalla struttura ordinamento in base al volume approssimativo sospensione cellulare. Prendere 3.000 virus trasdotte, le cellule ordinate in un microtubo sterile contenente fredda 2% FBS / IMDM. Pre-regolare il volume del 2% FBS / IMDM modo che il volume finale della sospensione sarà di circa 0,3 ml.
- Sospendere le cellule e trasferire l'intero 0,3 ml di sospensione cellulare ad una aliquota 3 ml di Methocult GF + H4435, che consiste di 1% di metilcellulosa, 30% FBS, 1% di BSA, 10 -4 M 2-mercaptoetanolo, 2 mM L-glutammina, 50 ng / ml SCF, 20 ng / ml GM-CSF 20 ng / ml di IL-3, 20 ng / ml di IL-6, 20 ng / ml G-CSF, e 3 unità / ml di eritropoietina in IMDM., Umano metilcellulosa Arricchito Media (R & D Systems), che consiste di 1,3% di metilcellulosa, 25% FBS, 1% di BSA, 5 x 10 -5 M 2-mercaptoetanolo, 2 mM L-glutammina, 50 ng / ml SCF, 20 ng / ml di GM-CSF, 20 ng / ml di IL-3, 20 ng / ml di IL-6, 20 ng / ml G-CSF, e 3 unità / ml in IMDM eritropoietina può anche essere usato.
- Energicamente per rendere il composto ascesa e la caduta completamente 3-4 volte. Lasciate che il tubo di stare fermo per 3 min.
- Collegare un calibro 16 ago smussato-end di una siringa da 3 ml e redigere 2,2 ml. Non redigere le bolle di grandi dimensioni; espellerli all'inizio spingendo fuori un paio di volte. Spingere fuori 1,1 ml ogni 30 millimetri in due non trattati piatto e distribuite il composto in modo uniforme mediante rotazione.
- Luogo duplicare le piastre in un piatto 100 millimetri con un piatto di acqua contenente 3 ml di acqua sterile. Cultura per 14 - 17 giorni.
- Caratterizzare e punteggio delle colonie in base alla loro morfologia con un microscopio rovesciato con ingrandimento 40x in un piatto di cultura contrassegnati con una griglia di punteggio. Ai fini del nostro test, le colonie sono classificati in 3 categorie: eritroide pura, mielomonocitica, e mista. Vedere le istruzioni del produttore per ulteriore sottoclassificazione colonia.
- L'intera piastra dosaggio CFC possono essere acquisiti senza ingrandimento usando un normale scanner a 600 dpi, e di bassa potenza (40x) microfotografie delle colonie possono essere scattate con un microscopio rovesciato dotato di una telecamera a colori.
- Per ulteriori analisi di differenziazione e proliferazione, le cellule dalla piastra intero saggio CFC vengono recuperati con la sospensione in diversi volumi della temperatura ambiente 2% FBS / IMDM. Dopo centrifugazione a 300 xg per 10 minuti a 4 ° C, le cellule sono risospese in 2% FBS / IMDM, contati, e sia macchiato con anticorpi per citometria a flusso o trasferiti alle diapositive utilizzando una centrifuga Cytospin per la colorazione Giemsa.
Anticorpi colorazione e citometria a flusso
- Cellule Centrifugare a 200 xg per 8 minuti a 4 ° C e risospendere a freddo nel siero del 50% del mouse normale in HBSS (Ca e Mg-free senza rosso fenolo).
- Luogo di circa 5 x 10 5 cellule in 80 microlitri per tubo (12 x 75 mm a fondo rotondo tubi) e tenere su ghiaccio. Aggiungi miscela di anticorpi (circa 20 microlitri miscela o soluzione di controllo negativo per non-anticorpo controlli) e mescolare leggermente toccando i tubi. Preparare tubi di controllo della calibrazione, senza o con un anticorpo anti-CD45 anticorpi per ogni fluorocromo. Tubi posto sul ghiaccio al buio e incubare per 20 minuti. Mescolare picchiettando leggermente provette dopo i primi 10 min. Dopo l'incubazione 20 min, riempire i tubi con HBSS freddo e centrifugare a 200 xg per 8 minuti a 4 ° C. Risospendere il pellet in freddo paraformaldeide 0,5% / HBSS.
Le seguenti miscele di anticorpi sono generalmente utilizzati per la nostra analisi. Per la differenziazione mieloide: CD11b (ficoeritrina coniugati clone ICRF44) / CD33 (allophycocyanin coniugato clone WM53) / CD45 (ficoeritrina-Cy7-congjugated clone HI30). Per la differenziazione eritroide: CD71 (ficoeritrina-coniugato clone M-A712) / CD235a (allophycocyanin coniugata con clone GA-R2) / CD45 (ficoeritrina-Cy7-congjugated clone HI30). - Citometria a flusso viene eseguita al core ad alta velocità Sorter cella del J. Alvin Siteman Cancer Center della Washington University School of Medicine su un citofluorimetro FACScan aggiornato a 5 colori e due laser (BD Biosciences) e analizzati utilizzando CellQuest (BD Biosciences) o FlowJO v7.2.4 (Albero Star, Inc., Ashland, OR, USA) del software.
Colorazione Giemsa
- Circa 30.000 cellule recuperate dai piatti dosaggio CFC sopra descritte sono sospesi in 0,3 ml 2% FBS / IMDM e trasferito a una diapositiva con una centrifuga Cytospin a 1.000 rpm per 10 minuti a temperatura ambiente.
- Impostare nove navi colorazione contenenti soluzioni nel seguente ordine.
- Metanolo assoluto
- Wright / Giemsa soluzione stock
- Wright / Giemsa tampone, pH 6,4
- 50% di metanolo in H 2 O
- H 2 O
- H 2 O
- Tampone fosfato, pH 6,0
- H 2 O
- H 2 O
- Porre i vetrini in un vettore di diapositive e tuffo in metanolo assoluto (# 1) per 2 minuti e asciugare fuori metanolo in eccesso.
- Immediatamente, immergere il vettore diapositiva Wright / Giemsa soluzione madre (# 2) per 5 min.
- Trasferire il vettore in Wright / Giemsa, pH 6.4 (# 3) e incubare per 10 min.
- Immergere il vettore due volte in metanolo al 50% (# 4), 10 volte in H 2 O (# 5), un altro 10 volte in H 2 O (# 6), e poi 5 volte in tampone fosfato, pH 6.0 (# 7) .
- Trasferire il vettore in H 2 O (# 8) e incubare per 2 minuti. Ripetere il lavaggio in H 2 O (# 9).
- Lasciare le diapositive asciugare completamente nel supporto. Rimuovere ogni diapositiva e pulire la parte posteriore del vetrino con metanolo-imbevuto Kimwipes per rimuovere le macchie. Mettere una goccia di Cytoseal 60 e un vetro di copertura per sigillare.
- Un 500-conta delle cellule differenziale è eseguita per ogni Giemsa-macchiate presentazione utilizzando un microscopio Olympus BX51. Le cellule si dividono in cinque categorie: le cellule primitive comprendono blasti e di promielociti; cellule mieloidi intermedie comprendono mielociti e metamielociti; cellule mieloidi mature comprendono bande, neutrofili segmentati, monociti e macrofagi, cellule eritroidi intermedia includono cellule con hemoglobinization intermedi; e maturare cellule eritroidi sono cellule con hemoglobinization pieno. Microfotografie sono scattate con una fotocamera Olympus DP71 con un obiettivo 60x olio.
3,0) risultati rappresentativi:
- Dosaggio CFC: Alcune delle popolazione di cellule ingresso sarà proliferano, si differenziano e colonie modulo a semi-solida media durante il 14-17 giorni di incubazione. In questo esperimento, è evidente che l'espressione del NUP98 HOXA9-oncogene causato la formazione di importanti rosso (colonie eritroidi) (Figura 1) (3).
- La colorazione degli anticorpi e Citometria a Flusso: immunofenotipizzazione citometria a flusso delle cellule raccolte da piastre test CFC fornisce informazioni sullo stato di differenziazione della popolazione cellulare. Con l'utilizzo combinato di anticorpi contro marcatori di differenziazione certo, la discendenza e il grado di maturazione delle cellule può essere valutata. In questo caso CD235a è stato utilizzato per identificare le cellule eritroidi. Come mostrato nella Figura 2A, NUP98-HOXA9 causato un aumento della percentuale di CD235a + cellule eritroidi, ma la luminosità di espressione CD235a da queste cellule è stato ridotto rispetto ai controlli, indicando l'inibizione della maturazione eritroide. In Figura 2B, le cellule mieloidi sono identificati in virtù della loro positività CD33. NUP98-HOXA9 causato una diminuzione del numero di cellule CD33 +, con una diminuzione della luminosità di espressione CD11b, coerente con l'inibizione della maturazione mieloide (3). Così i risultati mostrano che la citometria di flusso NUP98-HOXA9 causato un iperplasia eritroide con l'inibizione di maturazione sia mieloide ed eritroide.
- Colorazione Giemsa: esame morfologico delle cellule raccolte da piastre test CFC fornisce informazioni sul lignaggio e il grado di maturazione della popolazione cellulare. Le conclusioni ottenute morfologicamente possono differire da quelli ottenuti da studi di citometria a flusso, e quindi questi metodi sono complementari gli uni agli altri (3). L'esperimento viene ripetuto almeno 3 volte, e ogni volta che un 500-celle conta differenziale è eseguita a distinguere 5 categorie di cellule, come descritto sopra. Esempi di queste cellule sono segnalate nella Figura 3. I risultati sono tabulati e analizzati al fine di determinare se vi sono differenze statisticamente significative tra l'oncogene-trasdotte campione e il controllo. In questo caso, i risultati hanno mostrato che NUP98-HOXA9 ha causato un aumento complessivo del numeros delle cellule, con iperplasia eritroide e l'inibizione di entrambe le eritroide e maturazione mieloide (3) (non mostrato).
FIGURA LEGENDS

Figura 1: Gli effetti del NUP98-HOXA9 sulla morfologia CFC umano.
Primarie umane cellule CD34 + sono state trasdotte con retrovirally sia MSCV-IRES-GFP controllo vettoriale o vettoriale che esprime NUP98-HOXA9, e le cellule sono state ordinate per la positività GFP. Un migliaio di cellule sono state seminate in ognuna delle due piastre duplicati per dosaggio CFC e l'esperimento è stato ripetuto 3 4 volte indipendenti. Piastre rappresentante senza ingrandimento (a sinistra) e microfotografie a basso consumo di rappresentante colonie eritroidi (a destra) sono indicati (3).
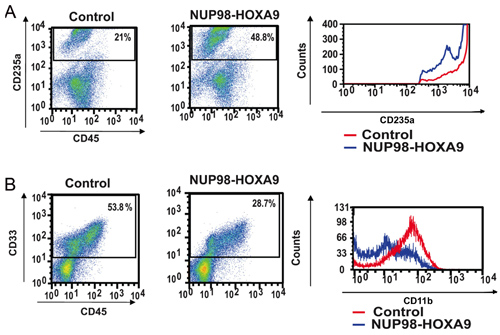
Figura 2: La citometria a flusso mostra interruzione umano primario differenziazione delle cellule CD34 + da NUP98-HOXA9.
(A) citometria a flusso per il differenziamento eritroide: Cellule dalle piastre CFC (vedi Figura 1) sono state raccolte e colorate con anticorpi CD45 e CD235a. Il CD235a + porta era tracciati su un istogramma (pannello di destra) per mostrare l'espressione di CD235a rispetto alle cellule di controllo (B) citometria a flusso per la differenziazione mieloide: Cellule dalle piastre CFC sono state raccolte e colorati con CD45 e CD33. Il CD33 + cancello è stato tracciato su un istogramma per mostrare l'espressione CD11b rispetto al controllo (pannello di destra). Le percentuali di cellule che rientrano ogni porta sono mostrati (3).
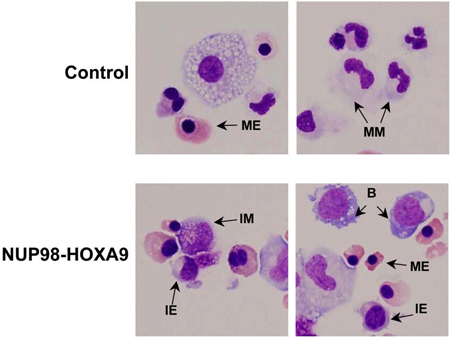
Figura 3: morfologia cellulare mostra interruzione di differenziazione da parte NUP98-HOXA9 rispetto al controllo vettoriale.
Strisci Cytospin sono stati preparati dai piatti CFC e colorati con Giemsa. Microfotografie sono state prese dai campi di rappresentanza con un obiettivo 60x olio. B: esplosione; MM: mieloide maturo, IM: mieloide intermedio, ME: maturo eritroide, IE: intermedio eritroidi (3).
Discussione
Il dosaggio CFC è stato ampiamente utilizzato per determinare la proliferazione e la differenziazione dei modelli di progenitori emopoietici e per studiare gli effetti di oncogeni (4, 5). Ha il vantaggio rispetto a colture liquide di essere un saggio clonale, tanto che le colonie rappresentano la progenie di un solo progenitore e può essere rimossa singolarmente per ulteriori analisi. La limitazione del dosaggio CFC è che non è adeguata per la rilevazione dei progenitori più immaturi o cellule staminali ematopoieti...
Divulgazioni
Riconoscimenti
Materiali
| Name | Company | Catalog Number | Comments |
| IMDM | Life Technologies | 12440 | |
| FBS | Stem Cell Technologies | 06150 | |
| L-Glutamine | Life Technologies | 25030 | |
| Penicillin/Streptomycin (PS) | Life Technologies | 15140 | |
| FLT-3 ligand | PeproTech Inc | 300-19 | |
| GM-CSF | PeproTech Inc | 300-03 | |
| SCF | PeproTech Inc | 300-07 | |
| TPO | PeproTech Inc | 300-18 | |
| IL3 | PeproTech Inc | 200-03 | |
| IL6 | PeproTech Inc | 200-06 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7030 | |
| EDTA | Fisher Scientific | BP118 | |
| Retronectin | Takara Bio Inc | T100A | |
| HBSS | Life Technologies | 14175 | |
| PBS | Life Technologies | 14200 | |
| Trypan Blue solution (0.4%) | Sigma-Aldrich | T8154 | |
| Methocult GF+ H4435 | Stem Cell Technologies | 04445 | |
| Human Methylcellulose Enriched Media | R&D Systems | HSC005 | |
| Wright/ Giemsa stain | Harleco | 64571 | |
| Phosphate Buffer Solution, pH 6.4 - Giordano formula | Ricca Chemical Company | 1450 | |
| Methanol | Fisher Scientific | A412-4 | |
| Cytoseal 60 | Thermo Fisher Scientific, Inc. | 8310 | |
| Normal Mouse Serum | Rockland Immunochemicals | D208 | |
| Anti-Human CD11b phyc–rythrin-conjugated | BD Biosciences | 555388 | |
| Anti-Human CD33 allophycocyanin-conjugated | BD Biosciences | 551378 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| Anti-Human CD71 phyc–rythrin-conjugated | BD Biosciences | 555537 | |
| Anti-Human CD235a allophycocyanin-conjugated | BD Biosciences | 551336 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| 24-well non-treated tissue culture plates | BD Biosciences | 35-1147 | |
| 30 mm non-treated dish | Stem Cell Technologies | 27150 | |
| 100 mm tissue culture dish | Fisher Scientific | 08-757-12 | |
| Gridded scoring dishes | Stem Cell Technologies | 27500 | |
| 15 ml centrifuge tubes | BD Biosciences | 35-2097 | |
| 50 ml centrifuge tubes | BD Biosciences | 35-2070 | |
| Syringes 3 ml | Stem Cell Technologies | 28240 | |
| 16 gauge blunt-end, 1½ inch needle | Stem Cell Technologies | 28110 | |
| 50 μm CellTrics cell filter | Partec | 04-004-2327 | |
| Hemocytometer | Fisher Scientific | 0267110 | |
| TPX sample chambers | Thermo Fisher Scientific, Inc. | A78710018 | |
| Fisherbrand Superfrost/Plus Microscope Slides, Precleaned | Fisher Scientific | 12-550-15 | |
| Shandon filter cards | Thermo Fisher Scientific, Inc. | 5991022 | |
| Shandon cytospin slide holder | Thermo Fisher Scientific, Inc. | 59920063 | |
| Shandon Complete Staining Assembly 100 | Thermo Fisher Scientific, Inc. | 100 | |
| Kimwipes | Kimberly-Clark Corporation | 34155 | |
| 1 μm filter paper | VWR international | 28307-134 | |
| Inverted microscope | Nikon Instruments | Diaphot | |
| Microscope camera | Nikon Instruments | DS-F11 | |
| Microscope | Olympus Corporation | BX51 | |
| Microscope camera | Olympus Corporation | DP71 | |
| Scanner | Microtek | Scanmaker 4 | |
| Vortex mixer | Fisher Scientific | 12-812 | |
| Tissue culture incubator | Sanyo | MCO-18AIC | |
| Cytospin | Shandon, Inc. | Cytospin 2 | |
| Bench-top centrifuge | Eppendorf | 5810-R | |
| Water purification system | Barnstead | Nanopure-Diamond |
Riferimenti
- Takeda, A., Goolsby, C., Yaseen, N. R. NUP98-HOXA9 induces long-term proliferation and blocks differentiation of primary human CD34+ hematopoietic cells. Cancer Res. , 66-6628 (2006).
- Yassin, E. R., Abdul-Nabi, A. M., Takeda, A., Yaseen, N. R. Effects of the NUP98-DDX10 oncogene on primary human CD34+ cells: role of a conserved helicase motif. Leukemia. , (2010).
- Yassin, E. R., Sarma, N. J., Abdul-Nabi, A. M., Dombrowski, J., Han, Y., Takeda, A., Yaseen, N. R. Dissection of the transformation of primary human hematopoietic cells by the oncogene NUP98-HOXA9. PLoS One. 4, e6719-e6719 (2009).
- Nissen-Druey, C., Tichelli, A., Meyer-Monard, S. Human hematopoietic colonies in health and disease. Acta Haematol. 113, 5-96 (2005).
- Pereira, C., Clarke, E., Damen, J. Hematopoietic colony-forming cell assays. Methods Mol Biol. 407, 177-208 (2007).
- Coulombel, L. Identification of hematopoietic stem/progenitor cells: strength and drawbacks of functional assays. Oncogene. 23, 7210-7222 (2004).
- Hogge, D. E., Lansdorp, P. M., Reid, D., Gerhard, B., Eaves, C. J. Enhanced detection, maintenance, and differentiation of primitive human hematopoietic cells in cultures containing murine fibroblasts engineered to produce human steel factor, interleukin-3, and granulocyte colony-stimulating factor. Blood. 88, 3765-3773 (1996).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon