Method Article
Imaging in vivo di intatto Larve di Drosophila a livello sub-cellulare Risoluzione
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive un metodo affidabile per l'anestesia e l'imaging di intatta Drosophila melanogaster Larve. Abbiamo utilizzato il anestetico volatile desflurano per consentire immagini ripetitive a livello sub-cellulare risoluzione e re-identificazione di strutture fino a pochi giorni 1.
Abstract
Recenti miglioramenti nel campo dell'imaging ottico, fluorofori geneticamente codificato e strumenti genetici permettono stabilimento efficiente delle desiderato linee di animali transgenici hanno permesso i processi biologici da studiare nel contesto di una vita, e in alcuni casi anche comportarsi, organismo. In questo protocollo verrà descritto come anestetizzare intatte le larve di Drosophila, utilizzando il anestetico volatile desflurano, per seguire lo sviluppo e la plasticità sinaptica delle popolazioni a una risoluzione 1-3 sub-cellulare. Mentre gli altri metodi utili per anestetizzare le larve di Drosophila melanogaster sono stati precedentemente descritti 4,5,6,7,8, il protocollo presentato nel presente documento dimostra miglioramenti significativi per le seguenti caratteristiche combinate principali: (1) Un elevato grado di anestesia, anche il battito cardiaco viene arrestato consentendo risoluzione laterale fino a 150 nm 1, (2) un elevato tasso di sopravvivenza del> 90% per ciclo di anestesia, che consentono la registrazione di oltre cinque punti-tempo in un periodo di ore o giorni 2 e ( 3) una sensibilità elevata che ci permette in 2 casi per studiare la dinamica delle proteine espresse a livelli fisiologici. Nel dettaglio, siamo stati in grado di visualizzare i post-sinaptica subunità del recettore del glutammato GluR-IIA espresso tramite il promotore endogeno 1 in stabile linee transgeniche e la linea trappola FasII esone-GFP 1. (4) A differenza di altri metodi di 4,7 le larve possono essere esposte non solo vivo, ma anche interi (cioè non sezionato) che consente l'osservazione che si verifichi un certo numero di giorni 1. I dettagli del video che accompagna la funzione delle singole parti della camera di imaging in vivo 2,3, il corretto montaggio delle larve, la procedura di anestesia, come ri-identificare le posizioni specifiche all'interno di una larva e la rimozione sicura delle larve dalle immagini da camera.
Protocollo
A) Assemblea della camera di imaging
- Seleziona una larva di fase scelto (ad esempio, all'inizio del 3 ° larve instar lasciando un intervallo di osservazione di circa 24 ore a 25 ° C fino errante stadio).
- Sciacquare la larva con acqua per pulire il terreno di coltura e tamponare asciugare.
- Rivestire il centro dell'elemento fondo della camera, la regione ad affrontare la larva, con un sottile strato di olio alocarburi.
- Mettere la larva con il lato ventrale rivolto verso l'obiettivo microscopio nella camera (consente di giunzione neuromuscolare (NMJ) 26 e 27 per essere ripreso) (Figura 1 AE).
- Posizionare il distanziatore in plastica sullo strato di petrolio, con la prese d'aria del viso verso l'alto della griglia (Figura 1 A). Si prega di verificare a questo punto: L'altezza del distanziatore è circa la metà del diametro larvale, la larghezza della fessura dovrebbe essere circa il doppio del diametro della larva.
- Posizionare la camera di immagini al microscopio
B) anestesia della larva
- Collegare i due ingressi della camera con un appropriato dispositivo di anestesia / vaporizzatore.
Si prega di verificare up-front:
La concentrazione efficace di desflurane nella camera d'aria non deve mai superare quella indicata dalle norme di sicurezza! Solo un piccolissimo volume totale di desflurane è necessaria per anestetizzare le larve. L'applicazione del 15% (v / v) di desflurano 1 ha dimostrato di essere un buon punto di partenza per determinare la concentrazione ideale per essere usato in un esperimento. Per motivi di sicurezza si consiglia che il vaporizzatore non dovrebbe contenere più del necessario desflurano per 2-4 ore di imaging in vivo. - Immergere l'altra estremità del tubo collegato alla uscita della camera in un bicchiere d'acqua e poi aprire le valvole che controllano il flusso dei anestetico nella camera per circa cinque secondi.
Si prega di verificare in questa fase:
Fare le bolle d'aria salire in acqua? Se la camera non è che perde. - Chiudere le valvole per circa tre secondi.
- Monitorare i movimenti residui larvale al microscopio. Verificare sia il battito cardiaco e movimenti muscolari. Se necessario le valvole aprono e si chiudono come descritto al punto 8 e 9 fino anestesia della larva è completa, quindi chiudere tutte le valvole e iniziare imaging.
Si prega di verificare in questa fase:
Movimento muscolare residua o di battito cardiaco indica che la larva non viene adeguatamente anestetizzato. Anestesia completa è di vitale importanza per le immagini ad alta risoluzione. La larva normalmente non dovrebbero essere anestetizzati per più di 15-20 minuti in un dato momento.
C) Imaging
- Identificare la corretta posizione e l'immagine della struttura di interesse (Figura 2-4).
D) Il recupero da anestesia
- Dopo l'imaging è completato entrare aria nella camera.
Si prega di verificare in questa fase:
Controllare il battito cardiaco e contrazioni muscolari della larva di luce alogena trasmessa. Come i muscoli comincerà a contrarsi, è possibile rimuovere la larva dalla camera di imaging. - Staccare la camera dal dispositivo di anestesia e rimuoverlo dal microscopio. Smontare la camera con attenzione e posto la larva nel medio purè di coltivazione volare.
- Conservare il piatto in un incubatore alla temperatura appropriata.
E) Tempo di serie
- Ripetere i passaggi 2-14 punti fino a un tempo sufficiente sono stati ottenuti.
Alternative protocollo:
Se la larva è quello di essere ripreso più di una volta all'interno di un intervallo di 30 minuti potrebbe essere pratico di lasciarlo nella camera di imaging fino al punto successivo momento anestesia. Ripetere i passaggi 7-14 punti fino a un tempo sufficiente sono stati ottenuti.
Si prega di verificare in questa fase:
La larva non deve essere conservato nella camera di imaging per più di due ore alla volta, né è di essere anestetizzati per più di 15-20 minuti alla volta.

Figura 1 Assemblea della camera di imaging. (A) Posizionare la larva e il distanziatore in plastica sullo strato di olio. (B) Mettere un 22 x 22 mm sul vetrino il distanziale e inserire l'anello di guida in plexiglas nella camera accanto (C) fissare la posizione della larva con l'anello in metallo e (D) nei pressi della camera. (E) Ora la camera è pronto per essere montato sul microscopio.
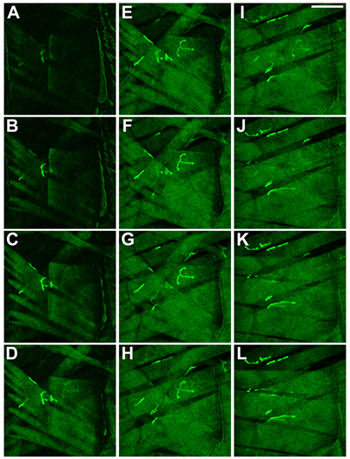
Figura 2 Body-muro muscoli larve di Drosophila. Muscoli e NMJs sono stati visualizzati mediante espressione di un CD8-GFP-Sh proteina di fusione 8. I muscoli sono mostrati come osservato quando concentrandosi sul lato ventrale attraverso la cuticola nella larva. In (CA) il muscolo più superficiale, 27 anni, è dimostrato, in (KL), i muscoli più interna, 6 e 7, sono mostrati. Scala Bar: 100 micron, ΔZ tra le sezioni è di 2 micron.

Figura 3 Identità del corpo parete muscoli larve di Drosophila. L'identità dei muscoli larve L3 Drosophila, A3 segmento, viene visualizzato. Muscoli e NMJs sono stati visualizzati mediante espressione di un CD8-GFP-Sh proteina di fusione 8. I muscoli vengono visualizzati come osservato quando concentrandosi sul lato ventrale attraverso la cuticola in larve. In AC il muscolo più superficiale, 27 anni, è dimostrato, nel KL i muscoli più interno, 6 e 7, sono mostrati. Scala Bar: 100 micron, ΔZ tra le sezioni è di 2 micron.
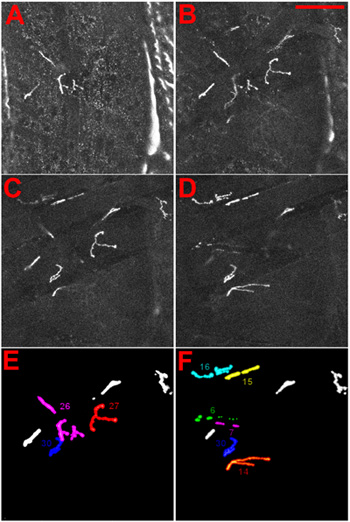
Figura 4 Identità di giunzioni neuromuscolari di larve di Drosophila. (AD) NMJs sono state visualizzate da espressione di un DGluRIIA-MRFP proteina di fusione 1. Il NMJs sono mostrate come osservato quando concentrandosi sul lato ventrale attraverso la cuticola in larva. In (AB) il più superficiale NMJ, 27 anni, è dimostrato, CD NMJs più interno, 6 e 7, sono mostrati. Scala Bar: 100 micron, ΔZ tra le sezioni è di 5 micron. (E) e (F) l'identità del superficiale (E) e più interni (F) NMJs è dato per riferimento.
Discussione
Il metodo proposto è stato inizialmente sviluppato per studiare le sinapsi glutammatergica sui muscoli della parete del corpo delle larve di Drosophila melanogaster. La Drosophila giunzione neuromuscolare (NMJ) è caratterizzato da una stereotipata cito-architettura dei muscoli e neuroni ed è quindi ideale per l'imaging in vivo. Tuttavia, il protocollo di anestesia descritto non è limitata alle immagini del NMJ, la trasparenza delle larve di Drosophila facilita l'adattamento del protocollo descritto per studiare lo sviluppo degli organi, la migrazione delle cellule, il trasporto di merci assonale e sub-cellulare riorganizzazione all'interno delle cellule.
Divulgazioni
Riconoscimenti
Ringraziamo Andreas Schönle, Max-Plank-Institut di chimica biofisica, Germania e David J. Sandstrom, National Institute of Mental Health, National Institutes of Health, Bethesda, MD, USA per un parere tecnico. Ringraziamo Frank Kötting, European Neuroscience Institute di Gottinga per la costruzione della camera di imaging e il dispositivo di anestesia. Questo lavoro è stato sostenuto dalle concessioni dal Forschung Alzheimer Iniziativa per TMRYZ è stato sostenuto da una borsa di studio della borsa di studio in Cina Consiglio, SBH da una borsa di studio della Graduate School per Cellulare e Molecolare Neuroscienze, Università di Tubinga.
Materiali
Reagenti:
- Desflurano (Suprane, Baxter, Unterschleißheim, Germania)
- Halocarbon olio (ad esempio Voltalef H10S olio / Atofina, Puteaux, Francia)
- Vola terreno di coltura
Attrezzatura:
- Invertito microscopio confocale
- Microscopio binoculare (ad esempio Stemi 2000, Carl Zeiss, Jena, Germania)
- Pennello piccolo utilizzato per ordinare le mosche
- Incubatrice
- Costruito su misura da camera per immagini (Per i disegni meccanici vedere rif. 3)
- Vaporizzatore / anestesia periferica (Per i dettagli vedi rif. 3)
Riferimenti
- Rasse, T. M. Glutamate receptor dynamics organizing synapse formation in vivo. Nat Neurosci. 8, 898-905 (2005).
- Rasse, T. M. . In vivo imaging of long-term changes in the Drosophila neuromuscular system [dissertation]. , (1988).
- Fuger, P., Behrends, L. B., Mertel, S., Sigrist, S. J., Rasse, T. M. Live imaging of synapse development and measuring protein dynamics using two-color fluorescence recovery after photo-bleaching at Drosophila synapses. Nat Protoc. 2, 3285-3298 (2007).
- Wang, X., Schwarz, T. L. Imaging axonal transport of mitochondria. Methods in enzymology. 457, 319-333 (2009).
- Vinegoni, C. Mesoscopic fluorescence tomography for in-vivo imaging of developing Drosophila. J Vis Exp. , (2009).
- Lin, C. Y. Label-free imaging of Drosophila larva by multiphoton autofluorescence and second harmonic generation microscopy. Journal of biomedical optics. 13, 050502-050502 (2008).
- Levitan, E. S., Lanni, F., Shakiryanova, D. In vivo imaging of vesicle motion and release at the Drosophila neuromuscular junction. Nat Protoc. 2, 1117-1125 (2007).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y. &. a. m. p. ;. a. m. p., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon