È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Slice Cultura organotipica di GFP che esprimono embrioni di topo per imaging in tempo reale della crescita degli nervi periferici
In questo articolo
Riepilogo
Vi presentiamo un metodo per preparare le fette di organotipica metà gestazione embrioni di topo per l'imaging coltivazione e time-lapse di escrescenza dei nervi periferici.
Abstract
Per molti scopi, la coltivazione di embrioni di topo ex vivo come fette organotipica è auspicabile. Per esempio, impieghiamo una linea di topo transgenico (tauGFP) in cui la versione migliorata della proteina verde fluorescente (EGFP) è esclusivamente espressa in tutti i neuroni del sistema di sviluppo nervoso centrale e periferico 1, ammettendo la possibilità ad entrambi film di innervazione del la zampa anteriore e di manipolare questo processo con tecniche farmacologiche e genetiche 2. Il parametro più critico di successo nella coltivazione di culture fetta tale è il metodo con cui vengono preparate le fette. Dopo un'ampia sperimentazione di una varietà di metodi, abbiamo scoperto che una vibratome è il dispositivo migliore per affettare gli embrioni in modo tale da risultare in routine di una cultura che dimostra la vitalità in un periodo di diversi giorni e, soprattutto, si sviluppa in un'epoca specifico modo. Per la metà della gestazione gli embrioni, questo include la conseguenza normale di nervi spinali dal midollo spinale e gangli delle radici dorsali ai loro obiettivi in periferia e alla corretta decisione del tessuto scheletrico e muscolare.
In questo lavoro, presentiamo un metodo per l'elaborazione di embrioni intero del giorno embrionale (E) E10 a E12 in 300-400 fette micrometro per la coltivazione in una cultura incubatore standard di tessuto, che può essere studiato per un massimo di due giorni dopo la preparazione fetta. Critico per il successo di questo approccio è l'uso di un vibratome per tagliare ogni agarosio-embedded embrione. Questa è seguita dalla coltivazione delle fette su inserti cultura membrana Millicell posti sopra un piccolo volume di media, risultando in una tecnica cultura interfaccia. Una cucciolata con una media di 7 embrioni produce regolarmente almeno 14 fette (2-3 fette della regione degli arti anteriori per embrione), che varia leggermente a causa dell'età degli embrioni e allo spessore delle fette. Circa l'80% delle fette colta spettacolo escrescenza del nervo, che può essere misurato througout i 2 periodo coltura. Risultati rappresentativi utilizzando la linea del mouse tauGFP sono dimostrati.
Protocollo
Parte 1: Preparazione per affettare e coltura.
- Preparare 10 cm piastre di coltura di tessuto con taglio medio (DMEM, 25% 1x HBSS, il 25% di siero fetale bovino, 0,5% di glucosio, 1 mM glutammina, 2,5 HEPES mM, pH 7,3) e di 3 cm Millicell-CM 0.4-micron cultura inserti in membrana e di tenere incubatore a 37 ° C e 5% di CO 2.
- Riscaldare il 4% agarosio a basso punto di fusione in PBS nel forno a microonde e tenerlo a piastra di riscaldamento in modo che rimanga a circa 37 ° C.
- Riempi i piatti batteriologico 10 cm di Petri con PBS (140 mM NaCl, 2.7 mM KCl, 10 mM Na 2 HPO 4, 1,8 KH 2 PO 4) e posto sul ghiaccio.
- Imposta dispositivo di raffreddamento microtomo o garantire che vassoio di buffer e raffreddamento elementi sono memorizzati in freezer per pre-raffreddare.
Parte 2: embedding Embryo.
- Sezionare embrioni dall'utero ed esaminarle con un microscopio invertito a fluorescenza per verificare l'espressione della GFP.
- Embrioni posto su una rovesciata di 10 cm piastra di Petri e orientarli con strisce di carta Whatman per rimuovere eccessivo PBS.
- Applicare agarosio sull'embrione per risolvere il problema in questa posizione. Lasciate solidificare agarosio.
- Limitare l'area che circonda l'embrione da taglio con una lama di rasoio.
- Ruotare l'embrione embedded sul suo lato.
- Applicare ulteriori agarosio sul tessuto embrionale per assicurare che l'embrione sia completamente incorporato.
- Preparare blocco agarosio con bordi puliti e montata sul mandrino vibratome utilizzando Loctite 406, una speciale colla simile a "Glue Krazy".
Parte 3: Sfogliatrici procedura.
- Impostare il vassoio di buffer preraffreddato e l'elemento di raffreddamento.
- Inserire il mandrino con il tessuto incollato e aggiungere 1x HBSS (Ca 2 +-Mg 2 + senza HBSS, 10 mM tampone HEPES pH 7,3, 500 U / ml di penicillina / streptomicina) fino al coperto.
- Inserire e fissare un predepurata (70% etanolo) lama microtomo.
- Preparare 350-450 fette micron e trasferirli usando accorciato vetro pipette pasteur in piastre di coltura di tessuti conservati in ghiaccio.
- Usando un paio di pinze, rimuovere con attenzione agarosio da ogni fetta e trasferimento Millicell membrane cultura. Circa 4 fette può essere coltivato su una membrana in un piatto di 10 cm di coltura tissutale pieno con 6 ml di terreno di coltura.
- Incubare fette a 37 ° C e 5% di CO 2 (Terreno di coltura: DMEM, 25% 1x HBSS, 25% siero fetale bovino, 0,5% di glucosio, 1MM glutammina, 2,5 HEPES mM, pH 7,3). Se si esegue time-lapse serie di immagini si deve mantenere costante il volume del mezzo. Nel caso di serie a tempo di imaging per un breve lasso di tempo è sufficiente lasciare il medium così com'è. Per le modifiche cultura periodi più lunghi, dopo 12-20 ore sono raccomandati.
Parte 4: escrescenza Imaging nervo spinale al microscopio.
- Nervi spinali immagine mettendo una di 10 cm piastra di coltura dei tessuti, contenenti le membrane cultura Millicell con le fette, sotto un microscopio a fluorescenza in posizione verticale.
- Etichetta l'orientamento delle membrane cultura Millicell sul palco microscopio per posizionare correttamente durante il punto successivo tempo di imaging.
- Escrescenza del nervo spinale immagine usando 4x (apertura numerica [NA] 0,1), 10x (NA 0,3), o 20x (NA 0,5) obiettivi.
La figura 1 mostra una serie di immagini raffiguranti la conseguenza del nervo spinale durante 20 ore di cultura con obiettivi 4x e 10x.
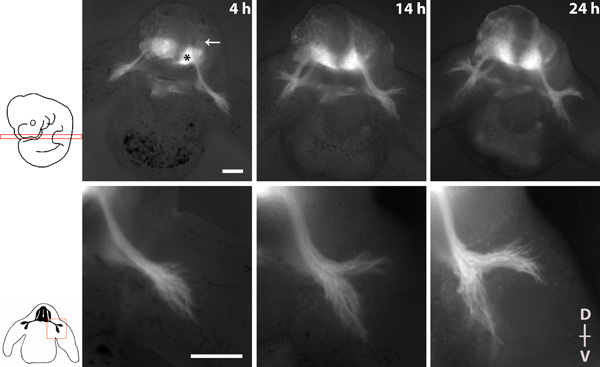
Figura 1 serie Imaging di escrescenza nervo spinale in una fetta trasversale di un embrione omozigote tauGPF. * = Motoneuroni del midollo spinale ventrale, freccia = DRG. La dorsale (D)-ventrale (V) asse della fetta viene indicato. Scalebars: 200 micron.
Discussione
In un confronto di metodi per preparare culture fetta embrionale di metà gestazione embrioni di topo (E10 - E12), abbiamo osservato che una vibratome produce senza dubbio i risultati più attendibili rispetto sia alla viabilità complessiva della culture e la riproducibilità dei il nervo escrescenza modelli. Al contrario, fette preparati con un elicottero dei tessuti McIlwain 3 dimostrato di essere completamente non vitali. Inizialmente abbiamo utilizzato un metodo ghigliottina 4, in cui un inter...
Riconoscimenti
Gli autori riconoscono la fonte originale per l'idea di eseguire cultura fetta su embrioni di topo 5. Vorremmo ringraziare Gioacchino Kirsch per generoso supporto scientifico e Anna Degen per agire come il nostro tuttofare durante le riprese. Questo lavoro è stato finanziato dalla Fondazione per la Ricerca tedesca (Deutsche Forschungsgemeinschaft: Sonderforschungsbereich 488, Teilprojekt B7/B9) e l'Università di Heidelberg (Eccellenza Cluster reti cellulari).
Materiali
| Name | Company | Catalog Number | Comments |
| HBSS 10x | GIBCO, by Life Technologies | 14180 | |
| Dissection tools | Fine Science Tools | various | |
| L.M.P. agarose | Invitrogen | 15517-022 | |
| Whatmann paper | Whatman, GE Healthcare | 3030917 | |
| Shortened firepolished pipettes | |||
| DMEM | GIBCO, by Life Technologies | 41966 | |
| FBS | GIBCO, by Life Technologies | 10270-106 | |
| Pen Strep | GIBCO, by Life Technologies | 15140 | |
| L-glutamine 100x | GIBCO, by Life Technologies | 25030 | |
| Vibratome | Microm International | HM 650 V | |
| Fluorescent microscope | Olympus Corporation | BX61WI | |
| analySIS | Soft Imaging System | ||
| Millicell-CM inserts | EMD Millipore | PICMORG 50 | |
| 10 cm culture plates | Greiner Bio-One | 633171 | |
| LOCTITE 406 | Henkel Corp | 142580 | |
| Razor blades | Thermo Fisher Scientific, Inc. | none | |
| Dissecting microscope | Nikon Instruments | SMZ800 | |
| HEPES | Carl Roth Gmbh | 9105.2 | |
| Glucose | Sigma-Aldrich | G7021 | |
| x4 objective | Olympus Corporation | PL series | |
| x10 objective | Olympus Corporation | UPLFL –PH series | |
| Filter | Olympus Corporation | U-MNIBA2 | |
| CCD camera | Soft Imaging System | SIS F-View II | |
| Equipment for heated chamber | Leica Microsystems | CTI-Controller 3700 and incubator S #11531171 |
Riferimenti
- Tucker, K. L., Meyer, M., Barde, Y. A. Neurotrophins are required for nerve growth during development. Nat Neurosci. 4, 29-37 (2001).
- Brachmann, I., Jakubick, V. C., Shaked, M., Unsicker, K., Tucker, K. L. A simple slice culture system for the imaging of nerve development in embryonic mouse. Dev Dyn. 236, 3514-3523 (2007).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. Journal of neuroscience methods. 59, 5-9 (1995).
- Katz, L. C. Local circuitry of identified projection neurons in cat visual cortex brain slices. J Neurosci. 7, 1223-1249 (1987).
- Hotary, K. B., Landmesser, L. T., Tosney, K. W. Embryo slices. Methods Cell Biol. 51, 109-124 (1996).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon