Method Article
Accoppiato a pinza registrazioni patch da Motor-neurone e muscolo scheletrico bersaglio in Zebrafish
In questo articolo
Riepilogo
Larvale zebrafish rappresentano il primo sistema modello vertebrato per consentire la registrazione simultanea patch clamp da un neurone spinale a motore e la destinazione del muscolo scheletrico. Questo video mostra i metodi microscopici utilizzato per identificare un CAP segmentale motore neuroni e cellule muscolari bersaglio così come le metodologie per la registrazione da ogni tipo di cellula.
Abstract
Larvale zebrafish rappresentano il primo sistema modello vertebrato per consentire la registrazione simultanea patch clamp da un neurone spinale a motore e la destinazione dei muscoli. Questa è una conseguenza diretta della accessibilità per entrambi i tipi di cellule e la capacità di distinguere visivamente il tetto unico segmentale motore neurone sulla base della morfologia e la posizione. Questo video mostra i metodi microscopici utilizzato per identificare un CAP motore neuroni e cellule muscolari bersaglio così come le metodologie per la registrazione da ogni tipo di cellula. Identificazione del motore tipo-neurone CaP è confermato da uno riempimento tintura o dalle caratteristiche biofisiche, come forma d'onda del potenziale d'azione e resistenza d'ingresso delle cellule. Motore neurone registrazioni di routine scorso per un'ora consentendo a lungo termine le registrazioni da cellule bersaglio più diversi muscolare. Il controllo del motore neurone modello cottura consente misurazioni della frequenza-dipendenza della trasmissione sinaptica a livello della giunzione neuromuscolare. A causa di una grande dimensione quantica e basso rumore fornite dal morsetto intera tensione di cella, tutti gli eventi unitario può essere risolto nel muscolo. Questa funzione permette di studiare le proprietà fondamentali sinaptica come le proprietà di rilascio, il riciclo delle vescicole, così come la depressione sinaptica e facilitazione. I vantaggi offerti da questo in vivo preparazione eclissi precedenti sistemi neuromuscolari modello studiato in cui il motore neuroni sono di solito stimolati da elettrodi extracellulari ed i muscoli sono troppo grandi per delle patch clamp intera cellula. La preparazione zebrafish è riconducibile alla combinazione di analisi elettrofisiologiche con una vasta gamma di approcci tra cui linee transgeniche, knockdown morfolino, l'intervento farmacologico e imaging in vivo. Questi approcci, insieme con il crescente numero di modelli di malattia neuromuscolare forniti da linee mutanti di zebrafish, aprire la porta per la nuova comprensione dei diritti umani malattie neuromuscolari.
Protocollo
1. Preparazione di pesce per Recordings associati
- Prima di iniziare la procedura, preparare cinque soluzioni chiave, tra cui: Bagno Solution, Solution Bagno con Tricaine (MS222), Soluzione Bagno con Formammide, Neuron soluzione interna e la soluzione del muscolo interno.
- Successivamente, raccogliere un pesce zebra singolo larvale di età compresa tra 72 a 96 ore e il luogo in Solution Bagno con Tricaine. Entro un minuto di esposizione al anestetico, il pesce non risponde al tatto.
- Mettere il pesce su un piatto di plastica e, utilizzando uno stereomicroscopio, decapitare con un rasoio a doppia lama bordo.
- Trasferire il pesce in una camera di registrazione di vetro rivestito con sylgard e riempito di soluzione del bagno. Fissare ad ogni estremità con l'inserimento di perni di tungsteno elettroliticamente affinato attraverso la notocorda.
- Creare un lembo cutaneo verso la fine rostrale del pesce con uno spillo che fornirà una presa adeguata per un paio di pinze fine. Togliere la pelle sovrastante afferrandolo vicino al pin rostrale con un paio di pinze fine. Sbucciare lentamente in direzione caudale per rimuovere la pelle.
- Trattare il pesce con 3 ml di soluzione da bagno con Formammide per 3-5 minuti per bloccare le contrazioni muscolari che potrebbero interferire con le registrazioni. Lavare 5 volte con la soluzione di Bagno normale. Rimuovere parte dello strato superficiale del muscolo da 5 a 6 segmenti delicatamente rottamazione con il lato di uno spillo tungsteno.
- Trasferire il pesce ad un microscopio verticale situato in una gabbia di Faraday per schermare il rumore elettrico. Il microscopio è dotato di un palco fisso, lunga obiettivo 40x distanza di 0,5 e zoom a 4x. Il microscopio è montato su un palcoscenico motorizzato traduzione XY in modo da spostare la preparazione tra nervo e muscolo in alta potenza. L'uso di ottiche interferenza differenziale contrasto aiuta a visualizzare i neuroni.
- Sotto zoom 0,5 x, utilizzare un ampio foro di 15 micron pipetta per rimuovere muscolare sovrastante ed esporre il midollo spinale. Pressione negativa viene applicata attraverso una siringa da 3 cc usa e getta e le cellule muscolari vengono rimosse una ad una. Questa procedura viene ripetuta per 5 o 6 segmenti dorsale del muscolo scheletrico. Lo stesso ampio foro pipetta viene utilizzato per rimuovere anche la parte superiore due strati di muscoli ventrali obiettivo di ottenere velocemente dei muscoli scheletrici.
- Questo completa la preparazione per le registrazioni appaiati e lo zoom microscopio è aumentata a circa 1,6 volte.
2. Registrazioni accoppiato della PAC motore neurone e cellule muscolari target
- I segmenti pulite vengono analizzati per individuare i neuroni PAC. Ogni emi-segmento del midollo spinale contiene un grande, diametro 10 micron, Cap-neurone motore. Questa soma a forma di lacrima si trova superficialmente sotto la dura madre spinale verso la fine più caudale del confine segmentale. Un neurone CaP viene scelto per la registrazione e il muscolo bersaglio ventrale del segmento adiacente caudale viene analizzato per verificare l'integrità.
- Due elettrodi patch sono posizionati per la registrazione, una per il neurone e un secondo per il muscolo. L'elettrodo superiore ha una conicità poco profonda per la penetrazione della dura spinale dura e un'apertura di circa 2 micron. L'elettrodo inferiore ha un cono più ripida per la registrazione a bassa resistenza morsetto di tensione del muscolo scheletrico
- Posizionare l'elettrodo neurone in un angolo di circa 30 gradi di penetrare la dura madre spinale, circa la metà del segmento anteriore del neurone CaP selezionato. Anticipo l'elettrodo con un manipolatore assiale, mentre applicando una leggera pressione positiva continua di circa 60 millimetri di mercurio. Come l'elettrodo sfonda la dura, la PAC neurone può essere spostato dalla perfusione dall'elettrodo, che richiedono un riaggiustamento della messa a fuoco.
- Quando l'elettrodo tocca il CaP neurone soma pressione positiva viene rilasciata e di solito provoca la formazione immediata di un sigillo gigaohm. Tuttavia, in alcuni casi in cui un sigillo non riesce a formarsi, diventa necessario applicare una leggera pressione negativa. Dopo la formazione di tenuta, il potenziale dell'elettrodo viene regolata a 80mV e l'applicazione di pressione negativa rottura della membrana cellulare. Il neurone CaP è caratterizzata da una resistenza di ingresso di 140-180 Mega-ohm e un potenziale d'azione che il superamento 40 millivolt. Questo è testato iniettando aumento incrementale passi depolarizzanti sotto morsetto corrente fino a quando il potenziale di azione si manifesta.
- Successivamente, il microscopio è trasferita a muscoli ventrali con il traduttore XY motorizzati con potenza elevata. Una cellula muscolare veloce è scelto dal campo di destinazione.
- L'elettrodo muscolo è avanzato verso la cellula muscolare bersaglio sotto pressione positiva, che quando viene rilasciato, forma un sigillo gigaohm. Il potenziale dell'elettrodo viene regolata a -50 millivolt per inattivare i canali del sodio e sotto succhiare dolce la membrana cellulare si rompe. Un calo della resistenza a 100-200 Mega-ohm e l'improvvisa apparizione del grande ingresso capacitivo transitori segnali.
- Per testareper la registrazione appaiati, il motore-neurone è depolarizzata da iniezioni incrementale maggiore di corrente fino a quando un potenziale d'azione si manifesta. A questo punto una corrente placca deve essere raggiunta in muscolo. Stimolazione continua del motorneuron a 1 risultati Hertz correnti placca motrice senza guasti. Come la frequenza di stimolo viene aumentata a 100 Hertz le correnti di placca variano in ampiezza e subire l'esaurimento funzionale entro 10 secondi di stimolazione.
3. Rappresentante Risultati
Tipicamente, il neurone di registrazione è stabile per un massimo di un'ora, ma le cellule muscolari si deteriorano, come riflessi in un incremento della resistenza serie. Quando questo si verifica l'esperimento può essere interrotto o un'altra cellula muscolare è di patch bloccato. Tutte le registrazioni dovrebbero essere completati entro un'ora.
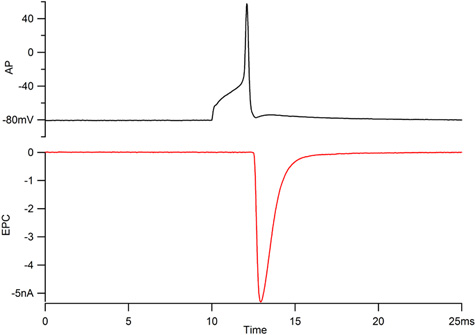
Figura 1. Registrazioni del potenziale d'azione motorneuron (AP, in alto) e la placca muscolare associato corrente (EPC, in basso). Il potenziale d'azione di un neurone PAC dovrebbe overshoot 40 mV e l'EPC dovrebbe salire a 300 msec e di degrado lungo un corso a tempo esponenziale con una costante di tempo inferiore a 1 msec.
| Nome | Ricetta |
| Bagno Solution (in mm) | 134 NaCl, 2.9 KCl, 2.1 CaCl 2, 1.2 MgCl 2, 10 Glucosio, 10 Na-HEPES, pH 7,8 |
| Soluzione bagno con Tricaine | Bagno Soluzione contenente 0,02% tricaine |
| Soluzione bagno con Formammide | Bagno Soluzione contenente 2M formammide |
| Neuron interno Solution (in mm) | 115 K-gluconato, 15 KCl, 2 MgCl 2, 10 K-HEPES, 5 K-EGTA, 4 Mg-ATP, pH 7,2 |
| Soluzione interna del muscolo (in mm) | 120 KCl, 10 K-HEPES, 5 Bapta, pH 7,4 |
Tabella 1. Solutions.
Discussione
Abbiamo utilizzato le registrazioni zebrafish accoppiati (Wen e Brehm, 2005) principalmente per studiare i processi di rilascio e riciclo delle vescicole durante la stimolazione ad alta frequenza. Questo processo viene interrotto in mutanti in cui la motilità normale trasmissione sinaptica è compromessa a causa di mutazioni puntiformi nelle principali componenti sinaptica. Per esempio, le mutazioni che interrompono aggregati recettore postsinaptico (Ono et al., 2001, 2002, 2004) e la sintesi del trasmettitore presinaptica (Wang et al., 2008) in conseguenza non coordinate nuoto. Registrazioni accoppiato fornire le informazioni che possono identificare l'origine del difetto funzionale, collegando così il comportamento, la genetica e la fisiologia. Ora dovrebbe essere possibile sezionare ulteriormente i processi sottostanti la trasmissione sinaptica per mezzo di espressione transitoria della PAC motore-neuroni utilizzando promotori giudizioso. In questo modo i geni dominanti negativi o mutati possono essere specificamente indicato nella questi neuroni e sia le conseguenze comportamentali ed elettrofisiologiche determinato. L'ulteriore vantaggio offerto dalla configurazione di cellula intera permette di dialisi del soma CaP con farmaci che possono potenzialmente alterare il riciclo delle vescicole, come le tossine clostridiali e buffer di calcio. A causa della breve distanza tra il soma e muscolare, la diffusione dovrebbe avvenire anche entro i tempi delle registrazioni. Il potenziale di questo preparato ha solo cominciato a essere sfruttato. La trasparenza dei pesci in questa posizione età e superficiale delle sinapsi facilita anche l'uso di strumenti ottici (Fetcho e O'Malley, 1997; Fetcho e Higashijima, 2004). Abbiamo avuto molto successo nella misurazione di endo ed esocitosi nei pesci che vivono con coloranti FM e gli indicatori genetici come Synaptophluorin (Li et al., 2003). Inoltre, fluorescente tossine coniugati possono essere usati per etichettare le proteine sinaptiche per l'imaging di pesci vivi (Ibanez-Tallon et al., 2004). Data la semplicità di questa preparazione è molto promettente per gli studi successivi.
Divulgazioni
Riconoscimenti
Finanziato dal NIH (NS-18.205).
Materiali
| Name | Company | Catalog Number | Comments |
| Pneumatic transducer tester | Fluke Biomedical | DPM1B | |
| 0.002 x 3 inch tungsten rod | A-M Systems | 715000 | |
| Sylgard 184 Elastomer | Dow Corning | The thickness of application will affect the DIC optics |
Riferimenti
- Fetcho, J. R., O'Malley, D. Imaging neuronal networks in behaving animals. Current Opinion in Neurobiology. 7, 832-838 (1997).
- Fetcho, J. R., S, H. i. g. a. s. h. i. j. i. m. a. Optical and genetic approaches toward understanding neuronal circuits in zebrafish. Integr Comp Biol. 44, 57-70 (2004).
- Ibañez-Tallon, I., Wen, H., Miwa, J., Xing, J., Aslantas-Tekinay, A., Ono, F., Brehm, P., Heintz, N. Tethering naturally occurring peptide toxins for cell autonomous modulation of ion channels and receptors in vivo. Neuron. 43, 305-311 (2004).
- Li, W., Ono, F., Brehm, P. Optical measurements of presynaptic release in mutant zebrafish lacking postsynaptic receptors. J. Neuroscience. , 23-10467 (2003).
- Ono, F., Mandel, G., Brehm, P. Acetylcholine receptors direct rapsyn clusters to the neuromuscular synapse in zebrafish. J. Neuroscience. 24, 475-5481 (2004).
- Ono, F., Shcherbatko, A., Higashijima, S., Fetcho, J., Mandel, G., Brehm, P. Paralytic zebrafish lacking ACh receptors fail to localize rapsyn clusters to the synapse. J. Neuroscience. 21, 5439-5448 (2001).
- Ono, F., Shcherbatko, A., Higashijima, S., Mandel, G., Brehm, P. The zebrafish motility mutant twitch once reveals new roles for rapsyn in synaptic function. J. Neuroscience. 22, 6491-6498 (2002).
- Wang, M., Wen, H., Brehm, P. Function of neuromuscular synapses in the zebrafish choline-acetyltransferase mutant bajan. J Neurophysiol. , 100-104 (2008).
- Wen, H., Brehm, P. Paired motor-neuron muscle recordings in zebrafish test the receptor blockade model for shaping synaptic current. J. Neuroscience. 25, 8104-8111 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon