Method Article
Nucleofection e cultura primaria di neuroni embrionali di topo ippocampale e corticale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo delinea i passaggi necessari per analizzare, attraverso trasfezione elettroporazione e neuroni dell'ippocampo e del mouse cultura corticale. Colture a breve termine possono essere utilizzati per gli studi della crescita degli assoni e la guida, mentre a lungo termine le culture possono essere utilizzati per studi di sinaptogenesi e analisi spine dendritiche.
Abstract
Neuroni dell'ippocampo e della corteccia sono stati ampiamente utilizzati per studiare il sistema nervoso centrale (SNC) polarizzazione neuronale, assone / dendrite escrescenza, e formazione di sinapsi e la funzione. Un vantaggio di coltura di questi neuroni è che essi prontamente polarizzano, formando assoni e dendriti distintivo, su un substrato a due dimensioni a densità molto bassa. Questa proprietà li ha resi estremamente utile per determinare molti aspetti dello sviluppo neuronale. Inoltre, fornendo condizionata gliali di questi neuroni che continuerà a svilupparsi, formando funzionali connessioni sinaptiche e sopravvivere per diversi mesi nella cultura. In questo protocollo abbiamo delineare una tecnica per analizzare, alla cultura e trasfezione embrionali di topo neuroni dell'ippocampo e della corteccia. Transfezione è compiuta electroporating DNA nei neuroni prima della placcatura via nucleofection. Questo protocollo ha il vantaggio di esprimere proteine di fusione fluorescenti-tagged presto nello sviluppo (~ 4-8 ore dopo la placcatura) per studiare la dinamica e la funzione delle proteine durante la polarizzazione, escrescenza assone e la ramificazione. Abbiamo anche scoperto che questo trasfezione singolo prima della placcatura mantiene fluorescenza-tagged espressione della proteina di fusione a livelli adeguati per l'imaging per tutta la durata del neurone (> 2 mesi in cultura). Così, questa metodologia è utile per studiare la localizzazione e funzione delle proteine durante lo sviluppo del sistema nervoso centrale con interruzioni poca o nessuna funzione neuronale.
Protocollo
1. Preparazione di Coprivetrini e delle Camere
- Preparazione del coprioggetto pulito e camere è essenziale per le culture sane. Scorciatoie non dovrebbe essere presa in qualsiasi di questi passaggi.
- Lavare i coprioggetti (rotondo 12 mm o 22 mm, vetro tedesco - Carolina Marca Assistant) pernottamento in acido nitrico concentrato (HNO3) in un vaso di vetro dedicato o bicchiere.
- Togliere i coprioggetti dai acido nitrico e lavare ampiamente (5-7x) in acqua deionizzata.
- Separare il coprioggetto ed asciugare in una cappa a flusso laminare o un armadietto biosicurezza. Una volta asciutta, li sterilizzare con raggi UV per 30 minuti. Luogo sterilizzato coprioggetto in una sterile piatti di Petri per la conservazione. Se i neuroni placcatura su vetrini coprioggetto 12 millimetri direttamente posto in un piatto sterile da 35 mm e passare alla Sezione 2.
- Camere di imaging sono costruite da 15 millimetri perforazione di un foro nella parte inferiore di 35mm piastre Petri (rimuovere tutte le sbavature) e allegando il coprioggetto pulito con una miscela 03:01 di paraffina e di vaselina.
- Fate sciogliere la paraffina / petrolio miscela gelatina in un tubo conico all'interno di un bagno di acqua bollente. Utilizzare un pennello piccolo strato di vernice e la parte inferiore del piatto attorno al foro 15mm. Assicurarsi di mantenere mescolare la paraffina / petrolio miscela gelatinosa come si separeranno. Questo di solito si traduce in camere incollati insieme con una maggiore concentrazione di vaselina, che diventerà viscoso quando i piatti sono posti in incubatrice, con conseguente distacco coprioggetto. La paraffina rimanenti / vaselina può essere conservato a temperatura ambiente.
- Collocare il piatto capovolto su un vassoio piatto e posizionare il vetrino sul foro. Calore nel forno a 80 ° C fino miscela paraffina è sciolto (~ 10 minuti). Rimuovere i piatti su una superficie piana e lasciare che la miscela di paraffina.
- Girare i piatti più e sterilizzare sia l'interno delle copertine e il fondo delle camere con raggi UV.
- Coprioggetto cappotto o regioni bicchiere di camere con 1.0mg/mL Poly-d-lisina (30kDa) in tampone borato (borato di sodio 0,1 M, pH 8,5) per un'ora. Lavare 3-5 volte con abbondante acqua deionizzata di grado coltura dei tessuti. Assicurarsi di rimuovere tutte le tracce di tampone borato. Asciutto e utilizzare immediatamente o conservare camere / lamelle per un uso successivo. Noi di solito utilizzare coprioggetto pulito entro un mese dalla preparazione.
2. Preparazione dei Dissection neuronale e medie Cultura
- Preparare il supporto dissezione (DM) con l'aggiunta di quantità appropriata di HBSS 10x e HEPES 100X all'acqua grado coltura dei tessuti. Conservare a 4 ° C. Tenere sul ghiaccio durante la dissezione.
- Il giorno prima della dissezione preparare la placcatura medio (PM) e mezzo privo di siero (SFM). PM è costituito da medie Neurobasal, B27 supplemento, 2 mM glutammina, 0,3% di glucosio, 37.5 mM NaCl e il 5% di siero fetale bovino (FBS). SFM consiste in Medio Neurobasal, B27 supplemento, 2 mM glutammina, 0,3% di glucosio e del 37,5 mM NaCl.
- Fare solo sufficiente per la dissezione e conservare in una cultura dei tessuti durante la notte con il tappo incubatore leggermente socchiusa in modo che i 2 contenuti temperatura e CO della equilibra mezzo. Aggiungiamo glucosio in più e aumentare la osmolalità a circa 310mOsm con NaCl. Troviamo le culture fare meglio in una osmolalità più fisiologico (osmolalità Neurobasal è tipicamente 205-245mOsm).
3. Gliali strato corticale Preparazione Alimentatore per lungo termine Culture
- Se a lungo termine le culture devono essere preparati, di eseguire questa parte di due o tre settimane il protocollo prima di continuare con la dissezione corticale o dell'ippocampo.
- Preparare medio gliali (GM) con MEM, 0,3% di glucosio, penicillina / streptomicina e siero di cavallo 10%.
- Euthanize P1-P3 cuccioli di topo da un raffreddamento in ghiaccio per 5 minuti. Rimuovere ogni cucciolo dal ghiaccio e spruzzare con il 70% di etanolo. Velocemente decapitare con le forbici. Rimuovere l'intero cervello di un piatto contenente freddo DM (punto 2.1).
- Rimuovere i due emisferi cerebrali e meningi. Accise la neocorteccia e trasportarlo in un nuovo piatto che contiene alcun supporto. Preparare cortecce da 4 cervelli totale.
- Tritare le cortecce con un panno pulito, lama di rasoio sterile più finemente possibile e rimuovere il tessuto tagliato con una pipetta di plastica per un tubo da 50 ml conica contenente 12 ml di freddo DM. Aggiungere tripsina e DNasi a concentrazioni finali dello 0,25% (1,5 ml) e lo 0,1% (1,5 ml), rispettivamente. Incubare in un bagno d'acqua a 37 ° C per 10 minuti, rimestando intermittente.
- Rimuovere la provetta contenente il tessuto corticale e pulire accuratamente con etanolo al 70% prima di portare all'interno della cappa coltura di tessuti. Pipettare tessuto corticale su e giù con una pipetta 10 ml circa 10-15 volte, o fino a quando la maggior parte pezzi di scomparire.
- Ritorna il tubo a 37 ° C a bagnomaria per altri 10 minuti con intermittente vorticoso.
- Pulire accuratamente il tubo con il 70% di etanolo e riportarlo alla cappa coltura dei tessuti. Pipettare il tessuto corticale su e giù con un 5 mL pipetta di circa 10-15 volte, o fino a quando i pezzi di scomparire.
- Aggiungere 15 mL di caldo GM e centrifugare a 200xg (1000rpm) per 10 minuti.
- Gettare il surnatante, risospendere le cellule pellet in 20 ml di fresca GM e contare con un emocitometro. Tavola 5-7.5x10 6 celle in 15 ml di GM per 75 centimetri 2 pallone.
- Dopo un giorno e ogni 2-3 giorni successivi in coltura, staccare le cellule allentato battendo il pallone contro la mano. Rimuovere il supporto insieme a tutte le cellule sloggiato e sostituire con 15 ml di fresca GM.
- Glia può essere raccolto dopo 1-2 settimane di crescita in fiaschi, quando sono circa 70-100% confluenti. Per preparare coprioggetto singoli rivestiti con glia, posto 6 acido nitrico puliti e sterilizzati coprioggetto 25 millimetri rotonda in un piatto da 10 cm, e posto 3 punti della miscela 03:01 di paraffina / vaselina su ogni vetrino in uno schema triangolare con un pennello piccolo . Trattare piatti aperti con luce UV per 30 minuti. Rivestire il coprioggetto con 0,1 mg / mL Poly-d-lisina (30kDa) in tampone borato per un'ora, poi lavare ampiamente (3-5x) con acqua sterile grado coltura tissutale deionizzata e lasciare asciugare.
- Rimuovere il gliali contenenti pallone di incubatore, eliminare il medio e sciacquare con 5 ml di pre-riscaldato tripsina / EDTA soluzione. Rimuovere la tripsina / EDTA soluzione dal pallone e Pipettare 3 ml di fresca pre-riscaldato tripsina / EDTA nel pallone. Incubare il pallone per 1 minuto a 37 ° C prima di aggiungere 5 ml di GM per fermare il tripsinizzazione.
- Rimuovere la glia da pallone ripetuto pipettaggio 10-15 volte, e poi trasferire i media ad un tubo da 15 ml. Centrifugare a 200xg (1000rpm) per 8 minuti. Rimuovere il supernatante e aggiungere 10 ml di GM, le cellule conta, e la piastra di 5x10 5 cellule in 12,5 ml di GM per piatto 10 centimetri contenente i coprioggetti.
- Scambiare il mezzo con fresca preriscaldata GM ogni 2-3 giorni. Il giorno prima della dissezione neurone, rimuovere il GM e sostituirlo con SFM (sezione 2.2). Utilizzare questa gliali condizionata SFM al passo 4,12, quando le inondazioni culture corticale o ippocampale.
4. Dissezione corticale e / o ippocampale ed elettroporazione
- Rimuovere quantità appropriata di soluzioni nucleofection (Lonza), unire e riscaldare a temperatura ambiente prima di iniziare la dissezione. Dal momento che la soluzione Nucleofection ha una durata limitata se combinati, si limita a combinare l'importo necessario per ogni preparazione (100 microlitri per trasfezione).
- Eutanasia di un mouse incinta E15.5 con CO 2 (giorno della spina è E0.5) e togliere l'utero per una piastra di Petri di 10 cm. Rimuovere i feti e decapitare in freddo DM (paragrafo 2.1).
- Rimuovere l'intero cervello in un piatto separato di freddo DM e con un ago di tungsteno piegato, rimuovere entrambi neocortices. Rimuovere le meningi con microforceps e corteccia posto in nuovo piatto di freddo DM. Con una forbice piccola iris o Wecker, togliere la corteccia e ippocampo e posto in una provetta Eppendorf 1,5 ml riempito con 1,0 mL di freddo DM. Tenere questo provetta in ghiaccio.
- Dopo dissezione tutti cortecce o dell'ippocampo, aggiungere 110 ml di tripsina 2,5% per il tubo Eppendorf contenente il tubo del tessuto e porlo in un incubatore a 37 ° C per 20 minuti.
- Rimuovere il surnatante e lavare cortecce o dell'ippocampo con 1,0 mL PM (sezione 2.2) delicatamente invertendo il tubo Eppendorf. Ripetere il lavaggio due volte, lasciando 1 mL di PM nel tubo.
- Triturare i pezzi 15 volte con una pipetta P1000, e rimuovere le cellule surnatante / a un nuovo tubo 15 ml contenente 4 ml di PM, lasciando tutti pezzi che rimangono in provetta Eppendorf.
- Spin i 15 ml al tubo 20xg (350rpm) per 7 minuti con il freno. Scartare il surnatante e aggiungere 100 ml di premiscelati, soluzione nucleofection temperatura ambiente (Lonza) per ogni trasfezione. Triturare 5 volte con un delicato movimento su e giù della pipetta P1000.
- Rimuovere 100 l di miscela nucleofection soluzione / cella ad ogni provetta Eppendorf nuovi e aggiungere la giusta quantità di DNA. A lungo termine culture generalmente usiamo 1-2μg di DNA per trasfezione. Tuttavia, questa etichetta solo una piccola percentuale <10% dei neuroni nella cultura. Generalmente usiamo 5-10μg di DNA per trasfezione se vogliamo efficienza di trasfezione superiore per breve termine cultura. Abbiamo usato fino ad un totale di 40μg di DNA quando trasfezione con due plasmidi diversi. I plasmidi sono memorizzati in TE buffer 1μg / mL.
- Aggiungi sospensione cellulare / DNA alla cuvetta (Lonza) e electroporate le cellule del Nucleofector (Lonza), utilizzando il programma di O-005 (SNC topo neuroni).
- Lavorare velocemente, aggiungere 500 microlitri di PM pre-riscaldato ed equilibrato alla cuvetta e rimuovere soluzione / cellule ad un nuovo tubo di 1,5 ml Eppendorf. Aggiungi PM abbastanza per portare il volume di ogni trasfezione a 1,0 ml. Contare le cellule con un emocitometro e piastra a 3-5x10 3 celle / cm 2 per le culture giovani, o 5-10x10 3 celle / cm 2 di lunga durata culture.
- Per le colture a breve termine, inondare la cultura piatti da 35 mm con 2,0 ml di riscaldato, CO 2-SFM equilibrato dopo un'ora di placcatura. Se si utilizza coprioggetto, togliamo la metà del PM e sostituirlo con SFM, quindi ripetere due volte. O le inondazioni delle camere di imaging o lavare i risultati coprioggetto in un bassissimo contenuto di siero (<0,5%). Colture a breve termine non hanno bisogno di essere coltivato con uno strato alimentatore gliale e non hanno bisogno di essere ri-alimentata.
- A lungo termine le culture, togliamo un coprioggetto glia coperto contenente tre puntini di paraffina / vaselina e capovolgere sopra il foro 15 mm di piatto da 35 mm, un'ora dopo placcatura iniziale. Due millilitri del SFM condizionato dal piatto gliali viene quindi aggiunto alla camera di imaging. Per alimentare a lungo termine le culture, togliamo un terzo del SFM ogni 2-3 giorni e sostituirlo con fresco, pre-riscaldata e CO 2-SFM equilibrato.
5. Rappresentante dei risultati:
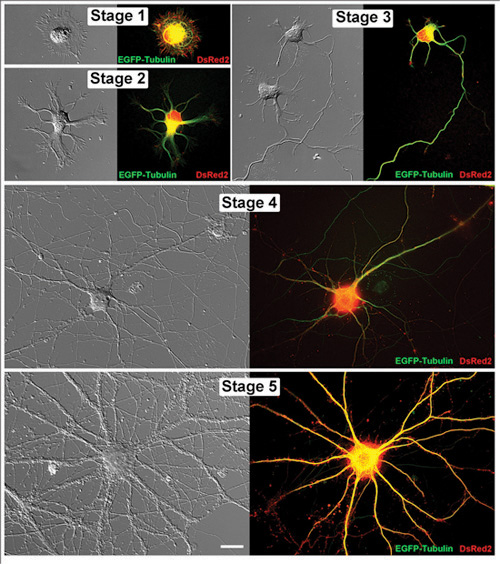
Figura 1. Vivere i neuroni dell'ippocampo in fasi successive di sviluppo. Immagini associati di rappresentante vivente neuroni dell'ippocampo sono mostrati sia come immagine contrasto differenziale di interferenza e di un microscopio a fluorescenza corrispondente. Ognuna di queste cellule è stata transfettate con EGFP-tubulina e DsRed2 in vettori pCAX. I neuroni sono stati fotografato nei giorni seguenti in vitro (DIV): Fase 1 (1DIV), Fase 2 (1DIV), Stage 3 (2DIV), Stage 4 (11DIV) e Stage 5 (32DIV). Barra di scala è 20μm.
Discussione
Questo protocollo per la coltura embrionali di topo neuroni dell'ippocampo e della corteccia è stato sviluppato come una modifica del protocollo Banker, che utilizza ratto 1,2 neuroni. Abbiamo usato questo protocollo per il mouse coltura e neuroni criceto anche 3,4,5,6,7. Questo protocollo funziona altrettanto bene per entrambi i neuroni dell'ippocampo e neocorticale, è simile ad un protocollo pubblicato da Meberg e Miller 8. In generale, usiamo i neuroni dell'ippocampo a lungo termine cultura, perché sono ben caratterizzati e un sistema modello più affermati. Inoltre, essi possono contenere una popolazione più omogenea di neuroni che neocorteccia. Tuttavia, i neuroni neocorticali colto utilizzando questo protocollo anche sopravvivere e differenziarsi in modo simile (dati non pubblicati). Noi abitualmente uso neuroni dell'ippocampo e neocorticale per breve termine cultura. Dissezione di neocorteccia risultati anche nei neuroni sostanzialmente più (1.5x10 6 neuroni per coppia di cortecce) rispetto alla dissezione dell'ippocampo (2.5x10 5 neuroni per ogni coppia di ippocampo), che lo rende una scelta migliore dei materiali per il Western blotting, per esempio.
Come per ogni coltura primaria, è essenziale ridurre al minimo il tempo impiegato dalla morte dell'animale per la placcatura delle cellule. Si assumerà generalmente 10-20 dissezioni per diventare sempre veloce a dissezione e placcatura. Inoltre, quando si lavora con la Nucleofector Lonza, è fondamentale per lavorare velocemente durante la procedura di elettroporazione, in quanto la vitalità dei neuroni decresce rapidamente se sono rimasti nel buffer nucleofection.
Gran parte della nostra immagine è condotta con un totale di microscopia a fluorescenza di riflessione interna (TIRFM). Questo tipo di microscopia è solo in grado di imaging diverse centinaia di nanometri al di là del coprioggetto. Pertanto, le aree dei neuroni che spesso l'immagine, il cono di crescita assonale e spine dendritiche, devono essere rispettate direttamente al coprioggetto. Quindi, usiamo le culture a bassa densità che richiedono alimentazione gliali a lungo termine cultura. Abbiamo usato le culture più alta densità (> 2x10 4 cellule / cm 2), senza strati alimentatore gliali, a lungo termine le culture e hanno scoperto che sopravvivono molto bene con l'alimentazione poco. Tuttavia, le spine dendritiche di questi neuroni sono spesso troppo lontano dal substrato di immagine in TIRFM, anche se possono essere facilmente rilevato con grande campo microscopia o microscopia confocale.
Nella maggior parte dei nostri studi abbiamo trasfezione neuroni prima della placcatura, e hanno ripreso le proteine fluorescenti marcate per un massimo di tre mesi in cultura. Questo a lungo termine espressione di proteine fluorescenti con etichetta ci dà fiducia che utilizzando basse concentrazioni di DNA (1-2μg) non producono artefatti sovraespressione nei neuroni. Tuttavia, questa procedura può essere utilizzata anche per studiare l'iperespressione delle proteine se elevate quantità di DNA siano usati (10-20μg). I plasmidi che usiamo per trasfettare neuroni di solito contengono proteine di fusione EGFP o mCherry, anche se abbiamo anche l'etichetta del citoplasma neuronale con DsRed2 EGFP o da soli. Questa tecnica di elettroporazione funziona bene con un certo numero di vettori. Noi preferiamo plasmidi che contengono un β-actina promotore con un potenziatore CMV e β-globina poli-Una coda (pCAGGs o pCAX plasmidi) 9, a causa dei livelli relativamente alti di espressione, e il fatto che non siano ben tollerate dai neuroni in entrambe le culture a breve e lungo termine. In generale, le proteine cominciano a esprimere entro circa 4 ore di placcatura e raggiungere livelli sufficienti per l'imaging in 10-24 ore 10. Abbiamo utilizzato con successo CMV-promotore-driven plasmidi culture in breve termine, ma hanno scoperto che possono causare alti livelli di iperespressione che uccidono i neuroni a lungo termine cultura. Tuttavia, abbiamo trovato che il condizionamento gliali di culture a bassa densità aiuta con la sopravvivenza dei neuroni transfettate con plasmidi CMV-promotore guidato, rispetto a maggiore densità (non alimentato gliali) culture.
Divulgazioni
Riconoscimenti
Tutte le procedure sono state approvate dalla University of Wisconsin commissione per cura degli animali ed erano in conformità alle direttive NIH. Ringraziamo il Dott. Katherine Kalil per l'uso generoso del suo dispositivo Nucleofector. Ringraziamo anche i membri del laboratorio Dent per commenti sul protocollo. Questo lavoro è stato sostenuto da NIH R01-NS064014, Dana Foundation e Whitehall Fondazione EWD
Christopher Viesselmann, Jason Ballweg e Derek lombardo contribuito in maniera uguale a questo articolo.
Materiali
* La maggior parte dei reagenti che conservare a -80 ° C possono essere conservati a -20 ° C pure. La conservazione a -80 ° C allunga la loro durata e dei risultati in culture un po 'più consistente.
Riferimenti
- Goslin, K., Asmussen, H., Banker, G., Goslin, K., Banker, G. Chapter 13. Culturing Nerve Cells. , 339-370 (1998).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Dent, E. W., Callaway, J. L., Szebenyi, G., Baas, P. W., Kalil, K. Reorganization and movement of microtubules in axonal growth cones and developing interstitial branches. J Neurosci. 19, 8894-8908 (1999).
- Dent, E. W., Kalil, K. Dynamic imaging of neuronal cytoskeleton. Methods Enzymol. 361, 390-407 (2003).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nat Cell Biol. 9, 1347-1359 (2007).
- Hu, X., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-dependent dynamic microtubule invasion of dendritic spines. J Neurosci. 28, 13094-13105 (2008).
- Lebrand, C. Critical role of Ena/VASP proteins for filopodia formation in neurons and in function downstream of netrin-1. Neuron. 42, 37-49 (2004).
- Meberg, P. J., Miller, M. W., Hollenbeck, P. J., Bamburg, J. R. Chapter 7. Neurons: Methods and Applications for the Cell Biologist. , 112-129 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Zeitelhofer, M. High-efficiency transfection of mammalian neurons via nucleofection. Nat Protoc. 2, 1692-1704 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon