È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento dei mitocondri dal muscolo scheletrico
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive una procedura per studiare la respirazione dei mitocondri isolati da muscolo scheletrico. Questo metodo è stato adattato da Scorrano Et al. (2007). La procedura di isolamento dei mitocondri richiede circa 2 ore. La respirazione mitocondriale può essere completata in circa 1 ora.
Abstract
I mitocondri sono organelli controllare la vita e la morte della cellula. Partecipano in chiave reazioni metaboliche, sintetizzare la maggior parte di ATP, e regolano una serie di cascate di segnalazione 2,3. Ricercatori passati e presenti hanno mitocondri isolati da tessuti ratti e topi, come fegato, cervello e cuore 4,5. Negli ultimi anni, molti ricercatori si sono concentrati sullo studio di funzione mitocondriale dei muscoli scheletrici.
Qui, descriviamo un metodo che abbiamo usato con successo per l'isolamento dei mitocondri da muscoli scheletrici 6. La nostra procedura richiede che tutti i buffer e reagenti sono freschi e hanno bisogno di circa 250-500 mg di muscolo scheletrico. Sono stati studiati i mitocondri isolati da gastrocnemio ratto e nel topo e il diaframma e muscoli extraoculari ratto. Concentrazione di proteina mitocondriale viene misurata con il saggio Bradford. E 'importante che i campioni mitocondriale essere tenuti ghiacciata durante la preparazione e che gli studi funzionali da eseguire in un tempo relativamente breve (~ 1 ora). Respirazione mitocondriale è misurata con polarografia con un elettrodo di Clark-tipo (sistema Oxygraph) a 37 ° C 7. Taratura degli elettrodi ossigeno è un passo fondamentale di questo protocollo e deve essere effettuata ogni giorno. Mitocondri isolati (150 mcg) vengono aggiunti 0,5 ml di tampone sperimentale (EB). Stato 2 respirazione inizia con aggiunta di glutammato (5mm) e malato (2,5 mm). Poi, adenosina difosfato (ADP) (150 mM) è stato aggiunto a iniziare 3. Oligomicina (1 micron), un bloccante sintasi ATPasi, viene utilizzato per stimare lo stato 4. Infine, carbonile cianuro p-[trifluoromethoxy]-fenil-idrazone (FCCP, 0,2 mM) si aggiunge a measurestate 5, o sganciati respirazione 6. Il rapporto di controllo respiratorio (RCR), il rapporto tra stato 3 allo stato 4, viene calcolato dopo ogni esperimento. Un RCR ≥ 4 è considerata come prova di una preparazione valida mitocondri.
In sintesi, vi presentiamo un metodo per l'isolamento dei mitocondri vitali da muscoli scheletrici che può essere utilizzato in biochimica (ad esempio, l'attività enzimatica, immunolocalizzazione, proteomica) e studi funzionali (respirazione mitocondriale).
Protocollo
1. Preparazione del buffer
- Accendere 5804R centrifuga e impostare a 4 ° C. Accendere bagnomaria Isotemp 3006D e impostare a 37 ° C.
- Preparare le seguenti soluzioni prima di isolamento del muscolo:
- PBS: sciogliere tampone fosfato (PBS) compresse in acqua distillata (5 compresse / litro). Mescolare bene.
- PBS + 10 mM EDTA: Per preparare un 100 ml di soluzione, aggiungere 2 ml di 500 mM EDTA a 98 ml di PBS.
- 8X Mitocondri buffer: 10,28 g di saccarosio per una concentrazione finale di 0,6 M, 400 mg di acidi grassi liberi albumina di siero bovino (BSA) per una concentrazione finale del 0,8%, 2,08 g di HEPES per una concentrazione finale di 160 mM, pH a 7,4 e QS a 50 ml con acqua distillata.
- Buffer isolamento 1 (IB1): Aggiungere 200 ml di 500 mM EDTA per una concentrazione finale di 10 mm, 0,392 g di D-mannitolo per una concentrazione finale di 215 mm, 1,25 ml di 8X mitocondri, pH a 7,4 e QS a 10 ml con acqua distillata.
- Buffer isolamento 2 (IB2): Aggiungere 60 ml di 500 mM EGTA per una concentrazione finale di 3 mm, 0,392 g di D-mannitolo per una concentrazione finale di 215 mm, 1,25 ml di 8X mitocondri, pH a 7,4 e QS a 10 ml con acqua distillata.
- Buffer sperimentale (EB): Aggiungere 100 ml di 500 mM MgCl 2 per una concentrazione finale di 5 mm, 0,392 g di D-mannitolo per una concentrazione finale di 215 mm, 25 ml di 2,5 mM KH 2 PO 4 per una concentrazione finale di 6,25 mM, 2 l di mM EGTA 100 per una concentrazione finale di 20 micron, 1,25 ml di tampone mitocondriale, pH a 7,4 e QS a 10 ml con acqua distillata.
2. Isolamento muscolare
- In un secchio di ghiaccio, mettere tre bicchieri 10 ml, Potter-Elvehjem macinatori tessuto e tutti i necessari altri strumenti / supplies sul ghiaccio. Tutto deve rimanere ghiacciato per tutto l'esperimento.
- Luogo IB1 e IB2 nel secchiello del ghiaccio e EB in bagno d'acqua calda quando hai finito.
- Nei tre bicchieri 10 ml, le seguenti soluzioni si aggiungono:
- Bicchiere 1: 10 ml di PBS
- Beaker 2: 10 ml di PBS / EDTA
- Becher da 3: 3 ml di IB1
- Uccidere un topo umanamente come approvato dal locale Cura degli animali e del Comitato Istituzionale Usa.
- Isolare rapidamente 250-500 mg di muscolo scheletrico, sciacquare in Beaker 1, poi il trasferimento a Beaker 2.
3. Omogeneizzazione / isolamento mitocondriale
- Trasferimento muscolo Beaker 3 e tritare finemente il muscolo con le forbici.
- Trasferire la soluzione del Potter-Elvehjem omogeneizzatore. Omogeneizzare il muscolo con un pestello motorizzata (un trapano a colonna farà il lavoro) 10 volte mantenendo il tubo in ghiaccio in ogni momento.
- Trasferimento omogenato di provette precedentemente congelate microcentrifuga da 2 ml e centrifugare a 700 g per 10 minuti a 4 ° C.
- Trasferire il supernatante in un nuovo pre-raffreddata provetta. Scartare pellet.
- Centrifugare surnatante a 10.500 g per 10 minuti a 4 ° C.
- Trasferire il supernatante in un nuovo pre-raffreddata provetta e SN1 etichetta (surnatante numero 1) e tipo muscolare.
- Risospendere pellet in 500 ml di IB2.
- Centrifugare a 10.500 g per 10 minuti a 4 ° C.
- Trasferire il supernatante in un nuovo pre-raffreddata provetta e SN2 etichetta (surnatante numero 2) e di tipo muscolare.
- Sospendere finale mitocondriale pellet in 100 ml di IB2.
- Re-spin sospensione finale mitocondriale in minifuge per alcuni secondi. Se c'è una pallina, trasferire il supernatante in un nuovo pre-raffreddata provetta e gettare il pellet.
- Determinare la concentrazione di proteine con il saggio Bradford 8.
4. Elettrodo di calibrazione
NOTA: calibrazione dell'elettrodo Completa durante l'isolamento mitocondriale.
- Aggiungere 100 ml di acqua distillata matraccio da 250 ml. Agitare vigorosamente per 20 minuti per equilibrare l'acqua con gas atmosferici.
- Aggiungere qualche goccia di 50% KCl all'elettrodo Oxygraph.
- Posizionare un piccolo pezzo di carta blu Rizla rotolamento sopra di elettrodo.
- Posizionare un pezzo di membrana in PTFE sulla parte superiore del foglio di rotolamento.
- Applicare l'anello interno con l'applicatore anello e poi posto l'anello esterno nella scanalatura elettrodo.
- Collegare gli elettrodi e assemblare il resto delle attrezzature: grande base del cilindro di plastica, camera mitocondriale, e tubi dell'acqua.
- Accendere scatole Oxygraph e avviare il software Oxygraph.
- Aggiungere l'acqua equilibrati a camera mitocondriale.
- Aggiungi mescolare bar e girare a una velocità di 60.
- Iniziare un nuovo esperimento.
- Clicca su calibrare e poi calibrazione fase liquida per Box 1. Variazione di temperatura a 37 ° C e fare clic su "OK" due volte.
- Quando "override" diventa "OK" clic su di esso e aprire il serbatoio di azoto.
- Luogo punta collegatoal serbatoio di azoto in camera e stabilire ossigeno pari a zero. Fare clic su "OK" quando si passa da "Sostituisci".
- Aspirare l'acqua e aggiungere 500 microlitri di tampone EB alle camere mitocondriale.
- Camera di tenuta con stantuffo.
- Se si utilizzano più caselle, ripetere i passaggi 11-15 per la calibrazione del riquadro 2.
5. Respirazione mitocondriale
- Inizia un nuovo esperimento, farlo funzionare per circa 1 minuto per stabilizzare il segnale.
- Aggiungere il volume necessario di sospensione mitocondriale (passo 3.11) per 150 mg in ogni camera, evento marchio, e farlo funzionare per 1 minuto.
- Aggiungere 10 ml di caldo 250 mM/125 mM glutammato / malato per una concentrazione finale di 5 mM mM/2.5. Mark e lasciare correre per 1 minuto. Questo è definito come Stato 2.
- Aggiungere 7,5 ml di ADP 10 mm per una concentrazione finale di 150 micron, segno, e lasciare per 30 secondi. Questo è definito come Stato 3.
- Aggiungere altri 7,5 ml di 10 mM ADP, marchio, e lasciare correre per 1,5 minuti.
- Aggiungere 0,5 l di freddo oligomicina 10 mm per una concentrazione finale di 1 micron, segno, e lasciare correre per 3 minuti. Questo è definito come Stato 4.
- Aggiungere 1 ml di mM FCCP freddo 0.1 per una concentrazione finale di 0,2 micron, segno, e lasciare correre per 3 minuti. Questo è definito come Stato 5.
- Al termine, fine sperimentare e salvare.
- Acquisire i tassi di respirazione utilizzando il software Oxygraph.
- Inserisci il fattore di normalizzazione: se l'aggiunta di 150 mcg di proteine mitocondriali, il fattore di normalizzazione sarà 0,15.
- Calcolare i tassi di respirazione normalizzata per la respirazione stati diversi.
- Calcolare il rapporto di controllo respiratorio (RCR) dividendo Stato 3 per Stato 4.
6. Rappresentante dei risultati:
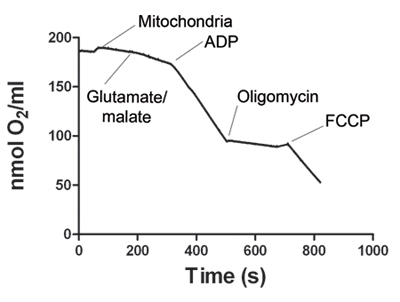
Figura 1. Mostra un rappresentante tracciamento del consumo di ossigeno da parte dei muscoli scheletrici mitocondri. Dopo il segnale dell'elettrodo è stabilizzato, il campione mitocondri viene aggiunta alla camera Oxygraph. Stato 2 respirazione inizia con aggiunta di glutammato e malato. L'aggiunta di ADP aumenta il consumo di ossigeno, la definizione di stato 3 respirazione. ATP sintasi è bloccato con l'aggiunta di oligomicina ottenere Stato 4 della respirazione. Infine, FCCP viene aggiunto sganciare la respirazione mitocondriale (stato 5). Tabella 1 mostra i tassi di consumo di ossigeno di rappresentanza per gli stati 2, 3, 4 e 5. Il rapporto di controllo respiratorio (RCR) è calcolato per ogni esperimento. RCR ≥ 4 è considerata come prova di una preparazione valida mitocondri.
Stati | Tariffe normalizzato |
Stato 2 | 34,74 |
Stato 3 | 153,40 |
Stato 4 | 16,49 |
Stato 5 | 143,70 |
RCR | 9,30 |
Tabella 1. Tassi di respirazione mitocondriale. Tassi di consumo Representativeoxygen dal muscolo scheletrico mitocondri. I valori sono normalizzati alla quantità di mitocondri aggiunta alla camera. Il rapporto di controllo respiratorio (RCR) è determinato dividendo stato 3 per stato 4. Un RCR ≥ 4 rappresenta una valida preparazione mitocondri.
Access restricted. Please log in or start a trial to view this content.
Discussione
Vi presentiamo un protocollo per isolare i mitocondri praticabile da muscoli scheletrici. Se il rendimento è un problema, il protocollo può essere modificato tramite l'incubazione del muscolo isolato in 5 ml di tripsina PBS/10mM EDTA/0.01% per 30 minuti in ghiaccio. Per assicurare la completa digestione con tripsina muscolare, il muscolo ha bisogno di essere completamente tritato. Dopo i 30 minuti di incubazione, la soluzione PBS/10mM tripsina EDTA/0.01% deve essere completamente sostituita con 3 ml di buffer di i...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Riconoscimenti
Questo lavoro è stato sostenuto da un finanziamento della National Eye Institute (R01 EY12998) per FH Andrade.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 95% CO2 / 5% O2 mix | Local Gas Supplier | ||
| Adenosine 5′-diphosphate sodium salt | Sigma-Aldrich | A2754 | |
| Blue Rizla Paper | Hansatech | 890101 | |
| Bradford protein assay | Bio-Rad | 500-0006 | |
| Carbonylcyanide p-trifluoromethoxyphenylhydrazone (FCCP) | Sigma-Aldrich | C2920 | |
| Centrifuge 5804R | Eppendorf | ||
| Compressed nitrogen | Local Gas Supplier | ||
| D-mannitol | Sigma-Aldrich | M9647 | |
| Ethlyene-glycol-bis-tetraacetic acid (EGTA) | Sigma-Aldrich | E3889 | |
| Ethylenediaminetetraacetic acid (EDTA) | Bio-Rad | 161-0728 | |
| Free fatty acid bovine serum albumin | Sigma-Aldrich | A8806 | |
| Glutamic acid | Sigma-Aldrich | G5889 | |
| HEPES sodium salt | Sigma-Aldrich | H7006 | |
| Isotemp 3006D | Fisher Scientific | ||
| Magnesium chloride | Sigma-Aldrich | M8266 | |
| Male Sprague Dawley Rats | Harlan Laboratories | 300-500g | |
| Malic acid | Sigma-Aldrich | M9138 | |
| Minifuge | ISC Bioexpress | C1301P | |
| Oligomycin | Sigma-Aldrich | O4876 | |
| Oxygen electrode disc | Hansatech | S1 | |
| Oxygraph | Hansatech | ||
| Oxygraph Plus V1.01 Software | Hansatech | ||
| pH-meter | Mettler Toledo | 1225506149 | |
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | P4417 | |
| Potassium chloride | Sigma-Aldrich | P3911 | |
| Potassium phosphate | Sigma-Aldrich | P8416 | |
| Potter-Elvehjem homogenizers | Fisher Scientific | 08-414-14A | |
| PTFE (0.0125mm × 25mm) membrane | Hansatech | S4 | |
| SKIL 3320 drill press | Hardware store | ||
| Sucrose | Sigma-Aldrich | S5016 |
Riferimenti
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle and cultured fibroblasts. Nat Protoc. 2, 287-295 (2007).
- Duchen, M. R. Roles of mitochondria in health and disease. Diabetes. 53, Suppl 1. S96-S102 (2004).
- Johannsen, D. L., Ravussin, E. The role of mitochondria in health and disease. Curr Opin Pharmacol. , (2009).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 80, 3-44 (2007).
- Pallotti, F., Lenaz, G. Isolation and subfractionation of mitochondria from animal cells and tissue culture lines. Methods Cell Biol. 65, 1-35 (2001).
- Gamboa, J. L., Andrade, F. H. Mitochondrial content and distribution changes specific to mouse diaphragm after chronic normobaric hypoxia. Am J Physiol Regul Integr Comp Physiol. , (2009).
- Patel, S. P., Gamboa, J. L., McMullen, C. A., Rabchevsky, A., Andrade, F. H. Lower respiratory capacity in extraocular muscle mitochondria: evidence for intrinsic differences in mitochondrial composition and function. Invest Ophthalmol Vis Sci. 50, 180-186 (2009).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon