È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un saggio Slice organotipica per High-Resolution Time-Lapse Imaging della migrazione neuronale nel cervello postnatale
In questo articolo
Riepilogo
Questo protocollo descrive un saggio organotipica fetta ottimizzato per il cervello postnatale e ad alta risoluzione time-lapse imaging di migrazione neuroblasti nel flusso migratorio rostrale.
Abstract
Neurogenesi nel cervello postnatale dipende dal mantenimento di tre eventi biologici: la proliferazione delle cellule progenitrici, la migrazione dei neuroblasti, nonché la differenziazione e l'integrazione di nuovi neuroni in circuiti neurali già esistenti. Per neurogenesi postnatale nei bulbi olfattivi, questi eventi sono segregati all'interno di tre ambiti anatomicamente distinte: la proliferazione avviene in larga misura nella zona subependimali (SEZ) dei ventricoli laterali, migrando neuroblasti attraversare attraverso il flusso migratorio rostrale (RMS), e nuovi neuroni differenziare e integrare all'interno del bulbo olfattivo (OB). I tre domini fungono da piattaforme ideali per studiare i meccanismi cellulari, molecolari e fisiologici che regolano ciascuno degli eventi biologici distintamente. Questo articolo descrive un saggio organotipica fetta ottimizzato per tessuto cerebrale post-natale, in cui le condizioni extracellulare strettamente imitare l'ambiente in vivo per la migrazione dei neuroblasti. Abbiamo dimostrato che la nostra analisi fornisce per il movimento uniforme, orientato, e veloce dei neuroblasti all'interno del RMS. Questa analisi sarà particolarmente adatto per lo studio della regolazione delle cellule autonome e non autonomi della migrazione neuronale utilizzando cross-trapianto si avvicina da topi diversi background genetico.
Protocollo
I. Procedure
Le seguenti tecniche devono essere eseguite in condizioni sterili, in una cappa a flusso laminare, utilizzando strumenti sterilizzati.
Preparazione di piatti con fondo di vetro per le fette organotipica
- I piatti devono essere preparati in ambiente sterile e l'utilizzo di strumenti sterilizzati.
- Una goccia 150μL di medio fetta (vedi ricette) si trova nel centro del fondo di vetro parte del piatto con cura per evitare bolle d'aria nel mezzo.
- Con una siringa monouso dotata di un ago di 23 Gauge, macchie più di colla (Gomma Cemento - Elmer, cat # E904) sono posti ai margini piazza adiacente alla coprioggetto circolare che occupa il centro del piatto cultura, lasciando una parte scollata per lo scambio di liquidi (Figura 1). Il tipo di colla elencati non è tossico per le fette o le cellule applicato in questo protocollo. Attenzione deve essere data di evitare di mettere la colla sulla bolla di copertura in vetro in quanto ciò plasmano ed ostruire l'imaging delle fette più tardi. Una membrana nucleopore (diametro 25 mm, dimensione dei pori 8.0μm - Whatman, cat # 110614) si trova sulla parte superiore del vetro coprioggetto, utilizzando i punti di colla per fissarlo in posizione. Questo dovrebbe essere fatto utilizzando una pinza micro, garantendo nel contempo che le bolle d'aria non sono intrappolati tra il coprioggetto di vetro e la membrana.
- Aggiungere 1 ml di media fetta in cima membrana. I piatti sono poste in un incubatore per 30 minuti e poi su ghiaccio, fino al momento dell'uso.
Estrazione dei primi cervello postnatale
I migliori risultati si ottengono quando le fette sono preparati da giovani topi postnatale (P1-P10).
- Cuccioli sono terminali anestetizzati (overdose), con metodi approvati isofluorane o altro. La testa può essere spruzzato con il 70% di etanolo per aumentare la sterilità, seguito da una rapida decapitazione usando forbici affilate.
- La testa è stabili mediante fissazione della mandibola con una pinza micro. La pelle viene asportata longitudinalmente dal collo al muso. Il cranio è tagliato longitudinalmente e anteriormente a partire dalla cisterna magna, facendo uno mediale e 2 tagli laterali (uno per ogni lato - Figura 2A). Si deve prestare attenzione a ridurre al minimo il contatto con sottostante tessuto corticale come i lembi cranici vengono rimossi dal cervello.
- Per migliorare la stabilità del tessuto durante il sezionamento vibratome, il laterale maggior parte degli aspetti del cervello vengono rimossi facendo due tagli sagittali. L'aspetto caudale del cervello è rimosso anche effettuando un taglio alla base rostrale del cervelletto (Figura 2B).
- I due emisferi sono separati, effettuando un taglio liscio lungo la fessura linea mediana, ed i due emisferi sono accuratamente scavato del cranio e posto, superficie mediale verso il basso, in uno stampo embedding (Fig. 2C-D).
Sezione del cervello ospite
- I due emisferi nello stampo embedding vengono immediatamente coperte con fuso 3% a basso punto di fusione del DNA di grado gel (Fisher, cat # BP1360-100) sciolta in tampone tessuto preparazione che viene mantenuta a 37 ° C (vedi ricette). Dopo 2 minuti di stabilizzazione su una superficie piana orizzontale per garantire anche l'indurimento delle agarosio, gli stampi sono posizionati sul ghiaccio per completare l'impostazione.
- Una volta che il gel che contiene i due emisferi è impostato, viene rimosso dallo stampo e tagliato, lasciando 2-3mm di gel intorno al tessuto cerebrale.
- Il gel-embedded tessuto viene montato sul disco campione del vibratome, con la superficie mediale, e fissato con cianoacrilato (colla Krazy o equivalente). Si deve prestare attenzione ad applicarsi solo quantità minime di colla, come troppo avrà effetti tossici sulle fette e migrazione delle cellule. Colla troppo sui lati del blocco anche impedire il taglio, causando danni potenziali nel tessuto.
- Il disco è installato nel cassetto campione vibratome pieno di ghiaccio, freddo medio di preparazione dei tessuti.
- Il tessuto è sezionato a spessore 150μm, con la velocità vibratome impostata su un lento-medio raggio (dipende dal vibratome utilizzati e, quindi, deve essere determinata in modo indipendente per ottenere risultati ottimali). Nelle nostre mani, la frequenza di vibrazione è ottimale quando è impostata al massimo. Le fette primi può essere scartata.
- Non appena il RMS contenenti fette vengono rilasciati dalla lama (RMS è visibile ad occhio nudo come una struttura a forma di U grigia che si estende dal SEZ al OB), sono attentamente presi in giro dallo stampo gel, e raccolse utilizzando una piccola spatola piatta. Le fette sono poste sulla membrana nucleopore del fondo di vetro piatti contenenti fette medio (Figura 3A-B). Un tipico cervello postnatale precoce del mouse produrrà circa 2-3 sezioni RMS per emisfero al taglio a 150 micron. E 'fondamentale che la gestione delle fette è ridotto al minimo in quanto sono molto fragili. I piatti con le fette vengono poi trasferiti in un incubatore.
Donatore cervellosezionamento e RMS trapianto
- Cervelli donatore (cervello che esprime i reporter fluorescente nella migrazione neuroblasti) vengono sezionati a fette dello spessore 250μm e sono raccolti in ghiacciato tampone tessuto preparazione.
- Fette sono immediatamente posto sotto un microscopio da dissezione con capacità epifluorescenza, e il RMS è microdissezionate delicatamente, usando pinze micro. Un forcipe viene usato per stabilizzare la fetta mentre l'altro è usato per fare piccoli tagli in tutto il RMS fino a quando non viene rilasciato dalla fetta. Il escisse RMS è poi tagliata in espianti di piccole dimensioni (circa 200-500 micron di diametro) prima del trapianto.
- Fondo di vetro piatti contenenti fette ospitare posizionato sul nucleopore filtri vengono rimossi dal termostato e posto sotto il microscopio da dissezione. Utilizzando la luce visibile, la RMS è chiaramente identificato e una piccola incisione è fatta nel segmento iniziale del RMS.
- Utilizzando una pipetta dotato di una punta di 20 l, un singolo donatore RMS espianto è trasferito al sito incisi RMS ospitante. L'espianto è leggermente spinto l'incisione di stabilire un contatto tra i 2 tessuti. Per garantire questo contatto è stabile, il espianti sono spinti un po 'fra la fetta e la membrana nucleopore.
- Una volta che tutte le sezioni host con il RMS vengono trapiantate, i piatti vengono restituiti al incubatore per almeno 1 ora per consentire le sezioni di stabilirsi sulla membrana. Neuroblasti dovrebbe iniziare a migrare dal espianto nell'ospite RMS dopo circa 1-2 ore.
Time-lapse imaging di migrazione neuronale
- Il fondo di vetro piatti sono trasferiti dal termostato alla camera di incubazione del microscopio (Figura 3C). Neuroblasti fluorescenti possono essere esposte ad intervalli che vanno da 0 a 10 minuti a seconda del tipo di analisi desiderata. Per esempio abbiamo un'immagine dinamica del citoscheletro durante il ciclo migratorio dei neuroblasti singoli impostando la nostra periodicità inferiore o uguale a 2,5 minuti. Tuttavia, dinamica di popolazione come l'orientamento e la velocità di migrazione sono meglio catturati ad intervalli da 5 a 10 minuti. La scelta degli obiettivi è molto variabile a seconda della marca del microscopio. Per un microscopio confocale Nikon C1, troviamo che il 20x secco (Nikon Pan Fluor, NA 0.75, WD 0,35 millimetri) è più adatto per le nostre analisi. Per ottenere i migliori risultati su questo sistema confocale, il foro stenopeico si apre a una dimensione media (diametro 60μm). Per più appropriato comportamento migratorio, di imaging si limita alle cellule in profondità nello spessore del RMS, di almeno 20 micron di distanza da una delle superfici di taglio della fetta. Potenza del laser deve essere ottimizzata in modo che sia al minimo, ma che i dettagli dei neuroblasti individuali rimangono visibili.
- Una volta che l'immagine è completata fette può essere fissato con il freddo ghiaccio, e preparati al momento 4% paraformaldeide, immunoistochimica, e montati su vetrini per l'imaging ulteriormente. Dal momento che non cappotto nostre membrane con qualsiasi substrati aderente come laminina, le fette di solito volare via dalla membrana una volta che sono immersi nel buffer di colorazione. Le sezioni sono ripreso, pur mantenendo il loro spessore di 150 micron. E 'anche possibile crioconservare e congelare le fette e utilizzare un criostato di ottenere sezioni più sottili delle fette originale. Tuttavia, questo si tradurrà in un aumento dell'incidenza di manufatti in colorazione così come alterare l'integrità del tessuto.
II. Materiali / attrezzature
Preparazione di piatti con fondo di vetro per le fette organotipica
- Siringhe piccole (1 ml)
- 23-gauge aghi
- Nucleopore Track-Etch a membrana - 25mm di diametro, dimensione dei pori 8.0μm - Whatman, cat # 110614
- Fondo di Vetro Piatti Cultura - 35mm scatola di Petri, 14mm strip, n ° 1,5 coprioggetti - MATTECH, cat # P35G-1.5-14-C
- Gomma Cemento - Elmer, cat # E904
- Basale medio Eagle - Gibco, cat # 21010
- Hepes 1M (pH7.4)
- 1M D-glucosio
- 100mM CaCl 2
- 100mM MgSO 4
- 1M NaHCO 3
- dH 2 O
- 200mm L-glutammina
- Penicillina-streptomicina
Cervello di estrazione e l'inclusione
- Anestetico (isofluorane, ecc)
- Forno a microonde
- Bassa fusione agarosio - Fisher, cat # BP1360-100
- Krazy colla - cat # KG585
- Peel-A-Way formelle monouso (R-40) - 22mmx40mm rettangolare, 20mm in profondità - Polysciences, cat # 18646C
Cervello sezionamento e RMS trapianto
- Vibratome - Leica VT1000S e tutti i componenti accessori per la preparazione fetta
- Sale Balanced 10X Hank Soluzione - Gibco, cat # 14185
- Forcipe Microdissecting # 5 - Roboz, cat # RS-4976
- Microspatula - Fisher, cat # 21-401-15
- Stereomicroscopio
Time-lapse imaging difette organotipica
- Umidificata Incubatore, 5% CO 2
- Microscopio invertito dotato di incubatore da camera e lunga distanza degli obiettivi di lavoro (NA di 0,6 o superiore)
III. Ricette
Soluzione tampone per la dissezione dei tessuti e la preparazione fetta (preparazione del buffer dei tessuti)
| Soluzione madre | Volume | Concetration finale |
| HBSS 10X | 50 mL | 1X |
| Hepes 1M (pH 7,4) | 1,25 ml | 2,5 mm |
| 1M D-glucosio | 15 ml | 30MM |
| 1M CaCl 2 | 0,5 ml | 1 mM |
| 1M MgSO 4 | 0,5 ml | 1 mM |
| 1M NaHCO 3 | 2 ml | 4mm |
| dH 2 O | 430,75 mL |
Filtro sterilizzare con filtro 0,2 micron e conservare a 4 ° C.
Terreno di coltura per le fette organotipica, trapianto di tessuti e di imaging (medio fetta)
| Soluzione madre | Volume | Concentrazione finale |
| Basale medio Aquila | 35 ml | |
| Tessuto preparazione del buffer | 12,9 mL | |
| 1M D-glucosio | 1,35 ml | 20 mM |
| 200mm L-glutammina | 0,25 ml | 1 mM |
| Penicillina-streptomicina | 0,5 ml | 100units / ml penicillina e 0,1 mg / ml di streptomicina |
Filtro sterilizzare con filtro 0,2 micron e conservare a 4 ° C.
Preparazione del basso punto di fusione su gel di agarosio
Basso punto di fusione agarosio viene diluito in tampone di tessuto preparazione a 0,3 g / ml in una provetta da 50 ml conici (vedi ricette). Il tubo è microonde con incrementi di 5-10 secondi ad alta potenza. Numero di incrementi dipende dal volume totale, per 10 ml, tre incrementi (10-8-5 secondi ciascuno) dovrebbe essere sufficiente. Il tappo della provetta viene accuratamente svitato tra incrementi di riscaldamento per scaricare la pressione dell'aria ed evitare esplosione del tubo. Attenzione deve essere preso come il contenuto del tubo sarà molto calda. Una volta che l'agarosio è completamente sciolto, il tubo viene mantenuto in un bagno d'acqua a 37 ° C per almeno 5 minuti per consentire la temperatura si stabilizzi prima dell'uso. L'esposizione prolungata a temperatura ambiente il gel si solidifica. Anche se questo deve essere evitato il più possibile, gel indurito possono essere riscaldati e ri-fuso per un utilizzo immediato entro 24 ore dalla preparazione iniziale.
Immunoistochimica su fette organotipica
A seguito di immagini al microscopio confocale, fette può essere fissata una notte a 4 ° C con il 4% di formaldeide in PBS. Le sezioni sono poi bloccati tutta la notte a 4 ° C, nel siero di capra 10% con 1% Triton X (Sigma, cat. # S26-36-23) in PBS seguita dalla notte di incubazione con anticorpi primari a 4 ° C. Anticorpi di capra fluorescenza-tagged secondari sono utilizzati per la visualizzazione (tutti diluito 1:1000, 1 ore di incubazione a temperatura ambiente). Fette etichettati vengono accuratamente lavate 5-6 volte con PBS freddo ghiaccio prima del montaggio su vetrini e coprire i vetrini.
IV. Rappresentante Risultati
La nostra cultura fetta organotipica protocollo è stato accuratamente testato e ottimizzato su quella degli ultimi anni per la coerenza nel modello migratorio e di orientamento. Analisi di cellule emigrano da espianti ottenuti da topi in cui è indotta l'espressione della proteina fluorescente rossa, Td-pomodoro, sotto il promotore Nestin (Nestin-Td pomodoro), rivela la migrazione altamente orientate e rapida tdTomato + neuroblasti nell'ospite RMS ( Figura 4A). Ad alto ingrandimento time-lapse analisi illustra risoluzione eccellente di tutta la lunghezza di una migrazione di neuroblasti durante 20 minuti di sessione di imaging (Figura 4B).
Fette con donatore Td-pomodoro + cellule sono state fissate e immunoistochimica per i diversi componenti cellulari all'interno del RMS. Astrociti GFAP + e CD31 + vasi sanguigni sono stati rivelati mediante immunoistochimica fluorescente (Figura 5A). Analisi ad alto ingrandimento di sezioni colorate per le proteine del citoscheletro di actina e tubulina rivelano non uniforme espressione di questi componenti di una cellula nel mezzo della migrazione (Figura 5B).
Anticorpi utilizzati nelquesti esempi: coniglio anti-RFP (Abcam, 1:250), di coniglio anti-GFAP (Dako, 1:1000), ratto anti-CD31 (BD Pharmigen, 1:100), mouse anti-actina (Santa Cruz, 1: 500), di coniglio anti-tubulina (Sigma, 1:1000), capra anti-topo Cy3 (Chemicon, 1:1000), capra anti-coniglio AlexaFluor 647 (Invitrogen, 1:1000), di capra anti-topo AlexaFluor 488 (Invitrogen , 1:1000), capra anti-coniglio AlexaFluor 488 (Invitrogen, 1:1000).
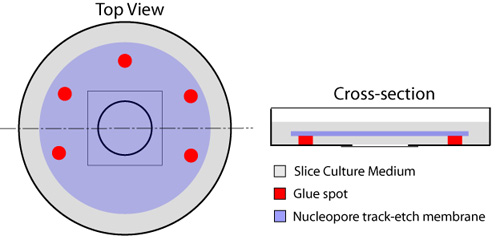
Figura 1. Preparazione di piatti con fondo di vetro per le fette organotipica. Punti multipli di colla sono disposte intorno circolare con fondo di vetro componente del piatto (rosso), lasciando un lato aperto per lo scambio di media da sotto il filtro. Una goccia 150μL di medio fetta si trova nel centro del coprioggetto di vetro. Una membrana nucleopore (blu) viene poi applicato, lato lucido verso il basso, garantendo nel contempo che bolle d'aria intrappolate tra i coprioggetto di vetro e la membrana. Un millilitro di media fetta (grigio) si sviluppa sulla parte superiore della membrana, e piatti vengono incubate a 37 ° C prima dell'uso.
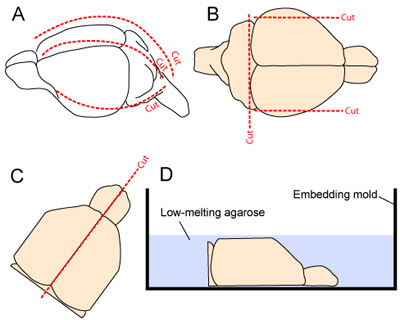
Figura 2. Cervello di estrazione e preparazione per il sezionamento. (A) Il cranio è esposto da incidere il cuoio capelluto dal collo al muso (linea tratteggiata lungo la linea mediana). Il cranio è poi tagliato longitudinalmente e anteriormente a partire dalla cisterna magna, facendo uno mediale e 2 tagli laterali (uno su ogni lato; 2A). (B) Il laterale maggior parte degli aspetti della corteccia e l'aspetto caudale del sistema nervoso centrale sono asportato per migliorare la stabilità del tessuto durante il sezionamento vibratome. (CD) I due emisferi sono poi separati e posizionate a faccia mediale verso il basso in uno stampo embedding prima dell'applicazione del 3% gel di agarosio sciolta in tampone di tessuto di preparazione.
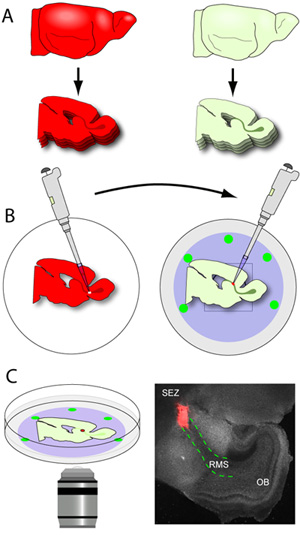
Figura 3. Cervello sezionamento e cross-trapianto. (A) Il tessuto ospite è sezionato a spessore 150μm, e il RMS contenenti sezioni sono accuratamente posizionati piatto sulla membrana nucleopore di freddo con fondo di vetro piatti. (B) il cervello del donatore (cervello che esprime i reporter fluorescente in RMS) sono sezionati a spessore 250μm, e le fette sono raccolti in ghiacciato tampone tessuto preparazione. Il donatore è RMS microdissezionate e tagliata in piccoli espianti. Utilizzando una pipetta dotato di una punta di 20 l, singoli espianti RMS vengono trasferiti a un sito incisa nell'ospite RMS. (C) Dopo 1-2 ore di incubazione, i piatti sono trasferiti a una fase incubate in un microscopio confocale e migrazione viene catturato utilizzando time-lapse imaging. La microfotografia è un rappresentante a basso ingrandimento immagine di una fetta tipica (grigio) istituito 1 ora dopo il trapianto (espianto rosso tdTomato + RMS di un topo donatore; rosso contorno tratteggiato le linee di RMS nella fetta host).
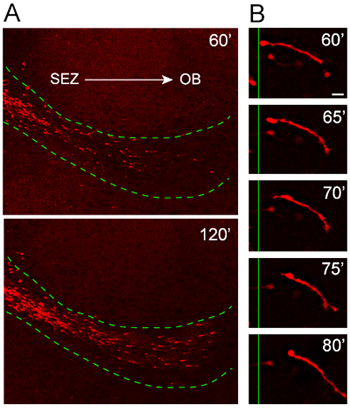
Figura 4. La migrazione dei neuroblasti da espianti in RMS ospitante. (A) Nestin-tdTomato + neuroblasti (rosso) migrare dal espianti nell'ospite RMS (linea tratteggiata verde) 1 ora dopo il trapianto. tdTomato + cellule di invadere il RMS dell'ospite fette organotipica muoversi in un modo altamente orientate e rapido dalla SEZ e verso l'OB. (B) Il ciclo migratorio si può osservare in alta potenza time-lapse immagini di un neuroblasti in circa un periodo di 20 minuti. Barra di scala = 10 micron.
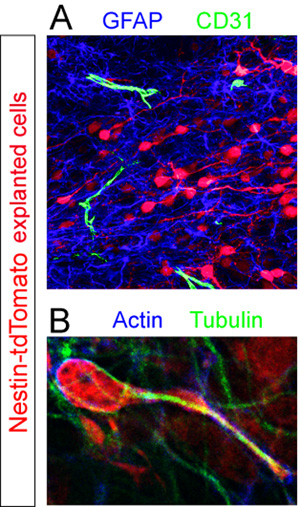
Figura 5. Valutazione immunoistochimica di fette organotipica. Neuroblasti espiantati (rosso) sono stati fissati nel bel mezzo della migrazione 12 ore dopo il trapianto. (A) fluorescente colorazione immunoistochimica della fetta rivela una piscina denso di GFAP + astrociti (blu) e dispersi CD31 + vasi sanguigni (verde) all'interno del RMS della fetta di accoglienza. (B) Il citoscheletro di una cellula isolata tdTomato + migrazione (rosso) in una serie RMS è rivelato da co-immunocolorazione utilizzando anticorpi diretti contro l'actina (blu) e tubulina (verde).
Discussione
Migrazione neuronale in RMS è una componente essenziale della neurogenesi postnatale nei bulbi olfattivi 1. Migrazione attraverso il RMS si presenta in un piano tangente alla superficie del cervello. Neuroblasti tangenzialmente migrazione sono distinti da radialmente migrazione delle cellule in base alla posizione della loro fonte progenitore, così come il destino divergenti dei loro prodotti finiti neuronale 1, 2, 3. La popolazione relativamente puro tangenzialmente di cellule migrano nel RMS po...
Divulgazioni
Riconoscimenti
Ringraziamo Dan McWhorter per raccontare il protocollo nel video. Questo lavoro è supportato dal NIH di Grant 5R01NS062182, una borsa da American Federation for Aging Research, e fondi istituzionali assegnati a HTG.
Riferimenti
- Ghashghaei, H. T., Lai, C., Anton, E. S. Neuronal migration in the adult brain: are we there yet. Nat. Rev. Neurosci. 8, 141-151 (2007).
- Valiente, M., Marin, O. Neuronal migration mechanisms in development and disease. Curr. Opin. Neurobiol. 20, 68-78 (2010).
- Rakic, P. Evolution of the neocortex: a perspective from developmental biology. Nat. Rev. Neurosci. 10, 724-735 (2009).
- Jaglin, X. H., Chelly, J. Tubulin-related cortical dysgeneses: microtubule dysfunction underlying neuronal migration defects. Trends Genet. 25, 555-566 (2009).
- Carro, M. S. The transcriptional network for mesenchymal transformation of brain tumours. Nature. 463, 318-325 (2010).
- Wu, W. Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature. 400, 331-336 (1999).
- Hu, H., Tomasiewicz, H., Magnuson, T., Rutishauser, U., U, . The role of polysialic acid in migration of olfactory bulb interneuron precursors in the subventricular zone. Neuron. 16, 735-743 (1996).
- Shapiro, E. M., Gonzalez-Perez, O., Garcia-Verdugo, M. a. n. u. e. l., Alvarez-Buylla, J., &, A., Koretsky, A. P. Magnetic resonance imaging of the migration of neuronal precursors generated in the adult rodent brain. Neuroimage. , (2006).
- Vreys, R. MRI visualization of endogenous neural progenitor cell migration along the RMS in the adult mouse brain: validation of various MPIO labeling strategies. Neuroimage. 49, 2094-2103 (2010).
- Davenne, M., Custody, C., Charneau, P., Lledo, P. M. In vivo imaging of migrating neurons in the mammalian forebrain. Chem. Senses. 30, 115-116 (2005).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal. J. Vis. Exp. , (2010).
- Shen, Q. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3, 289-300 (2008).
- Tavazoie, M. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3, 279-288 (2008).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural Stem Cells Confer Unique Pinwheel Architecture to the Ventricular Surface in Neurogenic Regions of the Adult Brain. Cell Stem Cell. 3, 265-278 (2008).
- Polleux, F. &. a. m. p. ;. a. m. p., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. , L9-L9 (2002).
- Murase, S. &. a. m. p. ;. a. m. p., Horwitz, A. F. Deleted in colorectal carcinoma and differentially expressed integrins mediate the directional migration of neural precursors in the rostral migratory stream. J. Neurosci. 22, 3568-3579 (2002).
- Suzuki, S. O. &. a. m. p. ;. a. m. p., Goldman, J. E. Multiple cell populations in the early postnatal subventricular zone take distinct migratory pathways: a dynamic study of glial and neuronal progenitor migration. J. Neurosci. 23, 4240-4250 (2003).
- Ghashghaei, H. T. The role of neuregulin-ErbB4 interactions on the proliferation and organization of cells in the subventricular zone. Proc. Natl. Acad. Sci. U. S. A. 103, 1930-1935 (2006).
- Khodosevich, K., Seeburg, P. H., Monyer, H. Major signaling pathways in migrating neuroblasts. Front Mol. Neurosci. 2, 7-7 (2009).
- Jacquet, B. V. Analysis of neuronal proliferation, migration and differentiation in the postnatal brain using equine infectious anemia virus-based lentiviral vectors. Gene Ther. 16, 1021-1033 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon