Method Article
Imaging ottico di neuroni nel ganglio Granchio Stomatogastric con tensione sensibili Coloranti
In questo articolo
Riepilogo
Qui vi presentiamo la metodologia per una rapida e ad alta risoluzione fluorescenti tensione-sensibili di imaging tintura di attività dettagliata dei neuroni del ganglio stomatogastric granchio.
Abstract
Voltaggio-sensibile di imaging tinta di neuroni è una metodologia chiave per la comprensione del funzionamento delle reti neuronali sono organizzate e come l'attività simultanea di neuroni che partecipano porta alla nascita della funzionalità integrante della rete. Qui vi presentiamo la metodologia di applicazione di questa tecnica per generare neuroni modello individuato nel ganglio granchio stomatogastric. Dimostriamo il caricamento di questi neuroni con la tensione fluorescente sensibile colorante Di-8-ANEPPQ e mostriamo come immagine l'attività dei neuroni colorante caricato utilizzando il MiCAM02 ad alta velocità e ad alta risoluzione CCD sistema di imaging. Dimostriamo l'analisi dei dati di imaging registrati utilizzando il software di imaging BVAna associati al sistema MiCAM02 imaging. La simultanea di tensione-sensibili di imaging colorante dell'attività dettagliati dei neuroni nel ganglio più granchio stomatogastric applicata insieme con le tradizionali tecniche di elettrofisiologia (registrazioni intracellulari ed extracellulari) apre radicalmente nuove opportunità per la comprensione di come centrale generatore di reti neurali lavoro modello.
Protocollo
1. Preparazione del Sistema Nervoso Granchio Stomatogastric
Adulto Cancer pagurus L. sono stati ottenuti da fonti locali (Università di Newcastle, Colomba Marine Laboratories) e tenuti in filtrata, l'acqua di mare aerata (10 - 12 ° C). Gli animali sono stati anestetizzati da imballaggio in ghiaccio per 20 - 40 min prima della dissezione. Abbiamo utilizzato sistemi isolati stomatogastric nervoso (STNS) 1. Il STNS è stato immobilizzato in un silicone elastomero alberato (ELASTOSIL RT-601, Wacker, Monaco, Germania) piastra di Petri e continuamente superfused (7 - 12 ml / min) con soluzione fisiologica fredda (10-13 ° C). Soluzione fisiologica composta da (mmol * l-1): NaCl, 440; MgCl 2, 26; CaCl 2, 13; KCl, 11; trisma di base, 10; acido maleico, 5. Saline è stato mantenuto a una temperatura costante di 11 - 13 ° C ed a pH 7,4-7,6.
La procedura dettagliata della dissezione STNS e preparazione, tra cui il desheathing del ganglio stomatoastric (STG), sono presentati in questo articolo JOVE da Guttierez e Grashow 1. Tutti gli esperimenti sono stati effettuati in conformità con la Direttiva Europea Comunità del Consiglio ° 24 novembre 1986 (86/609/CEE). La figura 1A mostra un diagramma schematico del STNS e Figura 1B mostra un tipico STG desheathed abbia la neuroni disposti a semicerchio pianeggiante nella parte posteriore del ganglio.
La piastra di Petri con il STNS è fissato alla piattaforma operativa del microscopio imaging (BW51 WI, Olympus, Tokyo, Giappone) con il pongo. Sia la fase di microscopio e il microscopio sono montate su una tavola vibrante isolato (Scientifica, Uckfield, Regno Unito) per evitare artefatti da movimento durante la registrazione ottica. Gli schemi motori generato nel ganglio stomatogastric (STG) sono monitorati con registrazioni extracellulari 2-4. Questo viene fatto attraverso i seguenti passi:
- Un compartimento vaselina a base cilindrica è costruito attorno a una sezione del nervo motore principale (LVN) per isolare elettricamente il nervo dal bagno (questo viene fatto sul palco dissezione prima scatola di Petri è posta sulla piattaforma operativa del microscopio di imaging ).
- Uno dei due cavi in acciaio inossidabile elettrodo viene posto in questo comparto, l'altra nella vasca da bagno come un elettrodo di riferimento.
- Il segnale differenziale viene registrato, filtrato e amplificato con un amplificatore differenziale AC (Univ. Kaiserslautern, Germania).
- L'attività motoria del ganglio è controllata mediante un oscilloscopio (DL708E, Yokogawa, Tokyo, Giappone) ed è inoltre registrata usando una scheda di acquisizione dati (Power CED, 1401, Cambridge Electronic Design, Cambridge, UK) e il Spike 2 v6.10 software (Cambridge Electronic Design, Cambridge, UK). I file vengono analizzati utilizzando Spike 2 v6.10 (Electronic Design a Cambridge, Cambridge, UK).
2. Preparazione della soluzione colorante
Abbiamo usato la tensione fluorescente sensibile colorante Di-8-ANEPPQ (Bioscience Cambridge) 5, che ha una doppia carica positiva che facilita il caricamento del colorante attraverso microelettrodi utilizzando positivi impulsi di corrente. La soluzione colorante deve essere protetto dalla luce quanto più possibile. La soluzione colorante si prepara come segue:
- 5 mg di colorante è mescolato con 1 ml di F-127 acido Pluronic in DMSO (Invitrogen) soluzione.
- Il flacone di plastica contenente il colorante dissolto è centrifugato per 20 minuti a 12.000 rotazione / minuto in un Microcentrifuga Sigma 1-14 (Sigma, Osterode, Germania) al fine di separare le particelle del colorante più grande che può intasare il microelettrodo.
- Il supernatante (top 200 mL) della soluzione colorante è separato mediante una pipetta e memorizzati in un flaconcino di plastica separato. Entrambi i flaconi sono avvolti in carta stagnola per evitare l'esposizione alla luce.
- La soluzione colorante è congelato a -20 ° C.
- Prima di usare la soluzione colorante è fuso ponendo la provetta chiusa e avvolta nel caldo (25 ° C) per 10-15 minuti.
3. Colorante di caricamento mediante iniezione intracellulare mediante microelettrodi Sharp
Abbiamo usato microelettrodi forte per caricare i neuroni con il colorante. Per controllare il carico colorante usiamo il sistema di imaging MiCAM02 (SciMedia, Tokyo, Giappone) 6. Il sistema di imaging è dotato di due telecamere CCD: la fotocamera HR ha un chip sensore più grande (6,4 mm x 4,8 mm) che fornisce una migliore risoluzione spaziale con la migliore risoluzione temporale è 1,4 ms, la fotocamera HS è una più piccola (2,9 mm x 2,1 millimetri), ma più veloce chip del sensore consentendo una più rapida immagini aventi 0,7 ms come la sua migliore risoluzione temporale. Le fasi del carico colorante sono i seguenti:
- Microelettrodi sono tirati con un P-97 Flaming - Brown (Sutter Instruments, Novato, CA, USA) estrattore elettrodo con 10 cm di lunghezza, 1 mm di diametro esterno tubi di vetro con filamento (GB100TF 8P, Prodotti Scienza, Hofheim, Germania). Gli elettrodi sono tirati per avere una resistenza algamma di 25-40 MOhm in 3M KCl (appropriato per le impostazioni dei parametri tirando seguire il libro di cucina pipetta fornita dal creatore del estrattore elettrodo).
- La soluzione colorante congelato è fuso e una quantità molto piccola di essa viene aspirata in un ago Microfil (Microfil - 34G, strumenti di precisione mondiale, Sarasota, FL, USA) - il colorante aspirato riempie intorno ° 2 / 3 del l'ago Microfil .
- La soluzione colorante in Microfil l'ago viene iniettato nella punta di un microelettrodo. Il microelettrodo è posto in una scatola scura per 15 minuti.
- Il microelettrodo è riempito con una soluzione 3M KCl. L'elettrodo viene posto nuovamente dentro una scatola buia stoccaggio elettrodo per altri 10-20 minuti per consentire la soluzione di colorante per raggiungere la punta fine dell'elettrodo per l'aspirazione della forza capillare che agiscono in microelettrodo.
- Il microelettrodo pronto viene inserito in un portaelettrodo e fissato sul headstage dell'amplificatore intracellulare (IA-251A, Warner Instruments Corporation, Hamden, CT, USA).
- L'amplificatore intracellulare è collegato alla scheda di acquisizione dati che fornisce un impulso per guidare impulsi di corrente nel microelettrodo.
- Il microelettrodo è posta delicatamente nella membrana di un neurone STG utilizzando un manipolatore microelettrodo (PatchStar, Scientifica Ltd, Uckfield, UK). Dal momento che la distanza di lavoro dell'obiettivo 10x (UMPLFL10XW, NA 0,30, WD 3,3 millimetri; Olympus Corporation, Tokyo, Giappone) del microscopio di imaging è molto piccolo, il microelettrodo deve essere posizionato in posizione obliqua (circa 30 °) e il movimento del microelettrodo nella giusta posizione richiede diversi passaggi di riorientamento del microscopio e l'obiettivo di spostare il microelettrodo. Per avviare il microelettrodo viene spostato in una posizione tale che la sua punta è superiore alla STG. L'obiettivo microscopio si abbassa fino alla punta dell'elettrodo appare a fuoco. Poi si abbassa ulteriormente, ma non così tanto da toccare il microelettrodo. Il microelettrodo si abbassa fino a che non riappare nel fuoco dell'obiettivo. Questi passaggi si ripetono fino a quando i neuroni appaiono chiaramente nel piano di messa a fuoco dell'obiettivo. Poi il microelettrodo si abbassa fino a che tocca e penetra delicatamente la membrana del neurone STG selezionato. Questo è controllata mediante l'oscilloscopio.
- L'elettrodo intracellulare è usato per registrare l'attività del neurone STG selezionati al fine di individuare il neurone dato il suo profilo di attività e il rapporto tra la sua attività e l'attività STG registrato dall'elettrodo extracellulare 2,3,7.
- L'amplificatore intracellulare è impostato in modalità di iniezione di corrente e viene utilizzato per 30 minuti a iniettare 10 nA positivi passi corrente nel microelettrodo che durano per 1 secondo e sono separati da 1 secondo con lacune senza corrente iniettata al microelettrodo. Le unità corrente iniettata le molecole cariche positivamente colorante nel neurone registrato. Se l'equipaggiamento è disponibile neuroni multipli possono essere iniettati contemporaneamente.
- Dieci minuti dopo il periodo di iniezione e dopo la fine dell'iniezione la diffusione colorante all'interno del neurone sia selezionata. Per fare questo usiamo il MiCAM02 sistema di imaging (SciMedia Ltd, Tokyo, Giappone) con l'obiettivo 10x e illuminazione dal bassissimo sorgente luminosa alogena ondulazione (HL-151; MORITEX, Tokyo, Giappone) attraverso il filtro MSWG2 cubo (con 480-550 nm di eccitazione filtro; Olympus Corporation, Tokyo, Giappone). Il sistema di imaging è impostato per utilizzare la fotocamera HR con 192 x 128 pixel di risoluzione, 40 ms di tempo di imaging, la modalità 'hbin', e 10 fotogrammi al sessione di imaging. Se il ripieno colorante è successo l'imaging dovrebbe mostrare una patch tinto in neurone intorno alla posizione del microelettrodo, e questa patch tinto dovrebbe crescere tra le immagini scattate dopo 10 minuti e dopo 30 minuti. Se la diffusione del colorante è insufficiente dopo 30 min, tempo di iniezione più è concesso. In alternativa, un elettrodo nuovo colorante può essere utilizzato.
- L'elettrodo è tirato fuori del neurone e il neurone è lasciato a rilassarsi per almeno 20-30 minuti. All'interno di questo tempo, il neurone successivo può essere iniettato con colorante.
4. Imaging di neuroni Tinti
L'attività dei singoli neuroni possono essere ripreso dopo la procedura di tintura di riempimento. In alternativa due o più neuroni possono essere riempiti immagine l'attività simultanea di diversi neuroni STG. In linea di principio molti e forse tutti i neuroni STG può essere riempito con un colorante. Le immagini dei neuroni è fatto con il sistema 02 MICAM immagini utilizzando la fotocamera HR. La procedura di imaging è la seguente:
- L'obiettivo microscopio è cambiato e una elevata trasmissione luminosa efficienza obiettivo 20x (XLUMPLFL20XW/0.95, NA 0,95, WD 2,0 millimetri; Olympus Corporation, Tokyo, Giappone) è utilizzato per la raccolta dei dati di imaging. Questo obiettivo raccoglie molta più luce che l'obiettivo 10x e dà anche maggiore ingrandimento fornendo un'immagine più dettagliata dei neuroni. Bein g significa più efficiente luce di quel poco di colorante di caricamento è già visibile con questo obiettivo e anche che siamo in grado di utilizzare l'intensità della luce più bassa per l'imaging riducendo il danno potenziale foto che possono essere causati ai neuroni del colorante.
- Fase operativa del microscopio è posizionato in modo tale che i neuroni che sono destinati ad essere ripreso sono nel campo di vista l'obiettivo e l'obiettivo si concentra su di loro.
- I dati di registrazione extracellulare è immessa nel sistema di imaging 02 Micam attraverso il suo canale di ingresso analogico. Questo permette al relativamente facile relative dei segnali ottici e schemi motori corrispondenti o picchi extracellulare registrato nella fase di analisi.
- Il sistema di Micam 02 è impostato per utilizzare 96 x 64 pixel di risoluzione con 2,2 ms di tempo di imaging o 48 x 32 pixel di risoluzione con 1,5 ms di tempo di imaging. In entrambi i casi l'impostazione 'hbin' può essere utilizzata se la tintura dei neuroni non è molto forte.
- Il livello di luce è quanto più basso possibile (cioè il colorante nei neuroni dovrebbe generare ancora sufficiente a fluorescenza per l'imaging) per evitare foto modulazione e danni foto dei neuroni registrati.
- L'illuminazione della stanza e tutte le sorgenti luminose sono rimasti spenti. Inoltre, una tenda nera può essere chiusa attorno alla piattaforma di registrazione per evitare l'esposizione alla luce da fonti esterne.
- Le sessioni di imaging sono impostati per essere tra 4 - 16 secondi di lunghezza.
- L'attività spontanea dei neuroni tinto è registrato nel corso delle sessioni di imaging diverse.
5. Analisi dei Dati Optical Imaging
Per analizzare i dati di immagini abbiamo usato il software BVAna (versione 10,08; SciMedia Ltd., Tokyo, Giappone) associati al sistema 02 MICAM di imaging. Il software supporta la visualizzazione dei dati di imaging e offre una gamma di strumenti di analisi pure. Le fasi dell'analisi dei dati e l'interpretazione sono i seguenti:
- Una regione appropriata circolare di interesse selezionati in ogni neuroni registrati. Di solito usiamo 2-3 regioni pixel raggio di interesse per lo studio dei neuroni a x 48 32 pixel di risoluzione, e 6 - 8 regioni pixel raggio di interesse per lo studio dei neuroni a 96 x 64 risoluzione.
- Il livellamento temporale dei dati può essere necessario, specialmente se il colorante genera quantità relativamente bassa di fluorescenza (valore di fondo basso i dati indicano questo, che può essere dovuto al basso livello di luce che viene utilizzato o basso carico colorante livello, per esempio in una neurite del neurone registrato). Di solito in questi casi abbiamo usato smoothing temporale con 3 - 5 unità di tempo.
- Oltre alle registrazioni ottica abbiamo anche visualizzare la registrazione extracellulare selezionando per visualizzare l'ingresso analogico del sistema di imaging.
- I parametri per la visualizzazione dei dati ottici e l'ingresso analogico deve essere impostato in modo idoneo a vedere tutte le registrazioni sullo schermo del computer.
- Considerando le registrazioni ottiche dei neuroni, la registrazione extracellulare dal LVN, e la classificazione del neurone basato sulla registrazione intracellulare in precedenza, è possibile determinare l'identità del neurone e mettere in relazione la sua attività alle attività neurale registrato dal nervose.
- Si prevede che le registrazioni ottiche mostrano chiaramente, e senza la necessità di una media su più eventi simili, le attività neurale corrispondente ai picchi registrati extracellulare e anche eventi sottosoglia come inibitori post-sinaptico potenziali causati dall'attività di altri neuroni.
- L'esportazione dei dati caratteristiche del software BVAna può essere utilizzato per esportare le registrazioni ottico calcolato per le regioni di interesse selezionati e anche l'ingresso analogico che contiene la registrazione dal LVN. I dati esportati possono essere elaborati e analizzati ulteriormente utilizzando altri software di analisi dei dati, nonché (per esempio, nel caso più semplice di Microsoft Excel (Microsoft, Redmond, WA, USA) possono essere utilizzati per la visualizzazione e l'elaborazione dei dati aggiuntivi).
6. Rappresentante Risultati
La figura 2 mostra la registrazione simultanea di due neuroni (LP, laterale pilorica neurone, PD, pilorica dilatatore neurone) nel generatore pilorica modello centrale di un granchio STG insieme con la registrazione dal LVN. Le registrazioni ottico dei neuroni LP e PD identificati sulla base delle loro registrazioni intracellulari mostrano che effettivamente queste corrispondono bene con le registrazioni extracellulari corrispondenti ai neuroni LP e PD. C'è un consistente ritardo 12 ms tra le registrazioni ottiche e LVN dei picchi di punta (vedi riquadro di Figura 2) a causa del ritardo di trasmissione assonale tra il ganglio e il sito di registrazione extracellulare. I dati presentati mostra anche che l'attività neurale nel soma che corrisponde ai picchi dei neuroni registrati sia chiaramente rilevabile.
s/ftp_upload/2567/2567fig1.jpg "alt =" Figura 1 "/>
Figura 1. A) Schema del sistema nervoso stomatogastric (STNS). CoG, commissurali ganglio; OG, ganglio esofageo, STG, ganglio stomatogastric; stn, nervo stomatogastric; LVN, nervo del ventricolo laterale. B) Il ganglio granchio stomatogastric (STG) - l'immagine mostra la disposizione semicircolare posteriore di neuroni STG.
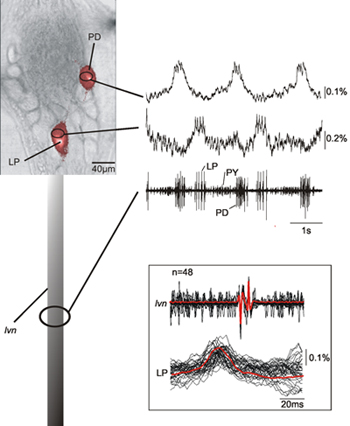
Figura 2. Simultanea registrazione singola scansione di un PD e un neurone LP con la registrazione del LVN. I dati mostrano che che le registrazioni del nervo ottico e partita molto bene e che siamo in grado di individuare le attività neurale corrispondente ai picchi registrati formare il nervo. L'inserto mostra una sovrapposizione di movimenti diversi di potenziali d'azione LP - sia otticamente che elettricamente registrate - e la loro media dimostrando la corrispondenza tra otticamente e attività elettrica registrata. A causa del fatto che il nostro metodo di registrazione ottica non filtra le componenti a bassa frequenza dei dati siamo anche in grado di registrare i cambiamenti lenti potenziale di membrana caratteristici per PD e LP neuroni 14.
Discussione
Il colorante sensibile tensione di imaging di 8,9 STG neuroni in combinazione con i tradizionali metodi di elettrofisiologia (registrazioni elettrodo intra ed extracellulare) consente una migliore comprensione di come questo piccolo, funziona bene conosciuto e ancora complesso sistema neurale. La STG è un prototipo di centrale modello generatore (CPG) reti neuronali (comprende il piloro e gastriche reti ritmo mulino) 10,, 11, quindi una migliore comprensione delle proprietà emergenti funzionali del STG aiuterà anche a capire come, in generale, reti CPG generare la loro funzionalità a livello di rete. Reti CPG giocano un ruolo critico nel controllo motorio 12 e anche nelle funzioni cognitive superiori 13, di conseguenza, una migliore comprensione delle loro proprietà emergenti possono avere un grande impatto in molte aree delle neuroscienze.
Divulgazioni
Riconoscimenti
Noi riconosciamo il sostegno della Facoltà di Scienze Informatica e Facoltà di Scienze, Agricoltura e Ingegneria dell'Università di Newcastle, da parte dell'Università di Ulm, e dal SciMedia Ltd (Tokyo, Giappone).
Materiali
| Name | Company | Catalog Number | Comments |
| MiCAM02 | SciMedia | Imaging system | |
| BVAna v.10.08 | SciMedia | Data analysis software for the MiCAM 02 imaging system | |
| HL-151 | Moritex, Tokyo, Japan | Ultra-low ripple halogen light source | |
| BX51 WI | Olympus Corporation | Upright microscope for epifluorescence imaging | |
| 20x imaging objective | Olympus Corporation | XLUMPLFL20XW/0.95 | NA 0.95, WD 2.0mm |
| 10x imaging objective | Olympus Corporation | UMPLFL10XW | NA 0.30, WD 3.3mm |
| Filter cube with 480-550 nm excitation filter and 590nm emission filter | Olympus Corporation | MSWG2 | |
| Antivibration table | Scientifica Ltd | 63-534 | |
| PatchStar electrode manipulator | Scientifica Ltd | PS-7000C | Micro-electrode manipulator |
| CED Power 1401 | Cambridge Electronic Design | Data acquisition board | |
| DL708E Oscilloscope | Yokogawa | Intracellular amplifier | |
| AC differential amplifier | University of Kaiserslautern, Germany | Extracellular amplifier | |
| P-97 Flaming – Brown type electrode puller | Sutter Instrument Co. | Electrode puller | |
| Sigma Microcentrifuge 1-14 | Sigma-Aldrich | Centrifuge | |
| Genex Pipettors Mline | Scientific Laboratory Supplies LTD | PIP7774 | PIP7774 |
| Glass micropipette with filament | Science Products | GB100TF 8P | Glass for micr–lectrodes |
| MicroFil – 34G | World Precision Instruments, Inc. | Microfil needle | |
| Spike 2 v6.10 | Cambridge Electronic Design | Electrophysiology software | |
| Di-8-ANEPPQ | Cambridge BioScience | BT61014 | Fluorescent voltage sensitive dye |
| F-127 Pluronic Acid, DMSO | Invitrogen | P-3000MP | Solvent |
| NaCl | Sigma-Aldrich | S9888 | Crab saline component |
| CaCl2 . 2H2O | Sigma-Aldrich | C3881 | Crab saline component |
| KCl | Sigma-Aldrich | P3911 | Crab saline component, electrolyte solution |
| MgCl2 . 6H2O | Sigma-Aldrich | M9272 | Crab saline component |
| Trizma base | Sigma-Aldrich | T1503 | Crab saline component |
| Maleic acid | Sigma-Aldrich | M0375 | Crab saline component |
| Elastosil RT-601 | Wacker, Munich, Germany | Lining of Petri dishes |
Riferimenti
- Gutierrez, G. J., Grashow, R. G. Cancer borealis stomatogastric nervous system dissection. J Vis Exp. , (2009).
- Bartos, M., Nusbaum, M. P. Intercircuit control of motor pattern modulation by presynaptic inhibition. J. Neurosci. 17, 2247-2256 (1997).
- Blitz, D. M., Nusbaum, M. P. Motor pattern selection via inhibition of parallel pathways. J Neurosci. 17, 4965-4975 (1997).
- Stein, W., Smarandache, C. R., Nickmann, M., Hedrich, U. B. Functional consequences of activity-dependent synaptic enhancement at a crustacean neuromuscular junction. J Exp Biol. 209, 1285-12300 (2006).
- Loew, L. Potentiometric dyes: Imaging electrical activity of cell membranes. Pure & Appl Chem. 68, 1405-1409 (1996).
- Tominaga, T., Tominaga, Y., Yamada, H., Matsumoto, G., Ichikawa, M. Quantification of optical signals with electrophysiological signals in neural activities of Di-4-ANEPPS stained rat hippocampal slices. J Neurosci Meth. 102, 11-23 (2000).
- Heinzel, H. G., Weimann, J. M., Marder, E. The behavioral repertoire of the gastric mill in the crab, Cancer pagurus: an in situ endoscopic and electrophysiological examination. J Neurosci. 13, 1793-1803 (1993).
- Zecevic, D., Wu, J. -. Y., Cohen, L. B., London, J. A., Höpp, H. P., Falk, C. X. Hundreds of neurons in the Aplysia abdominal ganglion are active during the gill-withdrawal reflex. J Neurosci. 9, 3681-3689 (1989).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. J Neurosci. 26, 10925-10933 (2006).
- Nusbaum, M. P., Beenhakker, M. P. A small-systems approach to motor pattern generation. Nature. 417, 343-350 (2002).
- Marder, E., Bucher, D. Understanding circuit dynamics using the stomatogastric nervous system of lobsters and crabs. Ann Rev Physiol. 69, 291-316 (2007).
- Grillner, S. Biological pattern generation: the cellular and computational logic of networks in motion. Neuron. 52, 751-766 (2006).
- Yuste, R., MacLean, J. N., Smith, J., Lansner, A. The cortex as a central pattern generator. Nat Rev Neurosci. 6, 477-483 (2005).
- Stein, W. Modulation of stomatogastric rhythms. J Comp Physiol A. 195, 989-1009 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon