È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Studiare Traiettorie cellulare Rolling Patterns Receptor asimmetrica
In questo articolo
Riepilogo
Abbiamo descritto un protocollo per osservare e analizzare le traiettorie delle cellule che rotola su asimmetrici recettore fantasia substrati. I dati risultanti sono utili per l'ingegneria del recettore-fantasia substrati per etichette senza separazione delle cellule e l'analisi.
Abstract
Spostamento laterale delle cellule ortogonale a un flusso di flusso di laminazione su modelli asimmetrici recettore rappresenta un'opportunità per lo sviluppo di nuovi dispositivi per l'etichetta senza separazione e l'analisi delle cellule 1. Tali dispositivi possono utilizzare spostamento laterale per flusso continuo di separazione, o schemi di recettori che modulano l'adesione di distinguere tra diversi fenotipi cellulari o livelli di espressione del recettore. Capire la natura delle traiettorie delle cellule rotolamento sul recettore modellata substrati è necessario per l'ingegneria dei substrati e progettazione di tali dispositivi.
Qui, dimostriamo un protocollo per lo studio delle traiettorie delle cellule che rotola su modelli asimmetrici recettore che sostengono l'adesione cellulare rotolamento 2. Ben definito, micron scala modelli di P-selectina recettori sono stati fabbricati usando stampa microcontact su oro rivestite diapositive che sono state incorporate in una camera di flusso. HL60 cellule che esprimono il PSGL-1 ligando 3 erano scorreva attraverso un campo di linee a motivi geometrici e visualizzati su un microscopio invertito in campo chiaro. Le cellule laminati e tracciati lungo i bordi inclinati dei modelli, con conseguente flessione laterale 1. Ogni cella tipicamente arrotolato per una certa distanza lungo i bordi modello (definito come la lunghezza di tracciamento bordo), staccato dal bordo, e riattaccato a un modello a valle. Anche se questo distacco rende difficile tenere traccia l'intera traiettoria di una cellula dall'entrata all'uscita della camera di flusso, di tracciamento di particelle-software è stato utilizzato per analizzare le traiettorie e la resa rotolamento delle cellule durante il periodo in cui si muovevano su un solo recettore con motivi di linea. Le traiettorie sono stati poi esaminati al fine di ottenere la distribuzione delle velocità di rotolamento delle cellule e le lunghezze di margine di monitoraggio per ogni cella per diversi modelli.
Questo protocollo è utile per quantificare le traiettorie delle cellule che rotola su modelli di recettori e relativi a questi parametri di ingegneria come l'angolo pattern e sforzo di taglio. Tali dati saranno utili per la progettazione di dispositivi microfluidici per l'etichetta senza separazione delle cellule e l'analisi.
Protocollo
1. HL60 cellula rotolamento
1.1. Fabbricazione di Patterned substrati.
- Utilizzando stampa microcontact (μCP) 4-7 per rendere alternati monostrati auto-assemblati (SAM) di molecole di PEG sull'oro rivestita vetrini: Realizzare microcontatto stampa polidimetilsilossano (PDMS) francobolli che ha definito i modelli recettore con angolo di inclinazione α = 10 ° con uno SU-8 processo di stampaggio. Pulire la superficie d'oro con soluzione piranha (3:1 miscela di acido solforico al 30% di perossido di idrogeno) per 20 minuti e risciacquare la superficie con abbondante acqua deionizzata a 24,5 ° C prima dell'uso. Dell'inchiostro il timbro PDMS con soluzione PEG 5mM in etanolo. Il timbro a secco in aria per 20 minuti. Gentilmente messo il timbro sulla superficie di oro per 40 sec e assicurarsi che ci sia un buon contatto tra la superficie d'oro e il timbro. Nessuna pressione in eccesso viene richiesto. Lavare la superficie con etanolo e asciugare sotto un flusso di N 2.
- Incubare il substrato all'interno di P-selectina soluzione (15 mg / mL in DPBS) utilizzando una camera di perfusione (Scienze della Microscopia Elettronica) per 3 ore a 24,5 ° C a modello le restanti aree con P-selectina. Lavare la superficie con abbondante DPBS.
- Backfill la superficie con BSA (1 mg / mL in DPBS) per 1 ora per bloccare non specifiche interazioni. Lavare la superficie con abbondante DPBS.
1.2. Cellula di Rolling Esperimenti in una camera di flusso.
- Flusso di una sospensione di cellule HL60 (~ 10 5 cellule / ml) sulla superficie lavorata in una camera di flusso rettangolare (Glycotech, Inc; larghezza w = cm 1,0; lunghezza = 6 cm, altezza h = 0,0127 centimetri) a 24,5 ° C. Utilizzare una pompa a siringa (Strumenti di precisione mondiale, SP230IW) per generare la portata di 75 microlitri / min, con corrispondente sforzo di taglio di circa 0,5 dyn / cm 2 (~ 0,05 Pa). Calcolare sforzo di taglio τ utilizzando l'aereo equazione del flusso di Poiseuille 6μQ/wh τ = 2, dove μ è la viscosità cinematica (0,001002 Pa s), Q è la portata volumetrica, w è la larghezza della camera di flusso, ed h è l'altezza del camera di flusso.
- Utilizzare un microscopio invertito (Nikon TE2000-U), con una telecamera montata (Andor ixon 885) per registrare le cellule HL60 rotolamento interazioni con adesivo P-selectina substrati con un 4 × obiettivo, di solito ad una velocità di 1 fotogramma al secondo per la durata di 300 s. Eseguire tre esperimenti indipendenti, per ogni grandezza sforzo di taglio e angolo di inclinazione del modello. Presentare i dati come media e deviazione standard dei valori medi ottenuti da ciascun esperimento.
- Analisi dei dati.
Analizzare le sequenze di immagini da una personalizzata Matlab (MathWorks, Inc.), programma che utilizzava una particella di tracciamento freeware di 8 a generare binari lungo i bordi linea di fantasia. Tracce di estendere fino alla fine di un P-selectina band sono selezionati e dotati di due segmenti di linea retta - uno allineato con il flusso, l'altro in linea con il bordo del modello. Questi due segmenti sono poi utilizzati per calcolare la lunghezza di tracciamento bordo, velocità di rotazione sul bordo, e la velocità di rotolamento sulla regione pianura.
2. Rappresentante dei risultati:
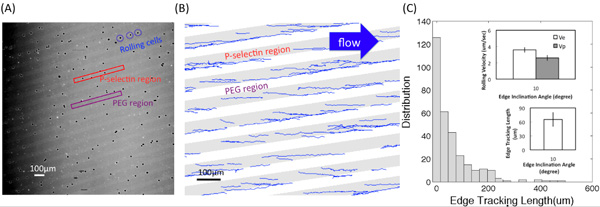
Figura (A) mostra una delle immagini al microscopio convertito dal video di HL60 interazioni laminazione con adesivo P-selectina substrati con un 4 × obiettivo. Regioni chiare e scure corrispondenti a P-selectina recettore e regioni PEG, rispettivamente. Figura (B) mostra le tracce ottenute con un programma personalizzato di Matlab. L'angolo di inclinazione limite era 10 ° e la tensione di taglio è stato dello 0,5 dyn / cm 2. La lunghezza di tracciamento bordo, l posta, spostamento, d, e le velocità di rotolamento sul bordo e all'interno della band, V e P e V, rispettivamente, sono descritti nella figura (C-1). Figura (C-2) mostra la distribuzione (il numero di cellule registrato) della lunghezza del bordo di monitoraggio. Riquadri mostrano il valore medio di l e la velocità di rotolamento e sul bordo (V e) e all'interno della band (V p) presso l'angolo di inclinazione α = 10 ° e la portata del fluido sforzo di taglio di circa 0,5 dyn / cm 2. Le barre di errore rappresentano una deviazione standard, dove n = 3 esperimenti di replicare (3 superfici replica) per ogni condizione.
Discussione
Abbiamo descritto un protocollo per esaminare le cellule che rotola su traiettorie asimmetriche recettore fantasia superfici fabbricate utilizzando stampa microcontact 2. Le immagini al microscopio ottico di superficie modellata che mostra il contrasto evidente tra PEG e P-selectina aree possono essere usati per confermare se stampaggio è successo. Sharp, bordi dritti si può osservare quando la timbratura viene eseguita bene. Dura pressione del bollo può causare deformazioni timbro che limita la precisione...
Divulgazioni
Riconoscimenti
Questo progetto è stato sostenuto dal Centro Deshpande per l'Innovazione Tecnologica del MIT (RK e JMK) e il premio alla carriera NSF 0.952.493 di RK attraverso la chimica e biologica programma Separazioni. Ringraziamo l'Istituto per le Nanotecnologie Soldier (ISN) e il Microsystems Technology Laboratory (MTL) al MIT per l'utilizzo dei loro impianti.
Materiali
| Name | Company | Catalog Number | Comments |
| Human promyelocytic leukemia cells | ATCC | CCL-240 | HL60 cells |
| Gold-coated glass slides | EMF | TA134 | Gold slides |
| (1-Mercaptoundec-11-yl)tetra(ethylene glycol) | Sigma-Aldrich | 674508 | PEG |
| Recombinant human P-selectin | R&D Systems | ADP3-050 | P-selectin |
| Bovine serum albumin | Rockland Immunochemicals | BSA-50 | BSA |
| Dulbecco’s phosphate buffered saline | Mediatech, Inc. | 21-030 | DPBS |
| Sulfuric acid | Sigma-Aldrich | 339741 | |
| Hydrogen peroxide | Sigma-Aldrich | 316989 |
Riferimenti
- Karnik, R., Hong, S., Zhang, H., Mei, Y., Anderson, D. G., Karp, J. M., Langer, R. Nanomechanical control of cell rolling in two dimensions through surface Patterning of receptors. Nano Lett. 8 (4), 1153-1158 (2008).
- Lee, C. H., Bose, S., Van Vliet, K. J., Karp, J. M., Karnik, R. Examining Lateral Displacement of HL60 Cells Rolling on Asymmetric P-selectin Patterns. Langmuir. 27 (1), 240-249 (2011).
- Norman, K. E., Moore, K. L., McEver, R. P., Ley, K. Leukocyte rolling in-vivo is mediated by p-selectin glycoprotein ligand-1. Blood. 86 (12), 4417-4421 (1995).
- Bernard, A., Delamarche, E., Schmid, H., Michel, B., Bosshard, H. R., Biebuyck, H. Printing patterns of proteins. Langmuir. 14 (9), 2225-2229 (1998).
- James, C. D., Davis, R. C., Kam, L., Craighead, H. G., Isaacson, M., Turner, J. N., Shain, W. Patterned protein layers on solid substrates by thin stamp microcontact printing. Langmuir. 14 (4), 741-744 (1998).
- Mrksich, M., Whitesides, G. M. Using self-assembled monolayers to understand the interactions of man-made surfaces with proteins and cells. Annual Review of Biophysics and Biomolecular Structure. 25, 55-78 (1996).
- Tan, J. L., Tien, J., Chen, C. S. Microcontact printing of proteins on mixed self-assembled monolayers. Langmuir. 18 (2), 519-523 (2002).
- Lee, D., King, M. R. Microcontact Printing of P-Selectin Increases the Rate of Neutrophil Recruitment Under Shear Flow. Biotechnology Progress. 24 (5), 1052-1059 .
- Greenberg, A. W., Hammer, D. A. Cell separation mediated by differential rolling adhesion. Biotechnol. Bioeng. 73 (2), 111-124 (2001).
- Higuchi, A., Tsukamoto, Y. Cell separation of hepatocytes and fibroblasts through surface-modified polyurethane membranes. J. Biomed. Mater. Res. Part A. 71A (3), 470-479 (2004).
- Alexeev, A., Verberg, R., Balazs, A. C. Patterned surfaces segregate compliant microcapsules. Langmuir. 23 (3), 983-987 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon