Method Article
Preparazione e utilizzo di HIV-1 CD4 infetti primaria + T-Cells come cellule bersaglio nei test di cellule Natural Killer citotossici
In questo articolo
Riepilogo
Saggi di citotossicità per misurare le risposte delle cellule naturali litici killer per le cellule infettate da HIV è limitata dalla purezza delle cellule bersaglio. Dimostriamo qui l'isolamento di una popolazione altamente purificata di infezione da HIV-1 primario a cellule T colpi sfruttando la capacità di HIV-1 s di down-modulare CD4.
Abstract
Natural killer (NK) sono una componente vitale della risposta immunitaria innata di cellule infettate da virus. E 'importante capire la capacità delle cellule NK di riconoscere e lisare HIV-1 le cellule infettate a causa individuare eventuali aberrancy nella funzione delle cellule NK contro le cellule infettate da HIV potrebbe portare a terapie che potrebbero aumentare la loro attività citolitica. Vi è la necessità di utilizzare con infezione da HIV primario delle cellule T esplosioni come cellule bersaglio piuttosto che infetta-linee di cellule T nel test di citotossicità. Linee di cellule T, anche in assenza di infezione, sono molto sensibili alla lisi delle cellule NK. Inoltre, è necessario l'utilizzo di cellule autologhe primarie per evitare grandi complessi di istocompatibilità di classe I squilibri tra il bersaglio e cellule effettrici che si tradurrà in lisi. I primi studi valutare le risposte delle cellule NK citolitica di primari di HIV-infettate le cellule non è riuscito a mostrare l'uccisione significativa del 1,2 cellule infette. Tuttavia, con HIV-1 infetti primarie cellule T come cellule bersaglio nei test funzionali delle cellule NK è stata difficile a causa della presenza di contaminanti cellule non infette 3. Questa cellula infettata incoerente rapporto tra cellule non infette si tradurrà in una modifica uccidendo cellule NK tra i campioni che non può essere dovuto alla variabilità in funzione dei donatori di cellule NK. Pertanto, sarebbe utile per lavorare con una popolazione purificata cellule infette al fine di standardizzare le effettrici delle cellule di indirizzare i rapporti tra esperimenti 3,4. Qui mostriamo l'isolamento di una popolazione altamente purificata di HIV-1 le cellule infettate sfruttando la capacità di HIV-1 di down-modulare CD4 su cellule infettate e la disponibilità di kit commerciali per rimuovere le cellule morte o morenti 3-6. L'infezione primaria purificato di cellule T esplosioni possono poi essere utilizzati come bersagli sia in un degranulazione o test citotossico con purificato le cellule NK, come la popolazione effettore 5-7. L'uso di cellule NK come effettori in un test di degranulazione valuta la capacità di una cellula NK per la diffusione del contenuto litica dei lisosomi specializzate 8 chiamata "granuli citolitica". Con la colorazione con un anticorpo fluorocromo coniugato contro CD107a, una proteina di membrana lisosomiale che diventa espresso sulla superficie delle cellule NK, quando i granuli citolitica fusibile alla membrana plasmatica, siamo in grado di determinare la percentuale di cellule NK degranulano in risposta al riconoscimento delle cellule bersaglio. In alternativa, l'attività delle cellule NK litica può essere valutata in un test citotossico che consente la determinazione della percentuale di cellule bersaglio lisate dal rilascio di 51 Cr all'interno della cellula bersaglio in presenza di cellule NK.
Protocollo
1. Isolamento di CD4 + T-umani da cellule di sangue periferico (vedi Figura 1)
- Sangue venoso periferico (da 40 a 60 ml) viene raccolto in Vacutainer Provette contenenti eparina di sodio (Becton Dickinson).
- Il sangue periferico è poi trasferita dal Vacutainer Tubi di tubi da 50 ml conica in polistirolo (20 ml di sangue per provetta).
- RosetteSep CD4 + T-Cell reagente isolamento (Tecnologie StemCell) viene aggiunto in un volume di 1 ml a non più di 20 ml di sangue in una provetta da 50 ml e mescolato bene.
- La miscela viene poi incubata a 20-25 ° C per 20 minuti.
- Dopo 20 minuti, calcio e magnesio-free (CMF) PBS [PBS (Hyclone] w / 2% di siero (56 ° C per 30 minuti) di siero fetale bovino [FBS (Hyclone)] viene aggiunto alle miscele al fine di raggiungere un volume finale di 40 ml.
- Le miscele diluito (30 ml) vengono poi a strati sopra di 15 ml di mezzo di separazione linfociti [LSM (Cellgro)] in acqua dolce tubi di polistirolo da 50 ml.
- I 50 mL sono poi centrifugati a 1200 x g per 20 minuti con il freno off.
- I 50 mL sono stati rimossi dalla centrifuga con attenzione, in modo che l'interfaccia tra il LSM e medie imprese non è disturbato. Le cellule a livello di interfaccia sono raccolti con una pipetta 10 ml e messo in fresco tubi in polistirolo da 50 ml.
- Le interfacce raccolti vengono diluiti con FBS PBS w / 2% ad un volume finale di 50 ml.
- I 50 mL contenente le interfacce diluiti vengono centrifugati a 1200 x g per 10 minuti con il freno.
- Dopo la centrifugazione, il sovranatante sono aspirati e il pellet risospeso in 10 ml di PBS w / 2% FBS.
- Le sospensioni cellulari sono poi combinati in un unico tubo da 50 ml e diluire a 50 ml con PBS w / 2% FBS.
- Il tubo contenente la sospensione cellulare viene centrifugato insieme a 300 x g per 10 minuti per rimuovere tutti i rimanenti LSM.
- Il supernatante viene aspirato e il pellet viene risospeso in 10 ml di RPMI-1640 medium (Hyclone) contenente 10% FBS, 100 U / ml di penicillina, 100 mcg / ml di streptomicina (Hyclone) e 2 mM L-glutammina (CellGro ) (RPMI-completo) e contati con un emocitometro.
- La concentrazione di purificato CD4 + T-Cells è quindi regolata in modo 3x10 6 / ml con RPMI-completo.
- CD4 + 's vengono poi stimolati dalla coltura con anti-CD3/anti-CD28 accoppiato ad perline [T-Cell Kit di espansione (Miltenyi Biotec)] in un rapporto di tre grani per ogni cella per 72 ore a 37 ° C in un 5% di C0 2 umidificata incubatrice.
2. L'infezione di cellule CD4 + T-Cells con HIV-1 (vedi Figura 1)
- Sospensione cellulare contenente CD4 + T-stimolato cellule vengono rimosse dalla piastra di coltura e contati con un emocitometro.
- CD4 + T-cellule (~ 2x10 6), aggiunti ad un tubo da 15 ml per l'uso come un controllo non infetto.
- Il resto dei CD4 + T-cellule sospensione viene inserito in una provetta da 50 ml conica per l'infezione.
- I tubi contenenti i CD4 + T-cellule sospensioni sono centrifugati a 300 x g per 10 minuti e il supernatante della coltura viene aspirato.
- CD4 + T-stimolato cellule sono risospese direttamente nei fluidi di coltura contenente virioni e poi spin-infettati a 1200 x g per 2 ore a 20-25 ° C 9. Tipicamente si infettano CD4 + T-cellule a una molteplicità di infezione (MOI) di 5 per un ceppo carente la replicazione dell'HIV (ad esempio, DHIV-3) o un MOI di 0,01 per un virus di replicarsi (ad esempio, l'HIV-1 NL4 / 3) . Volume finale non è importante, ma i tubi devono essere tarate per centrifugazione. Polibrene (Santa Cruz) si aggiungono al succo di cultura prima di spinfection ad una concentrazione finale di 10 mcg / ml.
- Al termine del spinfection, surnatanti vengono rimossi e le cellule risospese ad una densità cellulare di 3x10 6 / ml in RPMI-completo integrato con 100 U / mL di IL-2. Le cellule infette, sono la cultura per 72 ore, se un virus replica incompetente è stato utilizzato per infettare la cellula o 5-7 giorni se un virus di replicarsi è stato utilizzato per infettare le cellule. Media dovrebbero essere sostituiti ogni 48 ore durante cultura.
3. Isolamento di cellule Natural Killer da sangue periferico
- Sangue venoso periferico (circa 100 ml) viene raccolto dal donatore stesso utilizzato per isolare le cellule CD4 + T-cellule in Vacutainer Provette contenenti eparina di sodio (Becton Dickinson).
- Il sangue viene poi trasferito dal Vacutainer Tubi in 50 ml provette coniche in 20 aliquote da ml.
- Il Vacutainer I tubi sono poi lavati con 8 mL di soluzione CMF Salt Hanks Balanced [HBSS (Hyclone)] e la lava sono trasferiti al 50 ml conicals containing i 20 ml di sangue periferico. Il volume risulta in ogni conica da 50 ml è di 35 ml.
- Il sangue diluito viene quindi a strati sopra di 15 ml di LSM in un nuovo tubo da 50 ml e tubi centrifugati a 400 x g per 30 minuti con il freno.
- I tubi sono accuratamente rimosso dalla centrifuga e l'interfaccia risulta tra le LSM e medie viene raccolto da ciascuna provetta con una pipetta 10 ml e messo in fresco 50 ml provette coniche.
- Le sospensioni cellulari vengono lavati una volta con CMF HBSS (centrifugati a 400 x g per 15 minuti con il freno).
- Dopo il primo lavaggio il surnatanti vengono rimossi e il pellet risultanti sono combinati in un unico 50 ml conica e lavato due volte con CMF HBSS (centrifugati a 30 x g per 10 minuti con il freno a) per rimuovere tutti i rimanenti LSM.
- Dopo l'ultimo lavaggio il pellet è resupended in 10 ml di tampone di lisi ACK (150 mm NH 4 Cl, 1,0 mm KHCO 3 e 0.1 mM EDTA pH 7,3) e incubate a temperatura ambiente (20-25 ° C) per 5 minuti. Questo passaggio è necessario per rimuovere eritrociti contaminare dalle cellule mononucleate del sangue periferico (PBMC).
- Dopo 10 min. 40 ml di PBS CMF si aggiunge alla sospensione cellulare al fine di arrestare la reazione lisi.
- Il tubo con la sospensione cellulare contenente il eritrociti lisati PBMC e viene poi centrifugato a 300 x g per 10 minuti con il freno.
- Il surnatante viene rimosso e il pellet è risospeso in 5 ml di PBS con il 2% FBS e 2 mM EDTA e contati con un emocitometro.
- Il natural killer (NK) sono poi isolate dal PBMC utilizzando un kit di isolamento delle cellule NK [selezione negativa-umano (Miltenyi Biotec)] secondo le istruzioni del produttore.
- Il flow-through dalle colonne sono raccolti in provette da 15 ml e tubi vengono centrifugati a 300 x g per 10 minuti con il freno.
- I surnatanti sono stati rimossi e il pellet risospeso. I pellet risospeso sono combinati in un unico tubo in un volume totale di 1 ml di terreno Iscove di modifica Dulbecco [IMDM (Gibco)] supplementato con 10% AB + inattivato con il calore (56 ° C per 30 minuti) siero umano (HS) e contati con un emocitometro.
- Il volume di sospensione cellulare viene regolata con HS IMDM w/10% in modo che la densità finale delle cellule NK è 3x10 6 / ml. La sospensione cellulare viene diviso a metà. Un set di cellule NK riceve 200 U / mL di umana ricombinante interleuchina-2. L'altra serie di cellule viene lasciato in mezzo senza trattamento di citochine.
- Le colture di cellule NK vengono poi incubate overnight a 37 ° C CO, 5% 2
- Le cellule NK risultante vengono poi utilizzati come cellule effettrici sia per un test di degranulazione CD107a o 51 saggio di rilascio Cr.
4. Purificazione del virus HIV-1 cellule infette (vedi Figura 1)
- I fluidi di coltura contenente cellule infette vengono rimossi dalle tavole e centrifugati a 300 x g per 10 minuti con il freno.
- Il supernatante viene aspirato e il pellet risospeso in 2 ml di PBS con il 2% FBS e 2 mM EDTA e le cellule contate su un emocitometro.
- Cellule infette che non contengono virus HIV-1 sono isolati di distanza da quelli che ospitano il virus sfruttando il fatto che l'HIV-1 modula giù CD4. A questo scopo CD4 Kit di isolamento positivo (Invitrogen) è utilizzato secondo le istruzioni del produttore con l'eccezione che un a-CD4 tallone per rapporto cellulare viene utilizzato.
- Dopo la rimozione dei CD4 + T-cellule, le cellule morte vengono rimosse dalla popolazione di cellule purificate ospitare il virus utilizzando un morto Kit Rimozione Cell (Miltenyi Biotec) secondo le istruzioni del produttore.
- Il flow-through dopo la rimozione delle cellule morte in colonne è centrifugato a 300 x g per 10 minuti con il freno. Il surnatante viene rimosso, pellet risospeso in 1 ml di RPMI-complete e le celle sono contati.
- Le cellule purificate infetti sono pronto per essere utilizzato come bersagli in un test di degranulazione CD107a o 51 saggio di rilascio Cr.
5. CD107a Assay degranulazione (vedi Figura 2)
- Colture di cellule NK sono stati rimossi dalle piastre e la sospensione cellulare viene conteggiato.
- Sospensioni delle cellule NK sono centrifugati a 300 x g per 10 minuti con il freno.
- Le cellule NK sono risospese in RPMI-complete e la concentrazione finale regolata a 10 6 cellule / ml.
- Sospensioni di cellule isolate dal infetti e non infetti le cellule T generate nei passi precedenti sono centrifugati a 300 x g per 10 minuti con il freno.
- Surnatanti vengono rimossi ed il pellet risospeso in RPMI-completo a 2x10 6 cellule / ml.
- Cellule K562 sono usate come cellule positive obiettivo di controllo, in quanto sono molto sensibili alla lisi NK. Tche le cellule sono centrifugate a 300 x g per 10 minuti con il freno, surnatanti vengono rimossi ed il pellet risospeso in RPMI-completo a 2x10 6 cellule / ml
- In un 96-v-fondo piatto ben 100 mcl di obiettivi e 100 effettori MCL sono aggiunti ai pozzetti.
- Un pozzo contenente 100 effettori mcLof e 100 mcl di mezzo senza cellule bersaglio saranno utilizzati per non specifici degranulazione delle cellule NK.
- Per ogni pozzetto 10 mcLFITC-coniugato anti-CD107a (BDIS) è aggiunto.
- La lastra viene poi centrifugato a 20 x g per 2 minuti con il freno.
- La piastra è incubata centrifugata per 4 ore a 37 ° C e 5% di CO 2.
- Dopo l'incubazione il piatto è centrifugato a 400 x g per 5 minuti con il freno.
- Il surnatante viene rimosso dal pellet.
- Ogni bene è poi macchiata con il pannello seguente fluorocromo anticorpi coniugati in ghiaccio per 20 minuti in un totale di 100 buffer di flusso mcLof (PBS w / 2% FBS e 0,1% NaN 3)
- anti-CD3/14/20 [Pacific Blue-coniugati (Biolegend)]
- anti-CD56 [APC (Biolegend)]
- Dopo l'incubazione 20 minuti, 200 mcl di buffer di flusso si aggiunge a ciascun pozzetto e la piastra viene centrifugato a 400 x g per 5 minuti con il freno.
- Il buffer di flusso viene poi accuratamente aspirata da ogni pozzetto utilizzando una pipetta da 2 ml di aspirazione dotato di una punta di 200 micropipetta mcl, badando a non disturbare il pellet.
- Passo 15 e 16 si ripetono ancora una volta.
- I pellet sono risospesi in 200 mcl di 1% paraformaldeide in PBS CMF. Le sospensioni cellulari sono quindi trasferite in tubi di flusso.
- Volume totale è cresciuto a 300 mcl con l'aggiunta di ~ 100 mcl di 1% paraformaldeide in PBS CMF ad ogni provetta.
- Gli eventi (2x10 4) corrispondenti a cellule NK sono raccolti da un citofluorimetro utilizzando il DIVA FACS (BDIS) software per l'acquisizione e analizzati utilizzando il software di flusso Jo (TreeStar).
6. CD107a strategia di gating (vedi Figura 3)
- Cancelli singola cellula vengono create utilizzando una altezza avanti scatter (FSC-H) vs larghezza scatter in avanti (FSC-W) trama.
- Per trama dimensioni rispetto a granularità un lato FSC vs scatter (SSC) trama è creato sul cancello singola cella. Tipicamente linfociti hanno granularità relativamente bassa e la cella di medie dimensioni.
- Le cellule del cancello linfociti vengono poi tracciate in un dot plot di CD3/14/20 cellule colorate contro CD56 cellule colorate al cancello sulle cellule NK omettendo monociti (CD14), cellule T (CD3) e B-cellule ( CD20).
- La popolazione CD56 pos gated viene poi valutato per CD107a.
- Le cellule NK, senza obiettivi di gruppo viene utilizzato per impostare le porte per quello che è considerato CD107a negativo.
7. 51 Cr Saggio di rilascio (vedi figura 4)
- Cellule bersaglio infettate sono etichettati con 125 MCCI 51 Cr (Perkin Elmer) saline/10 a 6 celle per 2 ore in un totale di 500 mcl a 37 ° C e 5% di CO 2. Come controllo positivo 10 6 cellule K562 sono etichettati con 100 MCCI 51 Cr per 2 ore in un totale di 500 mcl a 37 ° C e 5% di CO 2. Il volume totale è portato fino a 500 mcl con RPMI-completo. Il volume di 51 Cr aggiunto alle cellule bersaglio è calcolato qui: (http://las.perkinelmer.com/Catalog/RadCalculator.htm?Mode=RadioactivityCalculator)
- Mentre le cellule bersaglio sono l'etichettatura, precedentemente isolate le cellule NK sono stati rimossi dalla cultura e contati. Colture cellulari contenenti cellule NK sono centrifugati a 300 x g per 10 minuti con i freni.
- Pellet contenente cellule NK sono risospese in RPMI-completa e suddivisa in 3 tubi. La densità delle cellule è regolata a 10 5 / ml in una provetta, 2.5x10 5 / ml nel secondo tubo e 5x10 5 / mL nel terzo tubo.
- Etichettati cellule obiettivi sono ritirate dall 'incubatrice e 4,5 mL di RPMI-completo è aggiunto ad ogni provetta. I tubi sono poi centrifugati a 300 x gf o 10 minuti.
- Surnatante è travasato con attenzione per non disturbare il pellet in un contenitore per rifiuti radioattivi liquidi.
- Punti 4 e 5 sono ripetuti due volte di più per rimuovere tutte le assorbito 51 Cr. Surnatanti dal terzo lavaggio può essere smaltito in un contenitore per rifiuti non radioattivi liquidi.
- Obiettivi etichettati vengono poi risospesi in RPMI-completo per una densità cellulare finale di 10 5 / ml.
- 100 mcl di obiettivi etichettati sono aliquotati in pozzetti di una 96-v-piastra inferiore e per un numero di cellule finale di 10 4 cellule bersaglio / bene.
- Tabella 1 è un esempio di una configurazione tipica per un saggio di 51 rilascio Cr. Ogni gruppo è fatta in triplice copia.
1 2 3 4 5 6 7 8 9 A K562 E: T (1:1) K562 E: T (1:1) K562 E: T (1:1) K562 E: T (2.5:1) K562 E: T (2.5:1) K562 E: T (2.5:1) K562 E: T (5:1) K562 E: T (5:1) K562 E: T (5:1) B UI E: T (1:1) UI E: T (1:1) UI E: T (1:1) UI E: T (2.5:1) UI E: T (2.5:1) UI E: T (2.5:1) UI E: T (5:1) UI E: T (5:1) UI E: T (5:1) C Infetti da HIV-1 E: T (1:1) Infetti da HIV-1 E: T (1:1) Infetti da HIV-1 E: T (1:1) Infetti da HIV-1 E: T (2.5:1) Infetti da HIV-1 E: T (2.5:1) Infetti da HIV-1 E: T (2.5:1) Infetti da HIV-1 E: T (1:1) Infetti da HIV-1 E: T (1:1) Infetti da HIV-1 E: T (1:1) D E F K562 rilascio spontaneo K562 rilascio spontaneo K562 rilascio spontaneo UI rilascio spontaneo UI rilascio spontaneo UI rilascio spontaneo HIV-1 infetti rilascio spontaneo HIV-1 infetti rilascio spontaneo HIV-1 infetti rilascio spontaneo G K562 massimo rilascio K562 massimo rilascio K562 massimo rilascio UI massima rilascio UI massima rilascio UI massima rilascio HIV-1 infetti rilascio Maxmum HIV-1 infetti rilascio Maxmum HIV-1 infetti rilascio Maxmum - 100 mcl delle sospensioni sopra delle cellule NK vengono aggiunti a ciascun pozzetto contenente cellule bersaglio.
- 100 mcl di obiettivi vengono aggiunti nei pozzetti corrispondenti in cui le cellule effettrici sono assenti per i gruppi di massimo rilascio e spontaneo. Il gruppo di rilascio spontaneo viene incubato con ulteriori 100 mcl di RPMI-completo.
- La piastra a 96 pozzetti è centrifugato a 20 x g per 2 minuti con il freno.
- La lastra viene poi centrifugato incubate a 37 ° C e 5% di CO 2 per 4 ore.
- Dopo le 4 ore di incubazione di 5 mcl di una diluizione 1:10 di globuli rossi in RPMI-completo è aggiunto in ciascun pozzetto tranne i pozzi massimo rilascio.
- 100 mcl di solfato di sodio al 10% dodecil viene aggiunto ai pozzetti massimo rilascio.
- La piastra è centrifugato a 400 x g per 5 minuti per far sedimentare le cellule.
- 100 mcl di cell-free surnatante viene raccolto da ogni bene e messo in separato gamma-counter tubi (Perkin Elmer). I tubi sono collocati in un contatore gamma 2470 Automatica (Perkin Elmer). La quantità di 51 Cr presenti nel fluido cultura è misurata come conteggi al minuto dalla media di 2 minuti di lettura.
- Conteggi per minuto (CPM) letture dei campioni e controlli vengono utilizzati per calcolare la lisi specifiche% utilizzando la seguente equazione:
[(Sperimentale CPM - media di spontanea CPM) / (media di CPM massimo - media spontanea CPM)] x 100
8. Rappresentante dei risultati:
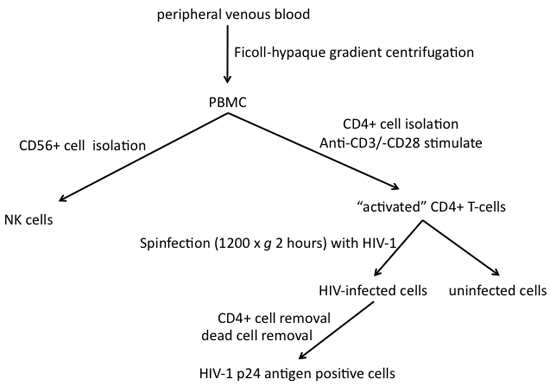
Figura 1. Passi necessari per l'isolamento delle cellule killer naturali e produzione di HIV-1 le cellule bersaglio infettate dal sangue periferico.
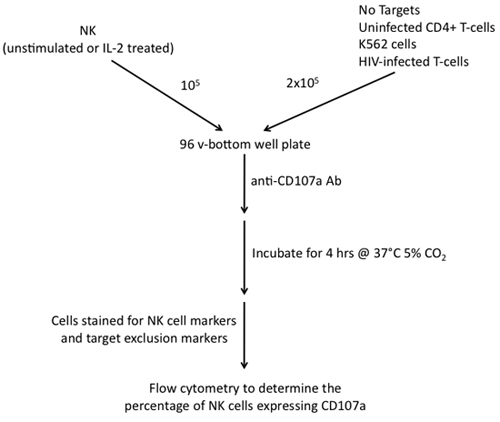
Figura 2. Passi necessari per la costruzione di un test di degranulazione CD107a utilizzando cellule NK come effettori e cellule K562, CD4 + non infette cellule T e HIV-1 infetti le cellule T come obiettivi.
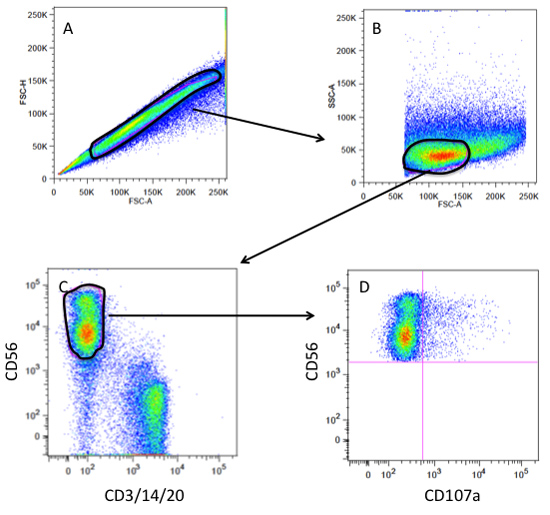
Figura 3. Citometria a flusso-gating strategia per un saggio degranulazione CD107a. (A) gating su singole cellule e macchie escludere o doppiette su un terreno di FSC-A (zona scatter in avanti) vs FSC-H (altezza scatter in avanti). (B) porta cellula singola tracciati come FSC-A vs SSC (side scatter) gate sulla popolazione linfocitaria. (C) porta linfociti rappresentati come CD3/14/20(Cellule T, monociti, cellule B) contro CD56 (cellule NK) gating sul pos andCD3/14/20 popolazione CD56 neg (NK cancello). (D) NK cancello tracciate come CD107a vs CD56 per visualizzare le cellule NK che hanno degranulated (CD107a pos).
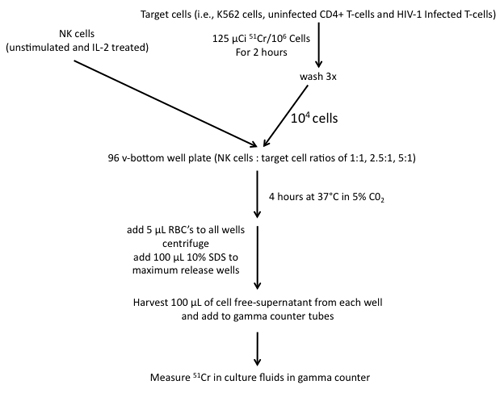
Figura 4. Passi necessari per la costruzione di un test di 51 rilascio Cr utilizzando cellule NK come effettori e cellule K562, CD4 + non infette cellule T e HIV-1 infetti le cellule T come obiettivi.
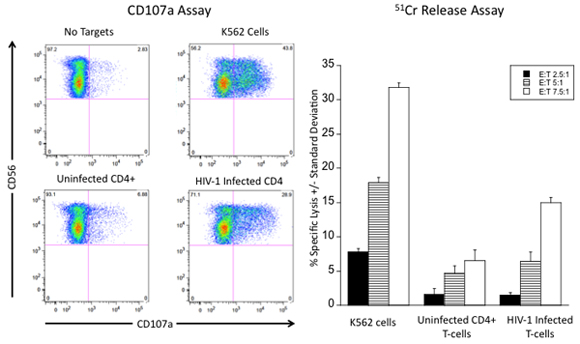
Figura 5. Risultati rappresentativi per la valutazione della risposta citotossica delle cellule natural killer contro l'HIV-1 le cellule infette. (A), le cellule NK sono stati valutati per la loro capacità di degranulano senza obiettivi e in risposta alle cellule K562, CD4 primarie + T-cellule e con infezione da HIV primaria cellule T valutata in base alla percentuale di cellule NK che CD107a superficie esprimere. I numeri in ogni quadrante rappresentano la percentuale del totale delle cellule NK. B) le cellule NK sono valutati per la loro capacità di lisare cellule K562, CD4 + non infette delle cellule T e HIV-1 infetti le cellule T in un test di 51 Cr rilascio a diverse cellule effettrici di indirizzare rapporti di cella (E: T).
Discussione
Se fatto correttamente il test descritti in questo protocollo dovrebbe fornire un quadro rappresentativo della capacità delle cellule NK di degranulano contrari e lisare HIV-1 cellule infette (vedi Figura 5). Degranulazione delle cellule NK in risposta ad infezione da HIV delle cellule e le cellule NK lisi cellule infettate da HIV dovrebbe essere direttamente proporzionale 10. Risultati affidabili per i due test funzionale delle cellule NK di misurare le risposte citotossiche per le cellule infettate da HIV dipendono l'isolamento delle cellule NK altamente purificato, nonché una popolazione altamente purificata delle cellule infette. Dopo aver purificato le cellule NK e HIV-1 le cellule infettate sono fondamentali per il raggiungimento di un effettore abbastanza preciso bersaglio rapporto cellulare. Allo stesso modo, la rimozione delle cellule morte e dalle popolazioni di cellule apoptotiche l'obiettivo è importante prima di 51 Cr etichettatura o l'incubazione con le cellule effettrici. 51 Cr possono essere internalizzati dalle cellule che sono in fase di apoptosi come la presenza di cellule morte o apoptosi durante la fase di etichettatura isotopo si tradurrà in un comunicato alta spontaneo e distorcere la lisi% calcolato specifici. Inoltre, la presenza di cellule morte o apoptosi può scatenare la degranulazione delle cellule NK con conseguente livelli anormalmente elevati di espressione CD107a. Pipettaggio preciso è necessario quando si rimuove la cellula senza sopranatanti dopo l'incubazione delle cellule NK e cellule bersaglio nei 51 saggi rilascio Cr, come le differenze nel volume del sopranatante rimosso da ogni replica e si tradurrà in alto deviazioni standard. Modifiche possono essere apportate a tali protocolli per valutare il ruolo di specifici recettori NK nello scatenare la lisi delle cellule NK di infezione da HIV delle cellule tramite l'incubazione del effettori o obiettivi prima di co-coltura con anticorpi antagonista ai recettori specifici o ligandi 6,11. Citochine trattati con cellule NK (ad esempio, IL-2, IL-15) può essere utilizzato per valutare la funzionalità delle cellule NK stimolate 12. Allo stesso modo, anticorpo-dipendente saggi di citotossicità delle cellule potranno essere eseguiti usando questi protocolli. Anticorpi anti-HIV (es. anti-gp120) possono essere aggiunti alle cellule bersaglio per il riconoscimento da parte delle cellule NK bassa affinità per il recettore Fc CD16 13. Questi test, pur essendo stato creato per misurare le risposte delle cellule NK citotossiche per le cellule infettate da HIV, possono anche essere modificati per misurare la capacità delle cellule NK per la produzione di citochine dopo infezione da HIV riconoscimento delle cellule. Anche se abbiamo descritto in questo protocollo l'uso di cellule in vitro le cellule infette come obiettivo abbiamo recentemente descritto la generazione di cellule bersaglio da pazienti infettati con HIV. Ciò richiede l'isolamento di cellule CD4 + T-cellule seguita dalla dilatazione delle cellule nel corso di un periodo di due settimane dopo stimolazione con mitogeni in presenza di interleuchina-2 11. Dopo il periodo di due settimane di espansione, i protocolli descritti in questo articolo sono utilizzati per isolare le cellule bersaglio.
Divulgazioni
Materiali
| Name | Company | Catalog Number | Comments |
| Vaccutainer Tubes (Sodium Heparin) | BD Biosciences | 367874 | |
| RosetteSep CD4+ T-cell Isolation Kit | Stem Cell Technologies | 15062 | |
| CMF PBS | Hyclone | SH30256.01 | |
| FBS | Hyclone | 10437-028 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| RPMI-1640 | Hyclone | SH30096.01 | |
| Penicillin / Streptomycin | Hyclone | SV30010 | |
| L-glutamine | Cellgro | 25-005-Cl | |
| T-cell Expansion Kit | Miltenyi Biotec | 130-091-441 | |
| CMF HBSS (1x) | Hyclone | SH30588.01 | |
| 0.5M EDTA | 46-034-Cl | ||
| NK Cell Negative Isolation Kit | Miltenyi Biotec | 130-092-657 | |
| IMDM | GIBCO, by Life Technologies | 12440-046 | |
| CD4+ Positive Isolation Kit | Invitrogen | 113.31D | |
| Dead Cell Removal Kit | Miltenyi Biotec | 130-090-101 | |
| Polybrene | Santa Cruz Biotechnology, Inc. | sc-134220 | |
| CD3 PacificBlue | BD Biosciences | 558117 | |
| CD14 PacificBlue | Biolegend | 325616 | |
| CD20 PacificBlue | Biolegend | 302328 | |
| CD56 APC | Biolegend | 318310 | |
| CD69 PE | BD Biosciences | 555531 | |
| CD107a FITC | BD Biosciences | 555800 | |
| 51Chromium | PerkinElmer, Inc. | NEZ030002MC | |
| Gamma Counter Tubes | PerkinElmer, Inc. | 1270-401 | |
| 2470 Automatic Gamma Counter | PerkinElmer, Inc. | 2470-0050 | |
| FACS Diva | BD Biosciences | 643629 | |
| FlowJo | Tree Star, Inc. | FJ-9-1YR |
Riferimenti
- Ruscetti, F. W. Analysis of effector mechanisms against HTLV-I- and HTLV-III/LAV-infected lymphoid cells. J Immunol. 136, 3619-3624 (1986).
- Zheng, Z. Y., Zucker-Franklin, D. Apparent ineffectiveness of natural killer cells vis-a-vis retrovirus-infected targets. J Immunol. 148, 3679-3685 (1992).
- Ferrari, G. Clade B-based HIV-1 vaccines elicit cross-clade cytotoxic T lymphocyte reactivities in uninfected volunteers. Proc Natl Acad Sci U S A. 94, 1396-1401 (1997).
- Shankar, P. Impaired function of circulating HIV-specific CD8(+) T cells in chronic human immunodeficiency virus infection. Blood. 96, 3094-3101 (2000).
- Ward, J. HIV-1 Vpr triggers natural killer cell-mediated lysis of infected cells through activation of the ATR-mediated DNA damage response. PLoS Pathog. 5, e1000613-e1000613 (2009).
- Ward, J. HIV modulates the expression of ligands important in triggering natural killer cell cytotoxic responses on infected primary T-cell blasts. Blood. 110, 1207-1214 (2007).
- Bonaparte, M. I., Barker, E. Killing of human immunodeficiency virus-infected primary T-cell blasts by autologous natural killer cells is dependent on the ability of the virus to alter the expression of major histocompatibility complex class I molecules. Blood. 104, 2087-2094 (2004).
- Stinchcombe, J. C., Griffiths, G. M. Secretory mechanisms in cell-mediated cytotoxicity. Annu Rev Cell Dev Biol. 23, 495-517 (2007).
- O'Doherty, U., Swiggard, W. J., Malim, M. H. Human immunodeficiency virus type 1 spinoculation enhances infection through virus binding. J Virol. 74, 10074-10080 (2000).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294, 15-22 (2004).
- Fogli, M. Lysis of endogenously infected CD4+ T cell blasts by rIL-2 activated autologous natural killer cells from HIV-infected viremic individuals. PLoS Pathog. 4, e1000101-e1000101 (2008).
- Tomescu, C., Chehimi, J., Maino, V. C., Montaner, L. J. NK cell lysis of HIV-1-infected autologous CD4 primary T cells: requirement for IFN-mediated NK activation by plasmacytoid dendritic cells. J Immunol. 179, 2097-2104 (2007).
- Ward, J. P., Bonaparte, M. I., Barker, E. HLA-C and HLA-E reduce antibody-dependent natural killer cell-mediated cytotoxicity of HIV-infected primary T cell blasts. Aids. 18, 1769-1779 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon