È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Trasfezione delle cellule gangliari della retina di topo In vivo Elettroporazione
In questo articolo
Riepilogo
Ci mostrano un In vivo Protocollo di elettroporazione per trasfezione singoli o piccoli gruppi di cellule gangliari della retina (RGCs) e altri tipi di cellule della retina nei topi postnatale in un ampio intervallo di età. La capacità di etichetta e manipolare geneticamente RGCs postnatale In vivo È un potente strumento per gli studi di sviluppo.
Abstract
Il targeting e la raffinatezza di proiezioni RGC al mesencefalo è un sistema modello popolare e potente per studiare come schemi precisi di forma connettività neurale durante lo sviluppo. Nei topi, proiezioni retinofugal sono disposti in modo topografico e la forma degli occhi-specifica i livelli del nucleo genicolato laterale (dLGN) del talamo e il collicolo superiore (SC). Lo sviluppo di tali schemi precisi di proiezioni retinofugal è generalmente stata studiata mediante l'etichettatura popolazioni di RGCs con tinture fluorescenti e traccianti, come la perossidasi di rafano 1-4. Tuttavia, questi metodi sono troppo grossolana per fornire la visibilità delle modifiche di sviluppo nei singoli RGC morfologia assonale pergolato che sono alla base della formazione di mappa retinotopica. Inoltre non consentono la manipolazione genetica di RGCs.
Recentemente, elettroporazione è diventato un metodo efficace per fornire un controllo preciso spaziale e temporale per la consegna di molecole cariche nella retina 5-11. Attuali protocolli di elettroporazione della retina non consentono la manipolazione genetica e la rintracciabilità di proiezioni retinofugal di un singolo cluster o piccole RGCs nei topi postnatale. Si è sostenuto che dopo la nascita in elettroporazione in vivo non è un metodo praticabile per trasfezione RGCs poiché l'efficienza di etichettatura è estremamente bassa e, quindi, richiede targeting in età embrionale quando progenitori RGC sono in fase di differenziazione e la proliferazione 6.
In questo video possiamo descrivere un protocollo di elettroporazione in vivo per la somministrazione mirata di geni, shRNA e destrani fluorescenti a RGCs murino dopo la nascita. Questa tecnica fornisce una soluzione efficace, veloce e relativamente facile piattaforma efficace per lo screening di geni candidati coinvolti in diversi aspetti dello sviluppo neurale tra cui retrazione assone, ramificazione, laminazione, rigenerazione e formazione di sinapsi nelle varie fasi di sviluppo del circuito. In sintesi descriviamo qui un prezioso strumento che fornirà ulteriori approfondimenti sui meccanismi molecolari alla base dello sviluppo sensoriale mappa.
Protocollo
1. Attrezzature Set-up per elettroporazione
- Elettrodi: Abbiamo modificato Dumont # 5 pinze da utilizzare come elettrodi.
- Separato e spezzare il forcipe.
- Saldare un filo, alla fine di ogni più ampio polo. Avvolgere il filo attaccato e denti con nastro isolante lasciando circa 25-30 mm della punta dei denti esposti.
- Mettere la pinza modificato di nuovo insieme con qualsiasi distanziatore plastico (ad esempio un pulsante) tra i due poli di fornire molla.
- Apparecchiature elettriche: Utilizziamo uno stimolatore elettrico per fornire impulsi di corrente per l'elettroporazione e oscilloscopio e un monitor audio per confermare la forma d'onda e il numero di impulsi di essere consegnati.
- Collegare il cavo da un polo della pinza ad un pedale che è anche collegata in serie con lo stimolatore. Il comando a pedale agisce come un interruttore. Quando sei depresso si completa il circuito per l'elettroporazione.
- Collegare il cavo dal polo altri allo stimolatore elettrico.
- Collegare lo stimolatore per l'oscilloscopio e monitor audio.
- Micropipetta iniettore e set-up: Noi usiamo taglienti pipette di vetro tirata ed il Nanoinject II sistema di iniezione per iniettare volumi molto piccoli di colore o la soluzione di DNA direttamente nella retina.
- Sistema di montaggio su un iniettore a 3 assi micromanipolatore.
- Tirare pipette di vetro con una candela lunga e piccola mancia.
- Riempire di nuovo la pipetta tirato con olio minerale e sicuro per iniettore (per dettagli vedere Nanoinect manuale di istruzioni II).
- Utilizzando taglienti forbici microdissecting un taglio la punta della pipetta, creando una piccola apertura (~ 2-3 micron).
- Riempire la pipetta con la quantità desiderata di soluzione per iniezione attraverso la punta della pipetta. Finché l'integrità della punta tiene, può essere utilizzato per le iniezioni multiple e gli animali.
Nota: i) Assicurare soluzione iniettabile è abbastanza caricata in punta in modo che l'olio minerale riempito non è mai iniettato nell'occhio. ii) Il Nanoinject II sistema e l'attrezzatura elettronica specifica utilizzata in questo video non sono cruciali per il raggiungimento etichettatura successo RGCs. Iniezioni effettuate con altri dispositivi quali un picospritzer ed elettroporazione con altri stimolatori comune può anche essere usato per RGCs etichetta.
2. Soluzioni per l'etichettatura plasmide RGC
- Per l'etichettatura piccoli gruppi di RGCs: Utilizziamo un costrutto codifica EGFP (~ 2-3 mg / mL) migliorato green fluorescent protein) sotto il controllo di un promotore CAG (pollo β-actina promotore di un immediato CMV primi enhancer). EGFP è etichettato con la sequenza palmitoilazione di GAP-43 (proteina associata alla crescita-43) che mira alla membrana cellulare (mut4EGFP) 12. Questo costrutto si riferisce a come pCAG-gapEGFP.
- Per l'etichettatura singola cella: Noi usiamo una combinazione di due costrutti. Il primo vettore è un promotore CAG guida Cre ricombinasi (pCAG-Cre, Addgene [Cambridge, MA] plasmide 13775) 13 e il secondo vettore contiene una cassetta floxed arresto seguito da membrana mirati EGFP (pCAG-LNL-gapEGFP). pCAG-Cre (~ 0.15-ng/μL) è utilizzato ad una concentrazione di circa 1.000-10.000 volte inferiore a quella pCAG-LNL-gapEGFP (~ 1-2 μgμL), confinando forte espressione EGFP ad un piccolo numero di cellule (in virtù di il relativamente basso pCAG Cre-concentrazione).
3. Iniezione della retina e il protocollo Elettroporazione
- Giorno postnatale 0 (P0) per cuccioli P5 sono anestetizzati da ipotermia, mentre i topi di età superiore ai P5 sono anestetizzati con una iniezione intraperitoneale (0,7 ml / kg) di un cocktail di ketamina (4.28 mg / mL), xilazina (0,82 mg / ml) , e acepromazina (0.07mg/ml) 14.
- Sterilizzare tutti gli strumenti chirurgici e le punte degli elettrodi in uno sterilizzatore a caldo tallone. Successivamente fresco sia in soluzione salina sterile prima dell'uso per evitare danni termici per l'occhio.
- Topo luogo sotto una portata dissezione e la posizione degli iniettori.
- Per i topi di età inferiore ai P14 (prima di aprire gli occhi), chirurgicamente aprire la palpebra, tagliando tutta la lunghezza di apertura delle palpebre futuro con b molle micro dissezione forbici.
- Rendere il bulbo oculare in parte sporgere leggermente pressione intorno all'occhio con la punta delle pinze c.
- Tenere l'occhio in posizione da pizzicando delicatamente la pelle intorno al bulbo oculare.
- Regolare micromanipolatore e portare pipetta vicino al bulbo oculare.
- Stampa pedale, che è collegato al II Nanoinject sistema, di espellere alcune gocce di soluzione di iniezione e quindi verificare che la pipetta non sia intasato.
- Con una mano la stabilizzazione del bulbo oculare, spostare il micromanipolatore in modo che la punta della pipetta di vetro penetra attraverso l'epitelio pigmentato retinico ed entra nella retina.
- Iniettare desIRED quantità di soluzione premendo il pedale per il sistema Nanoinject II. Ad esempio, per l'etichetta RGCs singolo facciamo una singola iniezione di 2,3 4.6nL.
- Ritrarre la pipetta e attentamente luogo punte degli elettrodi direttamente sul sito di iniezione e premere il pedale per stimolatore per completare il circuito e electroporate l'occhio. Usiamo tipicamente impulsi quadrati con impostazioni di potenza 25V, 50msec durata, 1sec a parte. 10 impulsi (5 impulsi di ogni polarità) si applicano per i topi vengono applicati impulsi di età superiore ai P4 e 6 (3 impulsi di ogni polarità) per P0 ai topi P3.
- Spingere delicatamente bulbo oculare indietro nella presa e applicare una pomata oftalmica sterile sulle palpebre tagliate.
- Animali posto su un blocco controllato la temperatura e calore per il recupero completo, compreso rewarming adeguata e la mobilità, il ritorno degli animali alla loro madre.
- Monitorare gli animali ogni 12 ore per ogni segno di dolore, angoscia o disagio, come la perdita della mobilità, postura anomala o mancato sposo. Ripetuti giri di anestesia, iniezioni ed elettroporazione non deve essere eseguito sull'animale stesso.
4. Note
- Il metodo di iniezione descritto in questo video è una iniezione di 'cieco'. E 'possibile visualizzare la quantità e la posizione di iniezione quando si lavora con i topi albini e soluzioni colorate (DII o soluzione plasmide con tracce di blu veloce). Tuttavia, con ceppi di topi pigmentati la posizione di iniezione non può essere direttamente visualizzati e quindi è difficile da descrivere verbalmente se uno ha raggiunto la posizione desiderata della retina o fino a che punto si dovrebbe spostare la pipetta di indirizzare lo strato RGC specifico. Pertanto, vi consigliamo vivamente di nuovi utenti al primo avvio con iniezioni Dii nei topi albini poiché queste iniezioni possono essere visualizzati immediatamente nella retina e l'etichettatura delle proiezioni RGC alla retina e il cervello può essere utilizzato per valutare la qualità di iniezione. Preparare il 10% Dii in N, N-Dimetilformammide (100%) per preparazioni iniettabili focale. Utenti una volta che questa procedura è padroneggiata dovrebbe essere in grado di indirizzare in modo coerente con le soluzioni RGCs DNA plasmidico chiaro nei topi pigmentati.
- Il metodo di iniezione descritto in questo video può essere usato per fare focale iniezioni DII di etichettare piccole popolazioni di cellule per studiare retinotopy (4.6nL etichette a poche centinaia di RGCS) 14 e RGCs etichetta di massa con fluorofori (Alexa555, 488, ecc), coniugata con subunità B della tossina del colera per studiare occhio specifici segregazione, escluso il passo elettroporazione in # 10. Un volume massimo di iniezione totale di 2-3UL per i topi di età superiore ai P14 e 1-2uL per i topi di età inferiore ai P14 di qualsiasi soluzione è raccomandato.
- Pipette può essere riempito con le soluzioni da iniettare seguita da riempimento con olio minerale prima di montare la pipetta sul iniettore e la rottura della punta. Questo è particolarmente utile quando si utilizzano soluzioni di DNA ad alta concentrazione (~ 6ug/uL), che sono generalmente molto viscoso e difficile da caricare dalla punta della pipetta.
- Se la pipetta di vetro si ostruisce, asciugare con cura la punta della pipetta con un batuffolo di cotone imbevuto di acqua per soluzioni di DNA ed etanolo (100%) per il colorante (DII) soluzioni.
- Dopo aver iniettato negli occhi, ritrarre la punta della pipetta dal bulbo oculare e premere il pedale per iniettare di nuovo. Questo per confermare che la punta non intasarsi durante il processo di iniezione. Se nessuna soluzione è dispensato, è molto probabile che l'iniezione non ha avuto successo. Tuttavia, questo non dovrebbe essere preso come un segno assoluto che l'iniezione non ha avuto successo. Lo sperimentatore può iniettare lo stesso occhio di nuovo se i siti di iniezione multipla e l'etichettatura di un maggior numero di cellule è voluta.
- Per l'etichettatura RGCs singolo, impostare la velocità di iniezione per rallentare la casella di controllo Nanoinject. Ciò riduce ulteriormente la quantità di soluzione iniettata nella retina in quanto il sistema impiega più tempo a questa impostazione di dispensare la soluzione allo stesso tempo la punta di pipette di vetro viene riavvolta velocemente dal bulbo oculare.
- Elettroporazione del giorno postnatale 0 a 3 (P0 a P3) topi richiede una cura ulteriore dato che è molto facile danneggiare l'occhio (questo diventa evidente dopo pochi giorni di recupero, quando l'occhio è palesemente più piccola del normale). Ridurre il numero di impulsi e la tensione applicata è consigliabile per i primi di topo neonato. Dopo P4, i bulbi oculari sono più resistenti ai danni causati dal elettroporazione.
- Nelle versioni nostra esperienza membrana mirata di EGFP o RFP ('gapEGFP', si veda 12) sono di gran lunga superiore alla GFP non modificato per l'esame delle proiezioni retinofugal al cervello. Tuttavia, pCAG-tdTomato, che manca di una membrana targeting modifica, funziona anche bene (Figura 1E). Inoltre, destrano coniugato coloranti fluorescenti possono essere utilizzati anche per RGCs etichetta utilizzando il protocollo di elettroporazione sopra descritto.
- Tipicamente, 9 su 10 iniezioni porterà a RGCs etichettati, anche se solo circa il 15% delle iniezioni con il duplice approccio plasmide sirisultato in appena un RGC singolo essere etichettati. Il numero di casi di successo può essere aumentato iniettando il DNA in più posizioni di un occhio o iniettando plasmidi codifica diversa proteine fluorescenti in ciascun occhio.
5. Rappresentante Risultati
RGC etichettatura è stata osservata a tutte le età, che vanno dalla P2 alla P25, con etichettatura EGFP in RGCs da 24 ore dopo l'elettroporazione e mantenuto espressione per almeno tre settimane dopo la trasfezione.
Dendriti fluorescente (Figura 1A, B) e pergole assonale (Figura 1F) di RGCs singoli possono essere visualizzati in modo chiaro e ricostruito.
Oltre a RGCs, questa tecnica può essere usata per etichettare gli altri tipi di cellule retiniche come le cellule orizzontali, cellule bipolari e vari sottotipi di cellule amacrine (Figura 1C)
Questo metodo non interferire con il corso normale orario di raffinatezza mappa visiva come dimostra retinotopy normale nel SC (figura 1E).
A tutte le età, in circa il 90% dei casi, una iniezione di piccolo volume (~ 2,3 4.6nL) di pCAG-gapEGFP portato ad espressione in una RGCs pochi (Figura 1D).
In circa il 15% delle prove utilizzando una singola iniezione di pCAG-Cre e pCAG-LNL-gapEGFP plasmidi combinazione per animale, ha portato alla singola etichettatura dei neuroni della retina compresa RGCs (Figura 1A, B, D) e altri tipi di cellule, come amacrine cellule (Figura 1C).
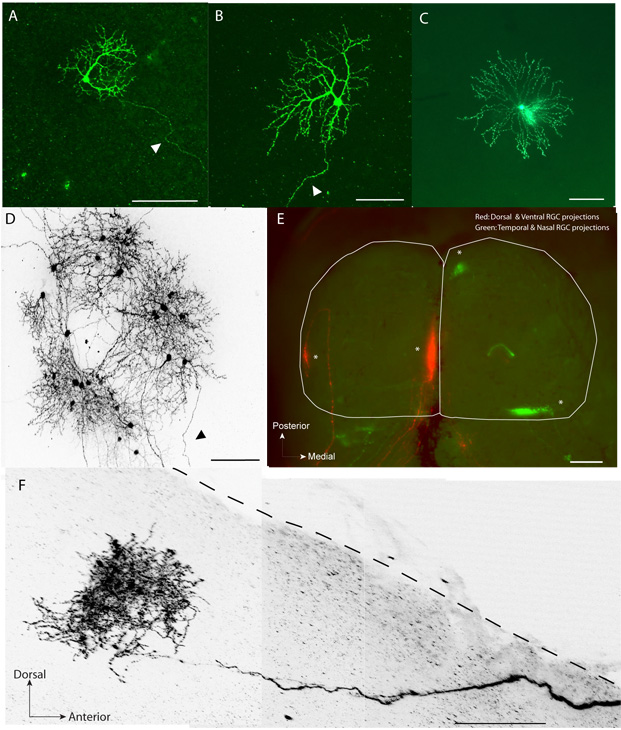
Figura 1 - A, B. Esempi di EGFP etichettati singole cellule gangliari della retina (testa di freccia che punta a assone) in un appartamento-mount retina a livello post-natale giorno 14 (P14) C. Esempio di singole cellule amacrine starburst a P8 D.. . Un gruppo di EGFP neuroni della retina etichettati compresi RGCs e le cellule amacrine in un appartamento-mount retina nella P14. RGCs E. dorsale e ventrale nell'occhio destro erano elettroporate ed etichettato con EGFP e RGCs temporale e ventrale nell'occhio sinistro sono stati elettrolitica e etichettati con tdTomato in P1. Le zone di destinazione (asterischi) formata dalla RGCs etichettati possono essere visti nella loro posizione topograficamente corretta nel SC a P9 (intero-mount, contorno bianco). Esempio F. di una singola etichetta EGFP RGC pergolato (2-D di proiezione) in una sezione sagittale (250 micron di spessore) della SC (linea tratteggiata). Per chiarezza, le immagini in (D) e (F) sono stati convertiti in scala di grigi e invertita. Barre di scala (micron): (A) - (D), (F): 100; (E): 500
Discussione
In questo video ci mostrano un protocollo di elettroporazione in vivo che si traduce in etichettatura dei singoli cluster o piccolo di neuroni della retina nei topi postnatale con costrutti di DNA codifica proteine fluorescenti. Piccoli gruppi di fluorescente proiezioni RGC al dLGN e SC riprodotti schemi di proiezione simile a quello degli studi precedenti utilizzando l'etichettatura RGC con coloranti lipofilici, indicando che elettroporazione non interferire con le normali raffinatezza RGC assone per...
Divulgazioni
Riconoscimenti
Il pCAG-gapEGFP plasmide era un dono dal Dott. S. McConnell (Stanford, CA). pCAG-tdTomato plasmide è stato un dono di Feller Dr. M. (Berkeley, CA). Ringraziamo il Dr. Edward Ruthazer per aver suggerito l'utilizzo di due plasmide strategia per l'etichettatura singola cellula e Anne Schohl (Montreal, QC) per la validazione dei due plasmide Cre / loxP strategia in studi pilota e membri laboratorio Crair per il supporto tecnico. Supportato da R01 MH62639 (MC), NIH R01 EY015788 (MC) e NIH P30 EY000785 (MC).
Materiali
| Name | Company | Catalog Number | Comments |
| Materiale | Azienda | Numero di catalogo | |
|---|---|---|---|
| Dumont # 5 Pinze | Strumenti Scienza multa | 11252-20 | |
| Stimolatore elettrico | Erba Instruments | Modello S4 | |
| Oscilloscopio | Agilent | Modello 54621A | |
| Monitor audio | Erba Instruments | Modello AM8B | |
| Puller | Sutter Instruments | Modello P-97 | |
| Vännäs Forbici uno | Mondo Strumenti di precisione | 14003 | |
| Micro forbici b | Ted Pella | 1347 | |
| Dumont AA Pinza c | Strumenti Scienza multa | 11210-20 | |
| Nanoinject II Sistema | Drummond scientifico | 3-000-204 | |
| Pipette di vetro | Drummond scientifico | 3-000-203-G / X | |
| Pedale | Drummond scientifico | 3-000-026 | |
| Olio minerale | Sigma-Aldrich | M3516 | |
| Dii | Invitrogen | D-383 | |
| N, N-Dimetilformammide | Sigma | D4551 |
Riferimenti
- Huberman, A. D., Feller, M. B., Chapman, B. Mechanisms underlying development of visual maps and receptive fields. Annu Rev Neurosci. 31, 479-509 (2008).
- McLaughlin, T., Torborg, C. L., Feller, M. B., O'Leary, D. D. Retinotopic map refinement requires spontaneous retinal waves during a brief critical period of development. Neuron. 40, 1147-1160 (2003).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinogeniculate and retinocollicular projections in the mouse. J Comp Neurol. 230, 552-575 (1984).
- Jaubert-Miazza, L. Structural and functional composition of the developing retinogeniculate pathway in the mouse. Vis Neurosci. 22, 661-676 (2005).
- Garcia-Frigola, C., Carreres, M. I., Vegar, C., Herrera, E. Gene delivery into mouse retinal ganglion cells by in utero electroporation. BMC Dev Biol. 7, 103-103 (2007).
- Matsuda, T., Cepko, C. L. Analysis of gene function in the retina. Methods Mol Biol. 423, 259-278 (2008).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. J Vis Exp. , (2009).
- Ishikawa, H. Effect of GDNF gene transfer into axotomized retinal ganglion cells using in vivo electroporation with a contact lens-type electrode. Gene Ther. 12, 289-298 (2005).
- Hewapathirane, D. S., Haas, K. Single cell electroporation in vivo within the intact developing brain. J Vis Exp. , (2008).
- Ruthazer, E. S., Haas, K., Javaherian, A., Jensen, K., Sin, W. C., Cline, H. T., Yuste, R., Konnerth, A. In vivo time- lapse imaging of neuronal development. Imaging in Neuroscience and Development: A Laboratory Manual. , 191-204 .
- Kachi, S., Oshima, Y., Esumi, N., Kachi, M., Rogers, B., Zack, D. J., Campochiaro, P. A. Nonviral ocular gene transfer. Gene Ther. 12, 843-851 (2005).
- Okada, A., Lansford, R., Weimann, J. M., Fraser, S. E., McConnell, S. K. Imaging cells in the developing nervous system with retrovirus expressing modified green fluorescent protein. Exp Neurol. 156, 394-406 (1999).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104, 1027-1032 (2007).
- Plas, D. T. morphogenetic proteins, eye patterning, and retinocollicular map formation in the mouse. J Neurosci. 28, 7057-7067 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon