È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Generazione di cellule staminali neurali da scartate tessuto fetale umano corticale
In questo articolo
Riepilogo
Un metodo semplice e affidabile sulle isolamento e la coltura di cellule staminali neurali da scartati tessuto fetale umano corticale è descritto. Culture derivati da noti disturbi neurologici umano può essere utilizzato per la caratterizzazione di processi patologici cellulari e molecolari, oltre a fornire una piattaforma per valutare l'efficacia farmacologica.
Abstract
Cellule staminali neurali (NSC) risiedono lungo il neuroepitelio zona ventricolare durante lo sviluppo della placca corticale. Questi primi progenitori in ultima analisi, dare origine a cellule progenitrici intermedi e più tardi, i diversi sottotipi di cellule neuronali e gliali che formano la corteccia cerebrale. La capacità di generare e ampliare NSCs umano (la cosiddetta neurosfere) da scartati tessuto normale fetale fornisce un mezzo con cui studiare direttamente gli aspetti funzionali di sviluppo umano normale NSC 1-5. Questo approccio può anche essere diretto verso la generazione di NSCs da disturbi neurologici conosciuti, offrendo così l'opportunità di identificare i processi di malattia che altera la proliferazione progenitrici, la migrazione e la differenziazione 6-9. Ci siamo concentrati sull'identificazione dei meccanismi patologici umani NSCs sindrome di Down che possa contribuire al fenotipo malattia accelerata di Alzheimer 10,11. Né in vivo e in vitro modelli murini in grado di replicare il repertorio identiche di geni localizzati sul cromosoma umano 21.
Qui usiamo un metodo semplice e affidabile per isolare da sindrome di Down NSCs abortiti corteccia fetale umano e farle crescere in coltura. La metodologia prevede aspetti specifici di raccolta del, dissezione dei tessuti con reperi anatomici limitata, separazione delle cellule, placcatura e passaging di NSC umano. Forniamo anche alcuni protocolli di base per indurre la differenziazione di NSC umano in sottotipi di cellule più selettivi.
Protocollo
1. Preparazione di soluzioni e materiali per la dissezione e la conservazione della cultura di cellule staminali neurali
- Preparare 100 ml di media dissezione (KNOCKOUT DMEM/F12, Invitogen) in anticipo e conservare in frigorifero.
- Prepare100 ml di terreno di coltura (Stem Pro NSC SFM, Invitrogen) e tenere a 37 ° C a bagnomaria.
- Preparare il congelamento delle cellule-media (KNOCKOUT DMEM/F12 +10% FBS + 5% DMSO) a lungo termine crioconservazione delle cellule.
- Se lo si desidera, preparare il 4% paraformaldeide (PFA) per il fissaggio del tessuto.
- Sterili, pinze e lame bisturi in autoclave con maniglie vengono utilizzati per la dissezione.
- Mettere da parte una pistola pipetta, 10 ml di pipette di trasferimento, e 40 filtro cellule mM (BD Falcon 352.340) per la dissociazione.
- Mettere da parte 10 piatti diversi cultura cm (BD) per la dissezione, 50 provette ml (BD) per la dissociazione, 1,5 ml, provette per la conservazione dei tessuti e fiale congelate (BD) per celle di congelamento.
2. Isolare cellule staminali neurali dal cervello fetale umano
- La raccolta di tessuti vitali immediatamente dopo la cessazione del feto è vitale per il successo della procedura. Per le procedure elettive, i tempi per ottenere i campioni possono essere organizzati in anticipo in modo da ridurre al minimo il tempo dopo la morte del feto. I prodotti del concepimento sono raccolti nella procedura a 2 colonne ore, ma idealmente può essere realizzato su procedure elettive in pochi minuti. I tessuti fetali sono spesso frammentati. Tuttavia, in generale, una significativa porzione del cervello rimane intatto per l'identificazione visiva. Limiti di età gestazionale (GA) sono determinate dalla legge scritta, ma sono state effettuate utilizzando questo protocollo tra 18-22 settimane GA.
- Cervello fetale è posto in un piatto da 10 ml Petri contenenti ghiacciata KNOCKOUT DMEM/F12 soluzione. Identificare le diverse parti della corteccia da punti di repere anatomici. Confini per la corteccia frontale e parieto-occipitale sono orientate dall'intersezione estrapolati del solco centrale e fessura Sylvian. Sezionare il tessuto dalla corteccia frontale anteriore al solco centrale e lungo il bordo della fessura silviana con lame chirurgiche, evitando di mettere il ventricolo integro e non danneggiato.
- Rimuovere eventuali residui di sangue e meningi dal blocco separato della corteccia frontale. Se il campione è di qualità sufficiente, è ideale per sezionare il blocco in diversi campioni più piccole per vari scopi: sezioni (fissate in 4% paraformaldeide, PFA) e di proteine / mRNA test (veloce congelati in -80 ° C).
- Trasferire il blocco selezionato cervello in una provetta da centrifuga da 50 ml e aggiungere ghiacciata KNOCKOUT DMEM/F12 soluzione a circa 3 volte il volume del tessuto. Delicatamente dissociare il tessuto pipettando meccanico con una pipetta 10 ml di trasferimento fino a che tutti i tessuti diventa frammentata (generalmente 20-30 volte), e quindi filtrare le cellule attraverso una cella di 40 micron filtro (BD Falcon 352340) per ottenere uno o vicino a singola cella sospensione.
- Centrifugare la sospensione cellulare a 2000 giri e la temperatura ambiente per 5 minuti, risospendere il pellet cellulare in 10 ml di terreno fresco cultura caldo (Stem Pro NSC SFM), e contare il numero di cellule con un emocitometro.
- Aggiungere 5 ml di mezzo di coltura caldo in ogni cm 25 2 fiasche cultura, e il trasferimento 2X10 6 celle ad ogni pallone. Le culture sono mantenuti a 37 ° C / 5% CO 2 incubatore per 1 settimana prima dell'analisi. Cambia la metà della media una volta alla settimana per le culture più o esperimenti.
3. Manipulaton di cellule staminali neurali per la caratterizzazione ulteriore o sperimentazioni
- Neurosfere di solito forma in 1 o 2 settimane in condizioni di coltura NSC raccomandata con diametro compreso tra 200 e 400 micron. Neurosfere in questa fase può essere dissociata con 0,2 g / L di EDTA di calcio e magnesio libero Hanks medio (Hanks) a 37 ° C per 15 minuti per ottenere cellule singole. Sospensione le cellule sono filata a 2000 giri al minuto, sciacquate in acqua dolce Hanks, e saltuariamente nel terreno di coltura caldo per sottocultura.
- Per avviare la differenziazione, le cellule dissociate sono placcati in poly-D-lysine/laminin 1 vetrini rivestiti con una densità di 1x10 5 cellule per vetrino (24mmX24mm). Differenziazione degli oligodendrociti si ottiene mantenendo le cellule in KNOCKOUT DMEM/F12 (Invitrogen, Main, MD) +2% B27 (50X, Invitrogen, Main, MD) +10 ng / ml bFGF 100 ng / ml SHH + 10ng/ml di PDGF-AA 2 giorni, poi il passaggio al mezzo stesso, senza fattori di crescita per altri 5 giorni. Differenziamento neuronale è ottenuto da cellule mantenendo in KNOCKOUT DMEM/F12 +2% B27 (50X) per 7 giorni. Differenziazione astrociti è fatto da cellule in coltura KNOCKOUT DMEM/F12 +1% FBS per una settimana.
- Trasfezione delle cellule staminali neurali con i geni può essere fatto con cellule dissociate dalla neurosfere preformate. Qui, abbiamo dimostrato che le cellule staminali neuronali transfettate con EGFP-C1 mediante elettroporazione. L'elettroporazione di EGFP-C1 costruire è stato fatto usando AMAXA Kit Nucleofector per cellule staminali neurali del mouse (VPG-1004) con dispositivo AMAXA Nucleofector (Lonza DAA-1001), a seguito di istruzione della società. In breve, 5 mg di DNA con 1 x 10 6 cellule sono state mescolate con 100 microlitri di media transfezione, e dopo l'elettroporazione di impulsi, le cellule sono state risospese in cellule staminali neurali mantenendo media per la cultura ulteriormente. La differenziazione delle cellule transfettate sono stati trattati con la dissociazione di giorni neurosfere dopo 3-4 l'elettroporazione, seguendo le stesse procedure descritte al punto 3.2.
4. Congelamento delle cellule staminali neurali e sottoculture
- Sospensioni cellulari dissociate sono centrifugate e risospese in medium di congelamento con una concentrazione di 1x10 7 cellule / flacone / ml. Lentamente congelare le cellule in -20 ° C, -80 ° C, poi il trasferimento a azoto liquido per la conservazione a lungo.
- Le cellule sono veloci scongelati con 37 ° C bagnomaria e risospese in riscaldato DMEM/F12 +10% siero per un lavaggio, centrifugato per rimuovere il supporto di congelamento, e risospeso nel terreno di coltura riscaldato.
5. Rappresentante dei risultati:
Cellule staminali neurali da un feto normale a 18 settimane di età gestazionale sono stati coltivati secondo i metodi descritti e neurosfere si può vedere dopo una settimana con il turno, bordi lisci e le dimensioni abbastanza omogeneo (Fig.2a). Questi neurosfere possono essere transfettate con EGFP-C1 o altri costrutti e seguita al microscopio a fluorescenza (Fig.2b,). Fondata neurosfere sono state poi dissociato con EDTA e placcato come cellule disperse su vetrini rivestiti. Cellule differenziate secondo i protocolli sono stati fissati rispettivamente con il 4% parafamaldehyde, e colorati con marcatori diversi tipi cellulari specifici. Multipotenzialità si osserva con l'espressione di marcatori indicativi di neuroni (Fig2C, D, rodamina) astrociti (Fig2E, F, rodamina) e gli oligodendrociti (Fig2G, H, rodamina). Le cellule non subito elettroporazione di EGFP sono state differenziate in diversi tipi di cellule e colorati con differenti marcatori cellulari specifici. Multipotenzialità si osserva con l'espressione di marcatori indicativi di neuroni (Fig3A, B, fluoroscein) astrociti (Fig3C, rodamina e Fig3D, fluoroscein) e gli oligodendrociti (Fig3E, F, rodamina).
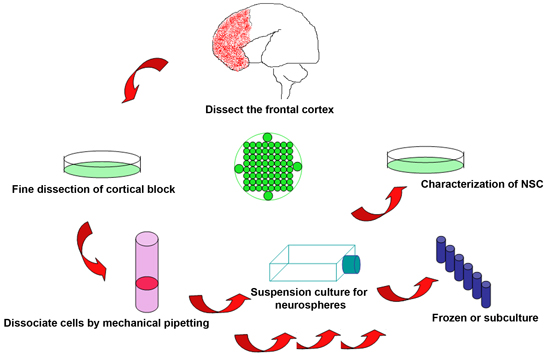
Figura 1. Schematica della procedura sperimentale per isolare le cellule staminali neurali da scartati cervello fetale umano

Figura 2. Cellule umane indifferenziate e differenziate propogated neurali in vitro. (A) neurosfere sono mostrati al microscopio a contrasto di fase dimostrare lisce, i bordi rotondi e una rapida crescita dopo la cultura per oltre 1 settimana. (B) Introduzione di plasmidi diversi e costruisce può essere raggiunto attraverso trasfezione. Tre giorni dopo EGFP-C1 transfezione, le cellule mostrano più espressione della proteina fluorescente verde come si è visto sotto immunocolorazione fluoroscein e microscopia a fluorescenza. EGFP-C1 neurosfere transfettate sono dissociate e differenziati in diverse condizioni in neuroni (C, D), gli astrociti (E, F) e gli oligodendrociti (G, H) e visto sotto fluorescenza rodamina. Allo stesso tempo, transfettate cellule EGFP positivi sono indicati sotto fluoroscein fluorescenza. Cellule transfettate (teste di freccia bianca) sono indistinguibili dalle cellule untransfected (frecce bianche). I nuclei delle cellule sono colorate con Hoechst33342. Barre di scala sono 200 micron per A, B per 100 micron e 25 micron per CH.
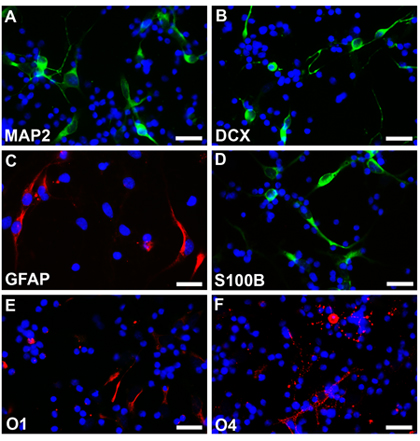
Figura 3. Neurosfere senza trasfezione sono dissociata e differenziata in diverse condizioni in neuroni (A, B, fluoroscein), gli astrociti (C, rodamina, D, fluoroscein) e gli oligodendrociti (E, F, rodamina). I nuclei delle cellule sono colorate con Hoechst33342. Barre di scala sono 25 micron per AF.
Access restricted. Please log in or start a trial to view this content.
Discussione
Ci sono vari approcci verso la cultura del tessuto fresco e la produzione di linee cellulari umane. Storicamente, tessuto fresco è stato raccolto e colto immediatamente di generare vari tipi di cellule del sistema nervoso centrale. Questo approccio però è chiaramente limitata dal numero di campioni che possono essere ottenuti, che nel caso di campioni umani, di solito è abbastanza piccolo. Dato il grado minimo di manipolazione, le cellule neuronali in coltura fresco fornire il sistema più affidabile sperimentale, l...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Riconoscimenti
Questo lavoro è stato sostenuto in parte dal National Institutes of Health: HD054347 e NS063997-01 per VLS. Questo lavoro è stato sostenuto in parte dal Fondo sulle cellule staminali attraverso l'Empire State di New York State Department del Contratto Sanità # C024324 di VLS. Le opinioni qui espresse sono esclusivamente quelle dell'autore e non riflette necessariamente il parere del Consiglio di cellule staminali Empire State Building, il New York State Department of Health, o lo Stato di New York. VLS è un Doris Duke Clinical Scientist Award Recipient sviluppo. Ringraziamo anche il professor Timothy Vartanian per il dono di Anti-O1, Anti-O4 anticorpi.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| KNOCKOUT DMEM/F12 | Invitrogen | 12660-012 | Dissociazione media |
| Staminali Pro NSC SFM | Invitrogen | A10509-01 | Terreno di coltura |
| Siero bovino fetale | Invitrogen | 10091-148 | Medio congelati |
| Hanks soluzione (-Ca 2 +, Mg-2 +) | Invitrogen | 14175-095 | Dissociazione media |
| DMSO | Sigma-Aldrich | D2650 | Medio congelati |
| EDTA | Sigma-Aldrich | 431788 | Dissociazione media |
| Paraformaldeide | Sigma-Aldrich | 158127 | Fissazione soluzione |
| bFGF | R & S | 234-FSE | Differenziazione media |
| SHH | R & S | 1845-SH | Differenziazione media |
| PDGF-AA | R & S | 221-AA | Differenziazione media |
| B27 | Invitrogen | 17504-044 | Differenziazione media |
| Mouse Anti-MAP2 | Sigma-Aldrich | M2320 | 1:200 |
| Coniglio anti-DCX | Segnalazione cellulare | 4604s | 1:200 |
| Coniglio anti-GFAP | DAKO | Z0334 | 1:200 |
| Coniglio anti-S100B | DAKO | Z0311 | 1:200 |
| Coniglio anti-O1 | doni del professor Timothy Vartanian * | 01:50 | |
| Coniglio anti-O4 | Regali del professor Timothy Vartanian * | 01:50 | |
| 40μm cellule filtro | BD Falcon | 352340 |
* Timothy Vartanian, MD, PhD, Dipartimento di Neurologia e Neuroscienze, Weill Cornell Medical College, New York, USA
Riferimenti
- Gage, F. H., Ray, J., Fisher, L. J. Isolation, characterization, and use of stem cells from the CNS. Annu. Rev. Neurosci. 18, 159-192 (1995).
- Vescovi, A. L., Snyder, E. Y. Establishment and properties of neural stem cell clones: plasticity in vitro and in vivo. Brain Pathol. 9, 569-598 (1999).
- Schwartz, P., Bryant, P., Fuja, T., Su, H., O'Dowd, D., Klassen, H. Isolation and characterization of neural progenitor cells from post-mortem human cortex. J Neurosci Res. 74, 838-851 (2003).
- Martinez-Serrano, A., Rubio, F. J., Navarro, B., Bueno, C., Villa, A. Human neural stem and progenitor cells: in vitro and in vivo properties, and potential for gene therapy and cell replacement in the CNS. Curr Gene Ther. 1, 279-299 (2001).
- Rajan, P., Snyder, E. Neural stem cells and their manipulation. Methods Enzymol. 419, 23-52 (2006).
- Ruiz-Lozano, P., Rajan, P. Stem cells as in vitro models of disease. Curr Stem Cell Res Ther. 2, 280-292 (2007).
- Sheen, V., Ferland, R., Harney, M., Hill, R., Neal, J., Banham, A., Brown, P., Chenn, A., Corbo, J., Hecht, J., Folkerth, R., Walsh, C. Impaired proliferation and migration in human Miller-Dieker neural precursors. Ann Neurol. 60, 137-144 (2006).
- Bahn, S., Mimmack, M., Ryan, M., Caldwell, M., Jauniaux, E., Starkey, M., Svendsen, C., Emson, P. Neuronal target genes of the neuron-restrictive silencer factor in neurospheres derived from fetuses with Down's syndrome: a gene expression study. Lancet. 359, 310-315 (2002).
- Ferland, R. J., Batiz, L. F., Neal, J., Lian, G., Bundock, E., Lu, J., Hsiao, Y. C., Diamond, R., Mei, D., Banham, A. H. Disruption of neural progenitors along the ventricular and subventricular zones in periventricular heterotopia. Hum Mol Genet. 18, 497-516 (2009).
- Esposito, G., Imitola, J., Lu, J., De Filippis, D., Scuderi, C., Ganesh, V. S., Folkerth, R., Hecht, J., Shin, S., Iuvone, T., Chesnut, J., Steardo, L., Sheen, V. Genomic and functional profiling of human Down syndrome neural progenitors implicates S100B and aquaporin 4 in cell injury. Hum Mol Genet. 17, 440-457 (2008).
- Esposito, G., Scuderi, C., Lu, J., Savani, C., De Filippis, D., Iuvone, T., Steardo, L. J. r, Sheen, V., Steardo, L. S100B induces tau protein hyperphosphorylation via Dickopff-1 up-regulation and disrupts the Wnt pathway in human neural stem cells. J Cell Mol Med. 12, 914-927 (2008).
- Flax, J. D., Aurora, S., Yang, C., Simonin, C., Wills, A. M., Billinghurst, L. L., Jendoubi, M., Sidman, R. L., Wolfe, J. H., Kim, S. U., Snyder, E. Y. Engraftable human neural stem cells respond to developmental cues, replace neurons, and express foreign genes. Nat Biotechnol. 16, 1033-1039 (1998).
- Fults, D., Pedone, C. A., Morse, H. G., Rose, J. W., McKay, R. D. Establishment and characterization of a human primitive neuroectodermal tumor cell line from the cerebral hemisphere. J Neuropathol Exp Neurol. 51, 272-280 (1992).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities? Nat Rev Neurosci. 11, 176-187 (2010).
- Svendsen, C. N., ter Borg, M. G., Armstrong, R. J., Rosser, A. E., Chandran, S., Ostenfeld, T., Caldwell, M. A. A new method for the rapid and long term growth of human neural precursor cells. J Neurosci Methods. 85, 141-152 (1998).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon