Method Article
Determinazione della mitocondriale Oxygen Species potenziale di membrana e reattiva in neuroni corticali di ratto dal vivo
In questo articolo
Riepilogo
Dimostriamo applicazione del indicatore di fluorescenza, TMRM, nei neuroni corticali per determinare le variazioni relative a TMRM intensità di fluorescenza, prima e dopo l'applicazione di uno stimolo specifico. Mostriamo anche l'applicazione della sonda di fluorescenza H 2 DCF-DA per valutare il livello relativo di specie reattive dell'ossigeno nei neuroni corticali.
Abstract
Potenziale di membrana mitocondriale (ΔΨm) è fondamentale per il mantenimento della funzione fisiologica della catena respiratoria per generare ATP. Una perdita significativa di cellule ΔΨm rende impoverito di energia con conseguente morte. Specie reattive dell'ossigeno (ROS) sono importanti molecole di segnalazione, ma il loro accumulo in condizioni patologiche porta allo stress ossidativo. Le due principali fonti di ROS nelle cellule sono tossine ambientali e il processo di fosforilazione ossidativa. Disfunzione mitocondriale e lo stress ossidativo sono stati coinvolti nella fisiopatologia di molte malattie, quindi, la possibilità di determinare ΔΨm ROS e può fornire indizi importanti circa lo stato fisiologico della cellula e la funzione dei mitocondri.
Diverse sonde fluorescenti (rodamina 123, TMRM, TMRE, JC-1) può essere utilizzato per determinare Δψm in una varietà di tipi di cellule, e molti indicatori di fluorescenza (Dihydroethidium, diidrorodamina 123, H 2 DCF-DA) può essere usato per determinare ROS . Quasi tutte le sonde a fluorescenza a disposizione per valutare ΔΨm o ROS sono singola lunghezza d'onda indicatori, che aumentano o diminuiscono la loro intensità di fluorescenza proporzionale a uno stimolo che aumenta o diminuisce i livelli di ΔΨm o ROS. Quindi, è indispensabile per misurare l'intensità di fluorescenza di queste sonde a livello basale e dopo l'applicazione di uno stimolo specifico. Questo permette di determinare la percentuale di variazione di intensità di fluorescenza tra il livello base e uno stimolo. Questo cambiamento di intensità di fluorescenza riflette la variazione dei livelli relativi di ΔΨm o ROS. In questo video ci dimostra come applicare l'indicatore di fluorescenza, TMRM, in neuroni corticali di ratto per determinare la variazione percentuale TMRM intensità di fluorescenza tra il livello basale e dopo l'applicazione FCCP, un disaccoppiatore mitocondriale. I livelli più bassi di TMRM fluorescenza risultante dal trattamento FCCP riflettono la depolarizzazione del potenziale della membrana mitocondriale. Mostriamo anche come applicare la fluorescenza della sonda H 2 DCF-DA per valutare il livello di ROS in neuroni corticali, prima in condizioni basali e dopo l'applicazione di H 2 O 2. Questo protocollo (con piccole modifiche) può essere utilizzato anche per determinare le variazioni ΔΨm e ROS in diversi tipi di cellule e nei neuroni isolati da altre regioni del cervello.
Protocollo
1. Coltura cellulare
- Neuroni corticali sono isolate e coltivate utilizzando tecniche precedentemente descritte e placcato in capsule di Petri con fondo di vetro (MatTek Corporation, Ashland, MA) rivestito con poli-D-lisina e laminina 1.
2. Preparare le soluzioni per il magazzino sonde fluorescenti TMRM e H 2 DCF-DA
- Preparare un 10-mM soluzione madre di TMRM sciogliendo 5,0 mg di TMRM in 1 ml di dimetilsulfossido anidro. Vortex è per 1 min. Poi, fare aliquote e conservarle a -20 ° C, proteggere dalla luce, e utilizzare entro un mese.
- Successivamente, preparare un 10-mM soluzione madre di H 2 DCF-DA, sciogliendo 4,87 mg di H 2 DCF-DA in 1 ml di DMSO anidro. Allo stesso modo, vortice che per 1 min. Poi, fare aliquote e conservarle a -20 ° C, proteggere dalla luce, e utilizzare entro una settimana.
3. Neuroni corticali di ratto di carico con TMRM e H 2 DCF-DA
TMRM è un potenziometro, cellula-permeabile indicatore fluorescente che si accumula al suo interno una forte carica negativa dei mitocondri. E 'importante utilizzare le concentrazioni basse (10-50 nm) di TMRM per evitare l'auto-spegnimento del TMRM mitocondriale. Poi, il segnale di fluorescenza di TMRM possono essere direttamente legati alla co-ΔΨm attraverso la membrana mitocondriale interna. Una perdita di ΔΨm cause TMRM a fuoriuscire dai mitocondri con conseguente perdita di intensità di fluorescenza. H 2 DCF-DA è la cellula-permeabile sonda convertito in DCF-DA dalle esterasi intracellulari, ei suoi risultati ossidazione DCF fluorescente. La concentrazione finale di H 2 DCF-DA varia tra 2-10 micron e dovrebbe essere testato empiricamente nei neuroni derivati da differenti regioni del cervello in quanto le concentrazioni di carico elevato potrebbe provocare la saturazione del DCF fluorescenza anche in assenza di H 2 O 2. La presenza di ossidanti endogeni o esogeni (ad esempio, di ossido nitrico, perossido di idrogeno) aumenterà DFC intensità di fluorescenza. Di seguito, forniamo un protocollo per il caricamento di neuroni corticali di ratto con TMRM e H 2 DCF-DA.
- Per caricare i neuroni di ratto corticali con TMRM, in primo luogo, lavare i neuroni coltivati 3 volte con tampone Tyrode di (Overlay Testo: TB: 145 mM NaCl, 5 mM KCl, 10 glucosio mm, 1,5 mm CaCl 2, 1 mM MgCl 2, e 10 HEPES mM; aggiustare il pH a 7,4 con NaOH). Poi, preparare 20 Nm di TMRM diluendo i 10 magazzino mM TMRM 1 / 1000 volte in TB e poi aggiungere 2 ml di TMRM diluito per 1 ml di TB. Incubare i neuroni con TMRM per 45 minuti al buio a temperatura ambiente. Dopo 45 minuti, montare il piatto cultura sul palcoscenico del microscopio e iniziare imaging.
- Per caricare i neuroni corticali di ratto con H 2 DCF-DA, lavare i neuroni in coltura 3 volte con TB. Quindi, preparare 2 mM di H 2 DCF-DA diluendo i 10 mm H 2 DCF-DA magazzino 1 / 10 volte in TB e poi aggiungere 2 ml di diluito H 2 DCF-DA per 1 ml di TB. Poi, incubare i neuroni con H 2 DCF-DA per 45 minuti al buio a temperatura ambiente. Dopo 45 minuti, lavare i neuroni 4 volte con TB per rimuovere l'eccesso indicatore fluorescente prima di ottenere le immagini.
4. Vivere l'imaging di neuroni incubate con TMRM per determinare ΔΨm
- Per eseguire l'imaging dal vivo di neuroni incubate con TMRM, microscopia confocale a scansione laser (Overlay Testo: LSM 510, Carl Zeiss Inc.), con l'applicazione di vivere serie temporali programma, viene utilizzato. Applicare a bassa risoluzione e attenuato laser di potenza (Overlay Testo: bassa risoluzione: 256 x 256, potenza laser: 1%) per ridurre al minimo il tempo necessario per ottenere immagini ed evitare photobleaching.
- . Successivamente, regolare la messa a fuoco dei neuroni montato caricato con TMRM usando la luce riflessa. Esaminare la fluorescenza TMRM di illuminazione a 514 nm e la rilevazione a 570 nm. Impostare il guadagno di rilevamento di una macchina fotografica appena sotto il livello di saturazione.
- Una volta che tutti i parametri che includono la risoluzione, potenza del laser, ottenere il rilevamento di una macchina fotografica, e time-lapse intervallo di ottenere immagini sono serie: non modificare queste impostazioni tra esperimenti. Successivamente, modificare il campo. Iniziare a raccogliere le immagini.
- Per verificare i cambiamenti in ΔΨm, stimoli come 1 microM di FCCP o 2 mg / ml di oligomicina, può essere applicato, causando notevoli depolarizzare o hyperpolarize il potenziale della membrana mitocondriale, rispettivamente. Questi cambiamenti si rifletteranno da una diminuzione dell'intensità TMRM fluorescenza rispetto con l'intensità di fluorescenza di base in caso di FCCP, o un aumento di intensità TMRM fluorescenza in caso di oligomicina.
5. Immagini dal vivo di neuroni incubate con H 2 DCF-DA per determinare ROS
- Per eseguire l'imaging dal vivo di neuroni incubate con H 2 DCF-DA, in primo luogo, montare il piatto cultura sul palcoscenico di un microscopio. Regolare il fuoco delle cellule noiING luce riflessa. Esaminare DCF fluorescenza da eccitazione a 488 nm ed emissione a 515 nm.
- Quindi, regolare la potenza del laser al 5-7%, il guadagno del rivelatore e risoluzione di 256 x 256. Non modificare queste impostazioni tra esperimenti. Quindi, impostare la frequenza per ottenere le immagini in diretta con il programma di serie temporali.
- Selezionare un campo nuovo e iniziare l'acquisizione di immagini. Per rilevare i cambiamenti nei livelli di ROS, il trattamento di cellule con 100-200 mM di H 2 O 2. Questo sarà tradursi in un aumento di intensità DCF fluorescenza rispetto al livello di base.
6. Analisi dei dati
- Usa regione di interesse (Overlay Testo: ROI) strumento dal programma LSM per selezionare le aree. Poi, misurare la TMRM o ROS intensità di fluorescenza. Seleziona ROI dalle regioni mitocondriale o ROI dal corpo cellulare nelle cellule intero fotografato per misurare l'intensità di fluorescenza di TMRM o ROS, rispettivamente.
- Calcolare l'intensità media di fluorescenza da tutte le ROI di ogni cella per TMRM o da corpi cellulari intero per tutte le cellule ripreso per ROS per ogni punto del tempo. Selezionare le regioni accanto alle cellule per calcolare l'intensità di fluorescenza di fondo. Prendere le misure diversi e calcolare l'intensità media di fondo.
- Sottrarre la media intensità di fluorescenza di fondo dalla media intensità di fluorescenza di ROI in ciascuna cella per ogni punto di tempo utilizzando Microsoft Excel. Dopo aver sottratto l'intensità di fondo, normalizzare l'intensità di fluorescenza TMRM o DCF per la fluorescenza di base utilizzando questa formula (Overlay Testo: ΔF = FF o / o F x 100, dove F = intensità della fluorescenza in un punto qualsiasi momento, Per = baseline fluorescenza). Quindi, utilizzare il programma Sigma Plot per generare la trama che mostra le variazioni di intensità di fluorescenza nel tempo.
7. Rappresentante Risultati
La figura 1A mostra una immagine di fluorescenza di neuroni corticali di ratto incubate con TMRM. L'aggiunta di FCCP, un disaccoppiatore mitocondriale, porta alla depolarizzazione mitocondriale e una perdita di intensità di fluorescenza TMRM (Fig. 1B). La linea di base a livello di fluorescenza TMRM rimane stabile prima dell'aggiunta FCCP (i primi 350 secondi;. Fig. 1C). Analisi quantitativa di fluorescenza TMRM cambiamenti nel tempo mostra una significativa diminuzione della fluorescenza TMRM dopo l'aggiunta di FCCP (Fig. 1C).
1D figura mostra l'immagine di fluorescenza di topo neuroni corticali caricato con DCF. L'aggiunta di H 2 O 2 si traduce in un aumento dell'intensità della fluorescenza DCF in corpi cellulari (Fig. 1E). Il livello di base DCF fluorescenza è invariato (i primi 120 secondi) prima dell'applicazione di H 2 O 2. Time-lapse misure di fluorescenza DCF mostrare i suoi livelli costanti, che aumentano dopo H 2 O 2 terapia (Fig. 1F).
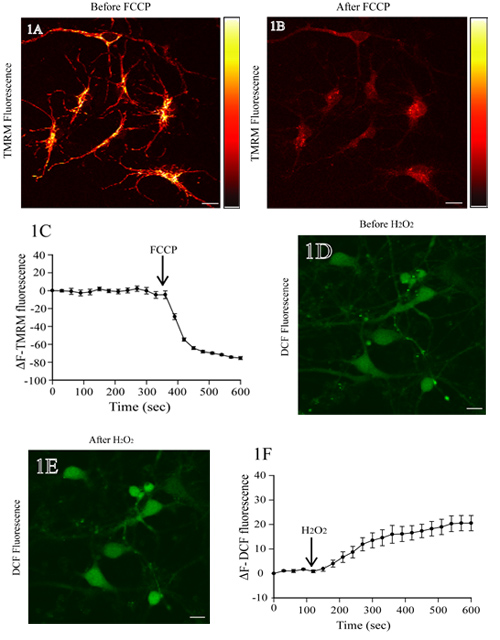
Figura 1. Valutazione del potenziale della membrana mitocondriale e dei livelli di ROS in neuroni corticali di ratto dal vivo. (A) Rappresentante immagine di fluorescenza di neuroni corticali caricato con TMRM. Dopo la scansione della linea di base TMRM fluorescenza, i neuroni sono stati trattati con il FCCP protonophore (1 mM). A destra è una barra pseudocolori intensità di fluorescenza TMRM con brillante massimo giallo e nero che rappresentano e l'intensità minima, rispettivamente. La perdita di fluorescenza TMRM dalle regioni mitocondriale indica il crollo del ΔΨm su FCCP trattamento (pannello B). La rappresentazione quantitativa del cambiamento di intensità TMRM fluorescenza in diversi momenti, prima e dopo il trattamento FCCP è mostrato nel pannello C. (D) l'immagine di fluorescenza di neuroni corticali di ratto caricato con H2DCF-DA. Dopo aver determinato la linea di base DCF fluorescenza, le cellule sono state trattate con 200 mM H 2 O 2, e la variazione del DCF fluorescenza è stata valutata. Un aumento della fluorescenza DCF riflette l'aumento dei livelli di ROS su H 2 O 2 trattamento (E). L'analisi quantitativa del cambiamento in DCF fluorescenza, prima e dopo H 2 O 2 trattamento, viene mostrato nella barra pannello F. Scala = 10 micron
Video.7.1 - labmedia 2704_Joshi.avi
Vivere l'imaging cellulare di TMRM nei neuroni corticali, prima e dopo l'aggiunta FCCP con obiettivo 40X. L'intensità pseudocolori mostra un massimo (giallo brillante, prima aggiunta FCCP) e diminuito (colore rosso, dopo l'aggiunta FCCP) intensità di fluorescenza TMRM dopo l'aggiunta FCCP. Clicca qui per visualizzare il video
Video. 7.5 - labmedia 2704_Joshi.avi
Vivere l'imaging cellulare di DCF in neuroni corticali prima e dopo H 2 O 2 oltre utilizzando obiettivo 40X. La linea di base DCF fluorescenza ha colore verde chiaro in corpi cellulari e H2O2 Inoltre aumenta la DCF intensità della fluorescenza di colore verde brillante. Clicca qui per visualizzare il video
Discussione
Abbiamo presentato un passo-passo procedura che descrive come determinare ΔΨm e ROS in neuroni corticali di ratto utilizzando la fluorescenza indicatori TMRM e H 2 DCF-DA, rispettivamente. Per altri tipi di cellule, è importante per determinare empiricamente la concentrazione finale e il tempo di caricamento per TMRM o H 2 DCF-DA. In generale, la gamma TMRM concentrazioni di 20-200 nM, e il tempo di incubazione delle cellule con TMRM varia da 20 a 60 min. La concentrazione finale di H 2 DCF-DA range 2-10 mM, e l'incubazione di cellule in soluzione tampone contenente tale indicatore varia da 30-45 min.
E 'importante per ottimizzare la potenza del laser e velocità di scansione di prendere le immagini per evitare sia foto-tossicità per le cellule e le variazioni dell'intensità di fluorescenza (ad esempio lo sfarfallio di TMRM fluorescenza), in assenza di qualsiasi stimolo. Le impostazioni ottimizzate ottico dovrebbe sfociare in un segnale di fluorescenza che non è sopra o sotto saturi (soglia) in assenza di stimolo. Le condizioni ottimali per raccogliere le immagini da un campo selezionato in una potenza del laser particolare e una velocità di scansione si ottengono quando non ci sono cambiamenti nella intensità di fluorescenza della sonda, in assenza di qualsiasi stimolo per 10-15 minuti di immagini dal vivo.
Altre sonde a fluorescenza per determinare ΔΨm comprendono rodamina 123 e tetra metilico rodamina etile (TMRE). Tuttavia, essi sono stati trovati per inibire i processi respiratori nella isolata 2 mitocondri. Importante, TMRM non ha alcun effetto sulla respirazione mitocondriale a basse concentrazioni 2 e ha fototossicità bassa e photobleaching 3 rispetto con altre sonde. H 2 DCF-DA è un buon indicatore di ROS, come è ben conservato nelle cellule e riconosce diverse specie ossidanti, come i perossidi, ossidi super, e l'ossido nitrico 4.
Divulgazioni
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institutes of Health (K22NS050137 a JCB).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
|---|---|---|---|
| Con fondo di vetro piatto cultura | MatTek Corporation | P35G-1.5-14-C | |
| NbActive4 | BrainBits | NbActive4 | |
| TMRM | Invitrogen | T668 | |
| H 2 DCF-DA | Invitrogen | C400 | |
| NaCl | Sigma | S6191 | |
| KCl | Sigma | P3911 | |
| CaCl 2 • 2H 2 O | Sigma | C3306 | |
| MgCl 2 • 6H 2 O | Sigma | M2670 | |
| D-glucosio | Sigma | G6152 | |
| HEPES | Invitrogen | 15630 |
Riferimenti
- Hilgenberg, L. G., Smith, M. A. Preparation of dissociated mouse cortical neuron cultures. J. Vis. Exp. , (2007).
- Scaduto, R. C., Grotyohann, L. W. Measurement of mitochondrial membrane potential using fluorescent rhodamine derivatives. Biophys. J. 76, 469-477 (1999).
- Ward, M. W. The amyloid precursor protein intracellular domain (AICD) disrupts actin dynamics and mitochondrial bioenergetics. J. Neurochem. 113, 275-284 (2010).
- Gunasekar, P. G., Kanthasamy, A. G., Borowitz, J. L., Isom, G. E. NMDA receptor activation produces concurrent generation of nitric oxide and reactive oxygen species: implication for cell death. J. Neurochem. 65, 2016-2021 (1995).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon