Method Article
Visualizzazione di MG53-mediata di riparazione della membrana cellulare Utilizzando In vivo E In vitro Sistemi
In questo articolo
Riepilogo
Qui descritte sono protocolli utilizzati per visualizzare il processo dinamico della MG53-mediata riparazione membrana cellulare in animali interi ed a livello cellulare. Questi metodi possono essere applicati per studiare la biologia cellulare della medesima membrana plasmatica e la medicina rigenerativa.
Abstract
Riparazione di lesioni acute alla membrana cellulare è un processo elementare di normale fisiologia cellulare e difettosa riparazione della membrana è stata collegata a molte malattie degenerative umane. La recente scoperta della MG53 come componente chiave della macchina medesima membrana permette una migliore comprensione della biologia molecolare di base della riparazione dei tessuti, così come per potenziali applicazioni traslazionale in medicina rigenerativa. Qui dettaglio i protocolli sperimentali per esplorare la funzione in vivo di MG53 nella riparazione di lesioni muscolo utilizzando protocolli di esercizio al treadmill in modelli murini, per testare la capacità di membrana ex vivo riparazione misurando ingresso colorante in fibre muscolari isolate, e per il monitoraggio del processo dinamico della MG53-mediata traffico di vescicole e membrana riparazione cellulare nelle cellule in coltura di cellule vive usando la microscopia confocale.
Protocollo
1. Tapis roulant Correre per Rivelare l'entità della lesione muscolare in modelli murini
- Stabilire l'angolo della superficie di tapis roulant per l'utilizzo durante il protocollo di esecuzione. In generale, un livello piatto o un angolo tra i 7 ° e 15 ° gradi in discesa o in salita è usato. Alcuni tapis roulant sono parte integrante dell'apparato di regolare l'inclinazione, mentre altri richiedono il tapis roulant di essere elevata con altri mezzi.
- Posizionare un vassoio o un trampolino di laboratorio blu sotto il tappeto prima di mettere gli animali nei tapis roulant per raccogliere i rifiuti di animali durante il protocollo di esecuzione.
- Prima di eseguire i topi dovrebbero essere acclimatati all'ambiente del tapis roulant. Ciò comporta l'immissione degli animali nei tapis roulant per 15 minuti con la rete elettrica spegne e il motore trasmissione a cinghia su, ma la cintura non si muove (cioè con la velocità impostata a 0 m / s).
- Attivare la griglia motivazionale elettrica. L'intensità e la frequenza degli impulsi utilizzati di solito può essere controllata su tapis roulant, ma varia da un costruttore all'altro. In generale, l'intensità massima non è tenuto a motivare i topi di funzionare mentre una frequenza elevata (almeno una volta ogni due secondi) migliorare la compliance.
- Attivare la cintura tapis roulant per iniziare il protocollo di esecuzione. Una velocità iniziale di circa 5 metri / min deve essere utilizzato per un periodo di riscaldamento per i topi. La velocità del tapis roulant può essere accelerato lentamente, di solito con l'aggiunta di 1-2 metri / min per ogni minuto dopo l'inizio del tapis roulant.
- Il rispetto degli animali nella maggior parte dei protocolli può essere migliorata conducendo una serie di basse tirature (5 minuti) a velocità di riscaldamento per 3 a 10 giorni prima della esecuzione sperimentale comincia.
- Un esercizio esaurimento acuta comporta in genere l'aumento della velocità del tapis roulant con il tempo fino ad una velocità massima (generalmente <30 m / m) è raggiunto e mantenuto fino a quando i topi mostrano segni di esaurimento. I criteri per giudicare esaurimento variare, ma generalmente includono un mouse spendere più della metà del tempo sulla rete elettrica o 5 secondi consecutivi sulla rete elettrica senza ritornare in superficie tapis roulant. Dopo un mouse individuo è esaurito può essere rimosso dal tapis roulant e il tempo totale di esecuzione può essere registrato.
- Cambiare l'angolo del tapis roulant può essere utilizzata in processi acuti corsa per aumentare il carico di esercizio (con un angolo di salita) o di indurre danni contrazioni eccentriche (con un angolo di discesa) che lacerano le membrane del sarcolemma delle fibre muscolari 1. Evans colorante blu possono essere iniettati in animali prima che le procedure per l'utilizzo come colorante istologico per identificare le fibre muscolari danneggiate 2,3.
- L'allenamento di resistenza in esecuzione protocolli prevedono un carico di esercizio per l'animale in un periodo di tempo prolungato (fino a mesi) al fine di produrre rimodellamento del muscolo o il sistema cardiovascolare. Warm up procedura è la stessa di cui sopra (punto 1.5) però la velocità massima è generalmente inferiore ed i tempi di esecuzione può essere piuttosto lungo (> 1 ora).
- Dopo il completamento di correre i topi possono essere restituiti alle loro gabbie. Tapis roulant di solito diventano piuttosto sporca, mentre i topi sono in esecuzione, in particolare su protocolli lungo. E 'necessario pulire il tapis roulant, di solito con uno spray etanolo al 70%, dopo ogni utilizzo.
2. Ex test in vivo della capacità di riparazione della membrana delle fibre muscolari isolati laser UV-A seguito di danni
- Sezionare lo strato superficiale del flessore delle dita brevis (FDB) muscolo dal piede del mouse. In primo luogo, tagliare la pelle del aperti solo alla linea mediana, mentre facendo attenzione a non danneggiare il muscolo sottostante, poi fare dei tagli orizzontali e togliere la pelle. Il tendine del muscolo piatto bianco FDB (tendine prossimale) può essere visto attaccati all'osso del calcagno. Senza mezzi termini a parte il tendine di forcipe e recidere il tendine vicino al sito di attaccamento, afferrare il tendine libero da pinza e tirarlo verso l'alto delicatamente per separare i FDB dai tessuti circostanti, mentre il taglio di qualunque tessuto connettivo che rimangono attaccati. Dopo aver visto il ramo distale tendini alle cifre individuali la FDB può essere rimosso tagliando dove questi tendini collegano allo strato più profondo del muscolo.
- Mettere il fascio muscolare FDB in 1 ml di soluzione di collagenasi pre-riscaldato a 37 ° C in una provetta da 1,5 ml Eppendorf, nastro il tubo in un orientamento orizzontale a 37 ° C orbitale shaker e agitare a 200 rpm per 65 min. Tempi di incubazione può essere regolato per garantire la digestione sufficiente, che è indicata da un aspetto sfilacciato e il colore pallido del muscolo.
- Cura il trasferimento del fascio FDB digerito in un tubo di 1,5 microlitri centrifuga contenente ~ 600 ml di 2,5 Tyrode Ca 2 + tramite una punta da 1 ml con una pipetta fine taglio che ha un diametro sufficiente a consentire il fascio digerito di passare facilmente attraverso senza interruzioni. Capovolgere delicatamente il tubo di scuotere le fibre sciolto dal bundle.
- Tagliare la punta della pipetta 30 microlitri in modo che il diameter è solo leggermente più piccolo del fascio muscolare (tra i 15 - 20 micron di diametro) Utilizzare la pipetta per disegnare delicatamente il pacco nella pipetta e poi spingerlo nuovamente dentro la soluzione.. Ripetere questo processo fino a quando la maggior parte delle fibre sono dissociate dal fascio.
- Mescolare fibre dissociate bene girando delicatamente il tubo, prendete importo desiderato e cadono in un fondo di vetro piatto delta T. Il volume di carico varia in base al rendimento di isolamento e il numero di fibre utili che servono su un piatto per un particolare protocollo. Le fibre restanti possono essere memorizzati nel tubo a 4 ° C per circa 6 ore per ulteriori studi.
- Lasciare che il piatto a riposare per 5 minuti. Questo permette alle fibre di aderire al fondo di vetro del piatto.
- Porre la capsula a fondo di vetro su un microscopio confocale equipaggiato con un laser UV. Osservare le fibre al microscopio di fase con ingrandimento> 100X per verificare la presenza di un pattern striatura normale e una scala, asta come forma.
- Aggiungi FM1-43 o FM4-64 coloranti styrylpyridinium 4 a soluzione ad una concentrazione finale di 2,5 mM 5.
- Per indurre danni alla posizione delle fibre nella finestra di imaging così la fibra è orientata ad un angolo di 45 ° dalla parte superiore sinistra del campo di vista in basso a destra (Figura 1). Irradiare una zona di 5x5 pixel (circa 0.9μmx0.9μm) della membrana plasmatica utilizzando un laser UV (80 mW o superiore, 351/364 nm) impostato alla massima potenza per 5 secondi. La regione irradiata dovrebbero dividere la membrana plasmatica, cioè la metà della casella 5x5 dovrebbe essere all'interno della fibra, mentre il resto dovrebbe essere al di fuori della fibra (Figura 1).
- Catturare immagini di entrata colorante nella fibra a intervalli di 5 secondi ciascuno per un massimo di 5 minuti.
- Ripetere il punto 2.8 per non più di 3 fibre per piatto, in quanto il colorante fluorescente alla fine sarà endocitato nella fibra e complicare le analisi dei dati. Dopo 3 fibre di un nuovo piatto deve essere preparato dal punto 2.5.
- Analizzare i dati calcolando la variazione di intensità di fluorescenza (ΔF / F 0) tra ogni fotogramma catturato per misurare la quantità di entrata colorante. Ciò richiede la misurazione della fluorescenza media di una superficie di circa 200 micron 2 utilizzando software di analisi come il pubblicamente disponibili ImageJ (http://rsbweb.nih.gov/ij/). Per fare un confronto tra le fibre, il seguente calcolo deve essere fatta per ogni fotogramma: ΔF / F 0, dove F 0 è la fluorescenza media della regione di interesse nel primo fotogramma catturato (t = 0; prima della lesione), e ΔF è la variazione di fluorescenza di ogni fotogramma successivo (FF 0).
3. Vivere Imaging confocale cellulare per controllare il processo dinamico di riparazione della membrana cellulare
- Micropipette sono state fatte da PYREX capillari. Il capillare è stata posta su un estrattore micropipetta e tirata a pre-impostati programma (calore = 695; Tirare = 50; Vel .= 55; Tempo = 250).
- Micropipetta è stato attaccato ad un asse 3 (xyz) micromanipolatore.
- Le cellule sono transfettate con il DNA plasmidico con metodi normali su un piatto fondo di vetro delta T. I terreni devono essere acceso a 2,5 mm Ca 2 + tampone Tyrode prima di iniziare gli esperimenti.
- Piatti di vetro contenenti cellule transfettate sono stati collocati su un microscopio confocale a scansione laser con obiettivo 40X 1.3NA immersione in olio.
- L'acuto live-cell danni è stata effettuata inserendo il micropipetta nella membrana cellulare e quindi rapidamente ritrarre la micropipetta fuori dalla cella 3,6. Consecutivi immagini dal vivo di cellule sono state ottenute con un intervallo di 1,54 s / telaio.
- Per il saggio saponina membrana indotta interruzione, 0,005% saponina (Sigma) in 2,5 mm di Ca 2 + tampone Tyrode è stato perfuso da un flusso di gravità su misura assemblati sistema di perfusione 7. Il tasso di perfusione è di circa 1 ml / min e la punta perfusione deve essere posto direttamente sopra la cella viene esposta.
4. Rappresentante dei risultati:
Un film rappresentante del tapis roulant in esecuzione del mouse può essere effettuato durante le riprese. Il film illustrerà la ridotta capacità di funzionamento del mg53-/ - i topi a causa di danni al muscolo scheletrico.
L'entità del danno causato dal laser UV-protocollo dettagliata dei danni sopra dipende dalla capacità della membrana riparazione della fibra analizzati. Questa capacità è influenzata dal genotipo del mouse da cui è stato isolato la fibra, le condizioni extracellulare, e qualsiasi modifica di espressione della proteina (trasfezione o infezione). Una fibra normale di tipo selvatico permetterà lieve a moderata ingresso colorante (Figura 2a). Fibra muscolare deriva dal mg53-/ - i topi con una capacità di membrana compromessa riparazione mostrerà ingresso più significativo del colorante nella fibra (Figura 2b).
I risultati tipici per traslocazione mostrare microelettrodo ferimento di MG53 contenenti vesiCles al luogo di ferita. Figura 3a e 3b mostrano GFP-MG53 miotubi C2C12 trasfettate danneggiati inserendo la micropipetta nella membrana cellulare. Nella cella prima che il danno micropipetta, GFP-MG53 si trova su entrambi membrana plasmatica citoplasma e 3. A seguito di penetrazione micropipetta, GFP-MG53 vescicole contenenti spostato verso siti danno (come indicato dalla freccia). Figura 3c mostra un GFP-MG53 mioblasti C2C12 trasfettate trattati con 0,005% di saponina, un detergente che può permeabilize la membrana plasmatica. Al trattamento saponina, GFP-MG53 traslocato dal citosol alla membrana cellulare.
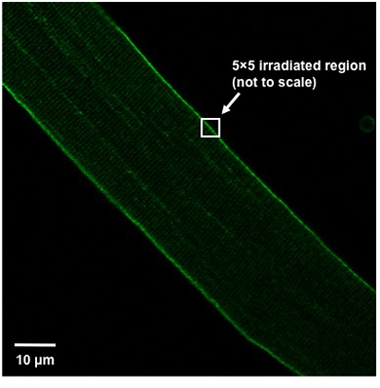
Weisleder, et al. Figura 1. Allineamento delle fibre e regione definizione lesioni. Corretto orientamento delle fibre muscolari isolate all'interno del campo visivo e la definizione della regione lesioni mostrato.
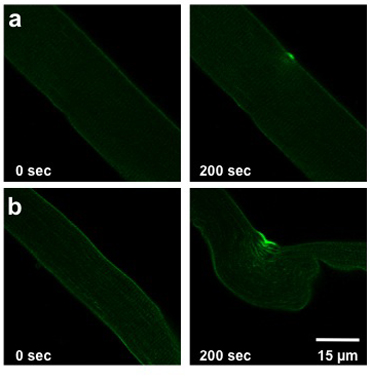
Weisleder, et al. Figura 2. Danni laser UV di fibra FDB. Immagini mostrano le fibre prima della lesione (0 sec, a sinistra) ea 200 lesioni dopo sec (a destra). Fibre da un topo wild-type (a) mostrano lesioni lievi. Fibre provenienti da topi con la riparazione della membrana compromessa (b) permettere a più tintura di entrare.
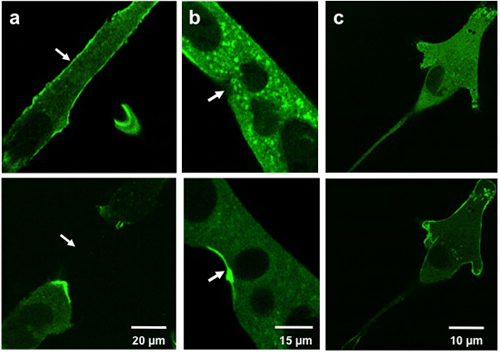
Weisleder, et al. Figura 3. Danni microelettrodo e saponina di cellule in coltura. Immagini mostrano miotubi C2C12 (a, b) e un mioblasti C2C12 (c) prima ferita (sopra) e lesioni post (in basso). Cellule danneggiate con un microelettrodo (a, b) mostrano MG53 traslocazione a siti di lesione (frecce). Cellule trattate con saponina (c) mostrare MG53 traslocazione alla membrana cellulare.
Discussione
Esecuzione tapis roulant è una metodologia utile a fornire un carico di esercizio per gli animali trattati. Come una metodologia per misurare la funzione muscolare o la capacità di resistenza si tratta di un approccio noto rumore che è difficile da eseguire in modo costantemente riproducibile 8. In generale, i tempi di esaurimento può essere utilizzato come un endpoint per risolvere grandi differenze tra i gruppi sperimentali, come quelle tra le linee del mouse alcuni topi knockout e wild-type 9. Manipolazioni sperimentali che producono differenze più sottili, come ad esempio alcune prove farmaceutiche, non può risolvere le divergenze di sopra del rumore associati a questa tecnica. Al fine di massimizzare la riproducibilità e la sensibilità di queste tecniche, è importante mantenere le condizioni per la sessione a sessione molto da vicino. L'ora del giorno gli animali sono esercitate, nonché le condizioni di caldo periodo di presentazione utilizzata, sono fattori importanti e dovrebbero rimanere costanti da prova a prova.
Effetti di deformazione può avere un impatto significativo sulla progettazione di protocolli di tapis roulant come alcuni ceppi di topi può funzionare per molto più tempo sul tapis roulant di altri ceppi e rispondono in modo diverso di esercitare la resistenza 10. Come regola generale, i topi molti saranno in grado di eseguire 200-300 metri totali in uno studio di esaurimento con aumento costante della velocità del tapis roulant (5 m / m velocità iniziale di 1 m / m aggiunto per ogni minuto dopo l'avvio). Per un esercizio di resistenza del topo può essere eseguito tra 9-12 m / m per 30 minuti 2 o 3 volte a settimana. Tuttavia, studi individuali di solito richiedono una ottimizzazione del protocollo per soddisfare esigenze individuali sperimentale.
L'UV-laser procedura danno è stato dimostrato di essere un metodo efficace per misurare la capacità di riparazione della membrana delle fibre muscolari scheletriche 3,6,11. Un componente essenziale per il successo di questi esperimenti è quello di utilizzare le fibre muscolari che visualizzano solo un diritto, aspetto a forma di asta con uno schema regolare di striature e di un sarcolemma liscia che non appare rugosa. Se le fibre muscolari sono selezionati altri danni membrana possono essere già presenti in queste fibre e l'interpretazione dei risultati di questi esperimenti può essere complicata. E 'anche importante che l'orientamento delle fibre e la definizione della regione irradiata essere definito in Figura 1. Questo fornisce una lesione di dimensioni riproducibili, in modo da permettere un raffronto tra le fibre. Se la regione definita di lesioni si trova completamente all'interno della fibra, una lesione interna verrà creato, piuttosto che interrompere il sarcolemma. Inoltre, il valore calcolato per ΔF / F 0 è molto sensibile alla regione di interesse selezionate per la misurazione della fluorescenza media. Una superficie di circa 200μm 2, adiacente e incluso il sito della lesione, è appropriato. A differenza della regione definita per infortunio, questa area dovrebbe trovarsi completamente all'interno della fibra. Se si include lo spazio al di fuori della fibra, l'area risulta vuota aumenterà ΔF / F 0 in fibre con poco colorante riducendo al contempo l'ingresso ΔF / F 0 in fibre con un fenotipo più grave. Questo diminuisce la sensibilità del dosaggio, rendendo così il confronto tra le fibre più difficile.
Per l'analisi danno micropipetta, l'angolo tra la micropipetta e fondo piatto di vetro dovrebbe essere di circa 45 gradi in modo da danneggiare in modo efficace la membrana cellulare. Le cellule sono state scelte per danni micropipetta deve essere strettamente collegato al fondo del piatto e le cellule arrotondate non deve essere utilizzato poiché la maggior parte è probabile che si staccano dopo micropipetta frugando. Esperimenti permeabilzation saponina sono meno tecnicamente impegnativo e piuttosto veloce da eseguire rispetto alla micropipetta test di penetrazione. Tuttavia, ci sono alcune limitazioni per i danni saponina, comprese che solo una cellula può essere utilizzato per ogni piatto dal saponina si diffonderà e danneggiare le altre cellule in quel piatto.
Divulgazioni
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
|---|---|---|---|
| Roditori tapis roulant | Columbus Strumenti Esercizi 06/03 o equivalente | ||
| Etanolo al 70% | ISC Bioexpress | ||
| Strumenti di dissezione tra cui pinze punta fine, forbici primavera | Mondo Strumenti di precisione | ||
| 2 mg / ml collagenasi di tipo I | Sigma | ||
| 0 Ca 2 + Tyrode tampone (140 mM NaCl, 5 mM KCl, 10 HEPES mM, 2 mM MgCl 2, pH 7,2, 290 mOsm) | Sigma | ||
| 2,5 mm di Ca 2 + Tyrode tampone (140 mM NaCl, 2,5 mM CaCl 2, 5 mM KCl, 10 HEPES mM, 2 mM MgCl 2, pH 7,2, 290 mOsm) | Sigma | ||
| Temperatura controllabile agitatore orbitale | New Brunswick o equivalente | ||
| Delta TPG Dish | Fisher Scientific | 1207133 | |
| LSM 510 con un microscopio confocale laser UV Enterprise 80 mW o equivalente microscopio confocale | Zeiss | ||
| FM1-43-64 FM4 o coloranti | Invitrogen | ||
| Borosilicato Capillari Dimensione 0,8-1,0 x 100 mm | PYREX | Codice 9530-2 | |
| Micropipetta estrattore | Sutter Instruments | modello P-97 | |
| 3 assi micromanipolatore | Narishige | MHW-3 | |
| Radiance 2100 microscopio a scansione laser confocale microscopio o equivalente | BioRad | MHW-3 | |
| Saponina | Sigma | 47036 |
Riferimenti
- Armstrong, R. B., Ogilvie, R. W., Schwane, J. A. Eccentric exercise-induced injury to rat skeletal muscle. J Appl Physiol. 54, 80-93 (1983).
- Hamer, P. W., McGeachie, J. M., Davies, M. J., Grounds, M. D. Evans Blue Dye as an in vivo marker of myofibre damage: optimising parameters for detecting initial myofibre membrane permeability. J Anat. 200, 69-79 (2002).
- Cai, C. MG53 nucleates assembly of cell membrane repair machinery. Nat Cell Biol. 11, 56-64 (2009).
- Cochilla, A. J., Angleson, J. K., Betz, W. J. Monitoring secretory membrane with FM1-43 fluorescence. Annu Rev Neurosci. 22, 1-10 (1999).
- McNeil, P. L., Miyake, K., Vogel, S. S. The endomembrane requirement for cell surface repair. Proc Natl Acad Sci U S A. 100, 4592-4597 (2003).
- Cai, C. Membrane repair defects in muscular dystrophy are linked to altered interaction between MG53, caveolin-3, and dysferlin. J Biol Chem. 284, 15894-15902 (2009).
- Wang, X. Cardioprotection of ischemia/reperfusion injury by cholesterol-dependent MG53-mediated membrane repair. Circ Res. 107, 76-83 (2010).
- Knab, A. M. Repeatability of exercise behaviors in mice. Physiol Behav. 98, 433-440 (2009).
- Zhao, X. Enhanced resistance to fatigue and altered calcium handling properties of sarcalumenin knockout mice. Physiol Genomics. 23, 72-78 (2005).
- Massett, M. P., Berk, B. C. Strain-dependent differences in responses to exercise training in inbred and hybrid mice. Am J Physiol Regul Integr Comp Physiol. 288, 1006-1013 (2005).
- Bansal, D. Defective membrane repair in dysferlin-deficient muscular dystrophy. Nature. 423, 168-172 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon