È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
L'insulina per iniezione ed estrazione emolinfa per misurare la sensibilità all'insulina nei adulti Drosophila melanogaster
In questo articolo
Riepilogo
Segnalazione dell'insulina conservato percorsi trova nel moscerino della frutta Drosophila melanogaster Fanno di questo organismo un potenziale strumento per la modellazione di malattie metaboliche tra cui diabete di tipo II. A tal fine, è fondamentale per stabilire i test fisiologici per misurare in modo efficace azione sistemica all'insulina nello smaltimento del glucosio periferico nella mosca adulta.
Abstract
Conservati i meccanismi di rilevazione dei nutrienti esistono tra di mammiferi e moscerino della frutta dove peptidi simili all'insulina nei mammiferi e il glucagone, rispettivamente la funzione di mantenere l'omeostasi del glucosio durante lo sviluppo larvale 1,2 fasi. Studi sulla gran parte post-mitotico mosche adulte hanno rivelato perturbazione dell'omeostasi del glucosio come il risultato di ablazione genetica di insulin-like peptide (ILP), cellule che producono (IPC) 3. Così, moscerini della frutta adulti sono molto promettenti come un sistema idoneo modello genetico di malattie metaboliche tra cui diabete di tipo II. Per sviluppare ulteriormente il sistema di moscerino della frutta, paragonabile test fisiologici utilizzati per misurare la tolleranza al glucosio e la sensibilità all'insulina nei mammiferi devono essere stabiliti. A tal fine, abbiamo recentemente descritto una nuova procedura per la misurazione della risposta orale di tolleranza al glucosio nei mosca adulta e ha dimostrato l'importanza di IPC adulti nel mantenimento dell'omeostasi del glucosio 4,5. Qui, abbiamo modificato la procedura descritta in precedenza per l'iniezione di insulina 6 e combinato con un nuovo metodo di estrazione emolinfa per misurare la sensibilità periferica all'insulina nei mosca adulta. Unicamente, il nostro protocollo permette misurazioni dirette fisiologica della capacità della mosca adulta di disporre di un carico di glucosio periferico a seguito di iniezione di insulina, una metodologia che rende possibile caratterizzare mutanti segnalazione dell'insulina e gli interventi possibili riguardano tolleranza al glucosio e la sensibilità all'insulina nei mosca adulta.
Protocollo
1. L'insulina Soluzione Preparazione
- Preparare una soluzione fresca bovina insulina sciogliendo insulina in PBS per raggiungere la concentrazione di 0,01 mg / ml. Sia insulina / PBS e controllo PBS soluzioni devono essere tenuti in ghiaccio per tutta la procedura di iniezione. Queste soluzioni devono essere preparate con il 0,5% (v / v) FD & C non blu. 1 colorante alimentare.
2. Ago Preparazione e iniezione Set-up
- Preparare gli aghi capillare di vetro con un puller.The micropipetta seguenti impostazioni di estrattore produrre aghi di qualità sufficiente per l'iniezione: Calore, 345; Pull, 210; Velocità, 100; Tempo, 200 (100 ms). Aghi appena tirato devono essere smussati premendo la punta attraverso un tessuto Kimwipe. Questo processo di ottundimento rimuove la punta allungata alta resistenza e produce una punta più robusto con un diametro dei pori più grandi.
- Luogo aghi smussati punta-up in una provetta contenente l'insulina / PBS soluzione o PBS solo. Capillare azione risulta in back-riempimento di ogni ago. Osservare la punta di un ago sotto uno stereomicroscopio per garantire che non detriti o bolle d'aria comparire sulla punta. Eliminare qualsiasi aghi che non riempire correttamente.
- Inserire aghi riempito nel manuale porta aghi microinjector e la posizione del titolare ago con un micromanipolatore in modo che la punta dell'ago è visibile attraverso uno stereomicroscopio. Applicare una pressione positiva sul fluido nella colonna l'ago ruotando la manopola manuale micrometrica microinjector attaccato al pistone sulla siringa microinjector.
- Verificare che la pressione sufficiente per lo spostamento dei fluidi è stata applicata toccando un Kimwipe alla punta dell'ago e confermando il flusso del fluido.
- Una volta che l'ago è stato preparato per l'iniezione, apporre una tabella di calibrazione per l'albero ago con del nastro adesivo trasparente, e portare la punta dell'ago a fuoco attraverso uno stereomicroscopio con ingrandimento 20X.
3. Preparazione volare
- Le mosche femmina di dieci giorni di età sono usati per gli esperimenti di iniezione. Raccogliere le mosche entro 24 ore eclosion. Anestetizzare vola con umidificata CO 2 su un cuscinetto a gas, risolvere i maschi e vola posto femminile in fiale contenenti standard o una dieta di trattamento. Mantenere la femmina vola sulle diete sperimentale per 10 giorni.
- Il decimo giorno successivo eclosion e separazione a diete sperimentali, il trasferimento di aria dal loro cibo contenenti fiale di fiale contenenti da 5 ml tappo del 2% agar e farli morire di fame per 12-16 h.
- Trasferimento vola di fame fiale contenenti filtri di glucosio al 10% messi a bagno per 1 ora prima dell'iniezione di insulina.
- Brevemente anestetizzare le mosche con 2 CO umidificata dopo l'alimentazione del glucosio e poi immobilizzare freddo li sul ghiaccio.
4. Procedura di iniezione
- Afferrare una mosca freddo immobilizzato con un paio di pinze sottili e tenerlo vicino alla punta dell'ago in modo che la punta è adiacente alla regione anteriore del lato sinistro del torace della mosca. Portare sia la punta dell'ago e del torace della mosca a fuoco con lo stereomicroscopio.
- Spostare delicatamente il volo verso la punta dell'ago in modo che la punta dell'ago tocca il centro della protuberanza della regione prescutum sinistra del torace della mosca (Fig. 1). Una volta che la mosca è correttamente orientato e allineato con la punta dell'ago, continuare ad avanzare al volo l'ago in modo che l'ago infilza il centro del prescutum.
- Applicare una pressione positiva, se necessario facendo avanzare lo stantuffo della siringa con la manopola del micromanipolatore microinjector fino al 0,1 ml di liquido è stato iniettato nel volare. Il flusso del liquido in hemocoel della mosca impartirà un colore blu sul lato sinistro del torace anteriore. Ogni tanto si deve ritirare e avanzare più volte per rimuovere eventuali blocchi punta dell'ago e consentire il flusso del fluido.
- Lasciare vola iniettato per recuperare in fiale agar al 2% per i punti designati tempo prima dell'estrazione emolinfa.
5. Emolinfa Collection
- Brevemente anestetizzare vola con CO 2 a umidificato desiderato post-iniezione punti ora e la posizione di ogni volo dorsale-side-down su nastro biadesivo apposte sulla superficie di un pad di CO 2. Disporre vola anche in filari con capsule testa allineati. Si può usare un bastoncino applicatore di legno tagliato a premere le loro ali nel nastro adesivo e garantire l'immobilizzazione.
- Una volta che le mosche sono fissati al nastro, afferrare proboscide ogni mosca con una pinza sottile e delicatamente tirare verso la regione ventrale e posteriore del volo in modo che la parte anteriore della capsula testa è visibile attraverso il microscopio stereo.
- Con l'altra mano e mentre si tiene la proboscide in posizione, forare il centro della capsula testa appena sopra la sutura ptilinal utilizzando un ago di tungsteno tagliente (Fig. 2). Bisogna stare attenti a non inserire l'ago troppo lontano, come è facile forare la punta dell'ago attraverso l'altro lato della capsula testa e successivamente perdere controllo del flusso di emolinfa. Puntura vola tutti in un gruppo di iniezione prima di raccogliere emolinfa.
- Una volta che la capsula di testa è stato perforato, utilizzare un bastone di legno tagliato applicatore per applicare delicatamente pressione sull'addome della mosca. Può essere utile per lanciare i sorvolare in modo che poggi su un lato ventrale, come si applica la pressione. Questa procedura produrrà una goccia di emolinfa dal sito della puntura testa capsula.
- Toccare un'estremità di un tubo di 1ml microcapillare alla goccia emolinfa che emerge dal sito della puntura testa capsula. L'emolinfa entra nel tubo attraverso l'azione capillare. Determinare e registrare la quantità di emolinfa raccolti controllando la colonna di liquido all'interno del tubo microcapillare contro un grafico del volume è laureato.
6. Emolinfa glucosio Determinazione
- Espellere i campioni emolinfa in pozzetti contenenti 100 ml di Reagente Glucosio Infinity. Tenere piastra su ghiaccio durante il caricamento di campioni emolinfa.
- Stabilire una curva standard caricando separatamente 1 ml ciascuna delle soluzioni madre di glucosio a 50mm, 25mm, 12,5 mm, 6.25mm e 3.125mM.
- Incubare i campioni a 37 ° C per 10 minuti.
- Rileva a 340 nm.
- Considerazione per il volume emolinfa raccolti e determinare la concentrazione di glucosio campione basato sulla curva standard con concentrazioni di glucosio noti.
7. Rappresentante Risultati
Una tipica risposta di tolleranza insulinica viene rilevato nei diabetici insulino-iniettata vola in cui viene rilevato un calo dei livelli circolanti di glucosio 15 minuti dopo l'iniezione. Al contrario, tale risposta non è visto nei moscerini della PBS iniettato (Fig. 3). Questa risposta in materia di smaltimento del glucosio periferico continua nei diabetici insulino-iniettata vola fino a 30 minuti dopo l'iniezione. Noi abitualmente estrarre 0,2-0,5 ml di emolinfa per 4-5 vola in ogni gruppo di iniezione. Tre gruppi di iniezione sono inclusi in ciascun esperimento.

Figura 1. Lato sinistro del torace Drosophila che mostra l'inserimento del sito ago (Modificato da Demerec, 1950) 7. Inserire l'ago attraverso il centro della prescutum sul anteriore, regione dorsale del lato sinistro del torace.
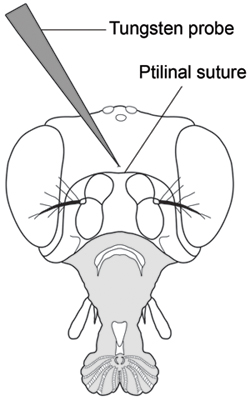
Figura 2. Vista frontale della testa di Drosophila che mostra la collocazione puntura per l'estrazione emolinfa (Modificato da Demerec, 1950) 7. Perforare la capsula testa con una sonda di tungsteno finemente incisi nel centro della capsula testa appena sopra la sutura ptilinal.
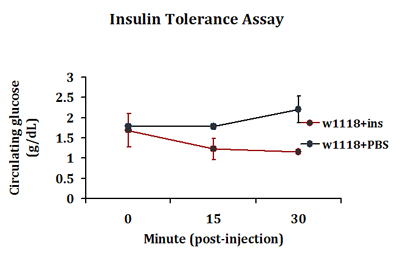
Figura 3. Una tipica risposta di tolleranza insulinica rilevato nel controllo delle mosche adulte. Controllo delle mosche w 1118 sono stati iniettati con insulina bovina (1 ng in PBS) o PBS solo. Vola in gruppi replicare sono stati poi permesso di recuperare per i minuti 0, 15 o 30 ed i livelli di glucosio circolanti sono stati misurati.
Discussione
La tecnica descritta in questo rapporto è potenzialmente utile in qualsiasi studio che indaga i processi fisiologici con conseguente alterazioni rilevabili nella composizione emolinfa Drosophila. Grazie alla combinazione di iniezione e la raccolta emolinfa in questo modo, è possibile accertare gli effetti immediati fisiologicamente rilevanti di un particolare trattamento sperimentale o manipolazione. Il vantaggio principale di questa tecnica "salasso" nella raccolta di emolinfa rispetto alle tecnich...
Divulgazioni
Riconoscimenti
Questo lavoro è stato sostenuto dalle concessioni dal NIA a YW.CF (AG21068, AG31086).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente / attrezzature | Azienda | Numero di catalogo | |
|---|---|---|---|
| Insulina bovina | Sigma | I5500 | |
| Infinity glucosio reagente | Thermo Electron Corporation | TR1541 | |
| Manuale microinjector | Sutter strumento | ||
| P-87 Flamming / Brown micropipetta estrattore | Sutter strumento | ||
| Singolo cilindro in vetro borosilicato capillare | Sistemi AM | 626000 | |
| FD & C blu n ° 1 | McCormick & Company | ||
| 1 tubi microlitri microcapillare | Drummond | ||
| Tre assi micromanipolatore manuale e la base | Mondo Strumenti di precisione |
Riferimenti
- Rulifson, E. J., Kim, S. K., Nusse, R. Ablation of insulin-producing neurons in flies: growth and diabetic phenotypes. Science. 296, 1118-1118 (2002).
- Kim, S. K., Rulifson, E. J. Conserved mechanisms of glucose sensing and regulation by Drosophila corpora cardiaca cells. Nature. 431, 316-316 (2004).
- Broughton, S. J. Longer lifespan, altered metabolism, and stress resistance in Drosophila from ablation of cells making insulin-like ligands. Proc Natl Acad Sci U S A. 102, 3105-3105 (2005).
- Haselton, A. Partial ablation of adult Drosophila insulin-producing neurons modulates glucose homeostasis and extends life span without insulin resistance. Cell Cycle. 9, 3063-3063 (2010).
- Haselton, A. T., Fridell, Y. W. Adult Drosophila melanogaster as a model for the study of glucose homeostasis. Aging (Albany NY). 2, 523-523 (2010).
- Belgacem, Y. H., Martin, J. R. Disruption of insulin pathways alters trehalose level and abolishes sexual dimorphism in locomotor activity in Drosophila. J Neurobiol. 66, 19-19 (2006).
- Demerec, M. . Biology of Drosophila. , (1950).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon