Method Article
Vibrodissociation di neuroni da fettine di cervello di roditore studio di trasmissione sinaptica e Immagine terminali presinaptici
In questo articolo
Riepilogo
Questa relazione dimostra una tecnica per isolamento meccanico di singoli neuroni vitali mantenendo attaccato boutons presinaptica. Vibrodissociated neuroni hanno il vantaggio di una produzione rapida, eccellente controllo farmacologico e migliorato lo spazio-clamp senza influenza dalle cellule vicine. Questo metodo può essere utilizzato per l'imaging di elementi sinaptica e di patch-clamp registrazione.
Abstract
Meccanica dissociazione dei neuroni del sistema nervoso centrale ha il vantaggio che boutons presinaptica rimangono attaccati al neurone isolato di interesse. Questo consente per l'esame della trasmissione sinaptica in condizioni in cui gli ambienti extracellulare ed intracellulare postsinaptici possono essere ben controllate. Una vibrazione a base di tecnica senza l'uso di proteasi, noto come vibrodissociation, è la tecnica più diffusa per l'isolamento meccanico. Una micropipetta, con la punta fuoco lucidato alla forma di una pallina, viene inserito in una fetta del cervello fatto da un P1-P21 roditori. La micropipetta è vibrato parallela alla superficie fetta e abbassare lo spessore della fetta con conseguente liberazione di neuroni isolati. I neuroni isolati sono pronti per lo studio in pochi minuti di vibrodissociation. Questa tecnica ha dei vantaggi rispetto all'uso di colture primarie neuronali, fettine di cervello e neuroni isolati enzimaticamente tra cui: la produzione rapida di vitale, neuroni relativamente matura adatto per studi elettrofisiologici e di imaging, controllo superiore dell'ambiente extracellulare libero dall'influenza delle cellule vicine; idoneità per esperimenti farmacologici ben controllati con l'applicazione rapida di droga e superfusione cellulare totale e migliorato lo spazio-clamp nelle registrazioni relativi ai neuroni in fetta o preparati colture cellulari a cellula intera. Questa preparazione può essere utilizzato per esaminare sinaptica fisiologia, farmacologia, la modulazione e la plasticità. Imaging in tempo reale di entrambi gli elementi pre-e post-sinaptici nelle cellule viventi e boutons è possibile anche utilizzando i neuroni vibrodissociated. Caratterizzazione dei costituenti molecolari degli elementi pre-e post-sinaptici può essere ottenuta anche con approcci immunologici e di imaging-based.
Protocollo
1. Preparazione di fiamma Sealed Glass Micropipetta
- Utilizzando il vetro microelettrodo, tirare una serie di patch-clamp micropipetta su un Flaming-Brown o equivalente micropipetta estrattore (punta diametro ~ 2 micron). Micropipetta luogo punta nella fiamma di un becco Bunsen per ~ 2 sec fino a quando si forma una palla fusa con un diametro di 200-300 micron.
- Luogo fiamma sigillato pipetta cerotto sulla titolare su un micromanipolatore che possono essere rapidamente vibrato da lato a lato (distanza viaggio 100-200 micron) utilizzando un piezoelettrico bimorfi, relè, o un dispositivo equivalente efficace.
2. Preparazione di sezioni di cervello da P1-P21 ratti o topi
- Preparare artificiale liquido cerebrospinale (aCSF) con la seguente composizione (in mm): 124 NaCl, 4.5 KCl, 1.2 NaH 2 PO 4, 26 NaHCO 3, e 10 D-glucosio. Soluzione bolla con il 95% di ossigeno / 5% CO 2 gas per circa 15 minuti, quindi aggiungere 2 mM CaCl 2 e 1 mM MgCl 2.
- Taglio fette di cervello:
- Anestetizzare animali con alotano o isofluorano. Decapitare animali - rimuovere cervello - cervello blocco nella posizione desiderata (coronale, parasagittale, trasversale, ecc) per includere le regioni di interesse.
- Fissare il cervello bloccato allo stadio di una affettatrice cervello vibrante immersa in aCSF - cervello sezione a 250-400 micron di spessore - fette posto in aCSF bollito con CarboGen in una camera "preincubazione" sulla rete che consente di fluido / esposizione a gas su tutte le superfici - permettono fette di equilibrare in questo mezzo per almeno un'ora.
3. Vibrodissociation
- Riempire un piatto di diametro 35 millimetri cultura con HEPES-soluzione salina tamponata della seguente composizione (mm): 150 NaCl, 5 KCl, 10 HEPES, 1 MgCl 2, 2.5 CaCl 2, 10 D-glucosio con pH impostato a 7,4 con NaOH e osmolarità regolato ~ 300 mOsm mediante saccarosio. Piatti la cultura può essere piatti sospensione, standard piatti di coltura cellulare, capsule di Petri con inserti in vetro coprioggetti, o piatti rivestiti con, ad esempio, poli-L-lisina, a seconda delle necessità di aderenza delle cellule più forte per il fondo piatto.
- Mettere la fetta nel piatto cultura e visualizzare con uno stereoscopio dissezione a 250 x. Tenere fetta sul fondo con un filo di platino piegato (0,5 mm di diametro) posto sulla superficie superiore della fetta di agire come un peso.
- Posizionare la punta della fiamma sigillato micropipetta sulla superficie di sezione nella regione del cervello desiderato. Attivare micromanipolatore a vibrare la punta laterale a 10-30 Hz, con la distanza escursione ~ 100 micron. Utilizzando il micromanipolatore, spostare la punta più in profondità nel tessuto fetta tale che passa attraverso la fetta intera entro ~ 30 sec. Ripetere questo passaggio come necessario per massimizzare il numero di neuroni isolati ottenibili da una regione del cervello dato.
- Rimuovere la punta dal fetta - raccogliere la fetta con una pinza e scuoterla delicatamente mentre è ancora in soluzione - quindi rimuovere fetta completamente e scartare.
- Consentire alle cellule dissociate di stabilirsi e di aderire al fondo piatto per almeno 10 min.
4. Registrazione elettrofisiologiche
- Porre la capsula che contiene i neuroni sul palcoscenico di un microscopio invertito e visualizzare con 10 x di 63 x obiettivo. Cercare i neuroni con una membrana brevetto liscio, non blebbing, e un nucleo rilevabile, ma non di grandi dimensioni. Se ottica a contrasto di fase sono utilizzate, per cercare di fase luminosa neuroni con una sfumatura giallo-, non troppo blu. Superfuse cellule con soluzione extracellulare contenente sali desiderato, sostanze nutritive, antagonisti dei recettori, ecc (il nostro standard è la soluzione salina HEPES-buffered di cui sopra (sezione 3.1)), spesso integrato con 5 mM 2,3-diosso-6-nitro-1, 2,3,4-tetrahydrobenzo [f] chinossalina-7-sulfonamide mM disodico (NBQX) e 25-100 D-2-amino-5-phosphonopentanoic acido (AP5) per bloccare i recettori del glutammato ionotropici che consente l'isolamento di digiuno GABA Un recettore-mediata iPSCs 1,2.
- Tirare una micropipetta normale cerotto con un estrattore Flaming-Brown o equivalente. Pipetta resistenza punta dovrebbe essere di 2-4 MΩ (a seconda delle dimensioni delle cellule bersaglio) quando è riempita con un Cl - - soluzione basata.
- Stabilire una cellula intera registrazione da un neurone osservata con tecniche elettrofisiologiche.
- Record spontanee correnti post-sinaptiche (sPSCs) con un gap-free di acquisizione dati di protocollo. Applicare 0,2-1 mM tetrodotossina e / oa basso Ca 2 + - che contiene la soluzione extracellulare per registrare in miniatura correnti post-sinaptiche (MPSCS).
- Soluzioni e agenti farmacologici può essere applicato direttamente alle cellule. Noi usiamo superfusione locali da fuso piazza punta tubi di vetro con scambio soluzione che comporti il movimento laterale del tubo montato su un motore passo-passo-driven micromanipolatore. Questo alloera per lo scambio di soluzione in 10s a 100s di ms per ottenere rapidi cambiamenti extracellulare contenuto molecolare, l'applicazione di agonisti del recettore, ecc
- Akaike e colleghi hanno sviluppato tecniche per stimolare singolo boutons presinaptica 3,4. Una micropipetta è posizionato vicino a una bouton visualizzati e la stimolazione è data (correnti stimolo negativo di 5-10 μA, 0,1-0,2 ms di durata). IPSCs unitario sono registrati, e metodi come il metodo di guasti può essere utilizzato per esaminare i cambiamenti nella funzione presinaptica e postsinaptica.
5. Terminali Imaging Presinaptico
- Neuroni postsinaptici possono essere riempiti con coloranti diversi tramite la pipetta di patch. I neuroni possono essere fatte anche da topi che esprimono proteine fluorescenti (PQ), come la proteina fluorescente verde (GFP) in selezionati popolazioni cellulari.
- Terminali presinaptici possono essere visualizzati sui neuroni vibrodissociated a base di topi che esprimono PQ nelle popolazioni interneurone particolare. Per esempio, i topi che esprimono GFP guidata dal glutammato decarbossilasi 65 (GAD65) mostrano somata promotore verde e dei processi nelle cellule dell'ippocampo basket e altri interneuroni. Vibrodissociated neuroni piramidali della regione CA1 dell'ippocampo sono GFP-positive terminali degli assoni apposto la loro somata e dendriti prossimali (Figura 1A). Neuroni piramidali vibrodissociated da topi che esprimono synaptopHlourin (un pH-sensibile GFP mutante fusa alla vescicola sinaptica associata alla proteina VAMP2) sotto il controllo del promotore Thy1 anche boutons FP-positivo allegato che mostrano fluorescenza sensibile al pH (Figura 1B).
- Boutons presinaptico può essere caricato con coloranti indicatore di calcio e di altre molecole fluorescenti con AM-esterificati composti 5. La Figura 2 mostra un esempio di carico con il calcio-colorante indicatore Fluo4-AM. In primo luogo, 1-2 mM AM-esterificati colorante viene applicato ai neuroni a 37 ° per 10 min. Colorante in grado di penetrare nell'ambiente intracellulare, dove esterasi fendere la molecola, dando libero, colorante cellule impermeant e inappagata. Questo approccio carichi sia gli elementi pre-e post-sinaptici cellulare. Dopo il caricamento, le cellule vengono lavate con HEPES-soluzione salina tamponata e mantenuta a 37 ° per altri 10 min. Prima di effettuare un GΩ-sigillo con un elettrodo pipetta di vetro, le cellule vengono risciacquati 3 volte con esterni soluzione tamponata.
- Una cellula intera registrazione è stabilita utilizzando un colorante senza soluzione intracellulare. Dopo 2-5 minuti di registrazione, il colorante è in gran parte rimossa dal neurone postsinaptico, consentendo la visualizzazione di boutons sinaptica Fluo-4-caricate. Questa tecnica è stata introdotta da Ye et al 5.
- Il colorante-caricato boutons possono poi essere visualizzati con un alto ingrandimento, alto obiettivo apertura numerica sia con un microscopio fotocamera-based o multiphoton. Simultanea a cellula intera registrazione e l'imaging di calcio può essere raggiunto utilizzando una configurazione come mostrato nella Figura 3. Le immagini del neurone e boutons mostrato nella figura 2C sono stati catturati con un dispositivo elettronico moltiplicando accoppiamento di carica (EMCCD) fotocamera. La potenza della sorgente di luce per l'eccitazione era attenuato a 1,2% con un filtro a densità neutra 1,0 e un filtro iris regolata al 12% in uscita. Transitori di calcio dal verde boutons presinaptico possono essere osservati e registrati in tempo reale, e misurato non in linea.
6. Rappresentante dei risultati:
Spontanea e corrente di iniezione-Evocati dei neuroni Vibrodissociated
Registrazioni da una tipica vibrodissociated neuroni piramidali CA1 dell'ippocampo sono mostrati in Figura 4A. Potenziali d'azione spontanei superamento può essere osservato nei neuroni piramidali dissociato dal ratto basolaterale dell'amigdala, dell'ippocampo e VTA 1,5. Durante il corso-clamp registrazioni da neuroni piramidali CA1, iperpolarizzante iniezione di corrente produce risposte tensione tipica, mentre le correnti depolarizzanti di ampiezza sufficiente suscitare potenziali d'azione superamento con il modello tipico cottura ritardato con moderati livelli attuali e non ospitare potenziali d'azione in risposta alla forte iniezione di corrente ( Figura 4B).
Spontanea e in miniatura GABAergici correnti inibitorie postsinaptici nei neuroni Vibrodissociated
Durante voltage-clamp registrazioni con un CsCl soluzione basata intracellulare, spontaneo correnti sinaptiche sono osservati (Figura 5A). Questi eventi sono eliminati in basso contenenti calcio soluzione di 2,6, e nella maggior parte dei tipi di neuroni sono completamente bloccate da antagonisti dei recettori GABA A come bicucullina o gabazine (Figura 5B, C), indicando che questi sono sIPSCs mediata dal rilascio di GABA e l'attivazione di questo sottotipo recettoriale ionotropici. Tuttavia, nei neuroni principali da regioni cerebrali come l'amigdala basolaterale 2 e l'area ventrale tegmentale 5,7, blocco dei recettori GABA Arivela EPSCs durata inferiore glutammatergica mediata dall'attivazione di recettori AMPA-tipo. È interessante notare che l'applicazione di TTX a concentrazioni che sono specifici per il blocco della maggior parte della tossina sensibili voltaggio-dipendenti canali del sodio riduce la frequenza e l'ampiezza del sIPSCs osservato nei neuroni vibrodissociated da regioni cerebrali diverse (Figura 6A) 2,4,7. Così, l'attività del canale sodio partecipa a rilascio di GABA nel boutons sinaptica pizzicato-off. Non è ancora chiaro se in piena regola potenziali d'azione di sodio si verificano in questi terminali. Vale la pena notare che la resistenza di ingresso di un ben chiuso 1 terminale assone diametro mM è probabile che sia anche nella gamma GΩ. Così, l'apertura anche di un piccolo numero di canali del sodio potrebbe essere sufficiente per depolarizzare terminali per attivare i canali di calcio che mediano la secrezione di accoppiamento eccitazione. A proposito di questi canali del calcio, l'evidenza suggerisce che N e P / Q-type canali partecipare a rilasciare ai terminali GABAergici nella preparazione vibrodissociated da CA1 dell'ippocampo e altrove 8.
Modulazione e la plasticità della trasmissione da una serie di neurotrasmettitori e recettori è stata esaminata utilizzando i neuroni vibrodissociated 3,4,9. I neurotrasmettitori dimostrato di avere le azioni modulatori quali sono adenosina, GABA, serotonina, gli endocannabinoidi, ecc 2,6,10,11,12. Inoltre, a breve termine plasticità sinaptica, come endocannabinoide-dipendenti depolarizzazione indotta soppressione di inibizione (DSI) è stata descritta anche in questa preparazione 2,11. Questi risultati indicano che molte forme di recettore-mediata e trans-sinaptica segnalazione da neuromodulatori endogeni sono intatte nella preparazione vibrodissociated.
Transienti di calcio e di rilascio vescicolare Terminal Axon nella preparazione Vibrodissociated
Utilizzando il EMCCD attrezzato microscopio invertito descritto sopra, abbiamo esaminato transienti di calcio in terminali presinaptici nel vibrodissociated neurone-Bouton preparazione. La Figura 2 mostra carico cella con AM-esterificati diluizione colorante Fluo-4 e la successiva post-sinaptici in un neurone piramidale CA1 dell'ippocampo. Transienti di calcio spontanee sono osservati in alcuni coloranti pieno boutons mostrato come regioni di interesse (ROI) in Figura 6B. Applicazione di 1 mM tetrodotossina (TTX) elimina questi transitori spontanee, indicando che essi sono mediati dall'attivazione del voltaggio-dipendenti delle correnti di sodio che sono spontaneamente attivati in boutons, portando ad aumenti di calcio successive. L'aumento KCl extracellulare da 10 mm a 40 mm con lo scambio soluzione rapida produce un aumento della fluorescenza misurata in ROI che corrispondono ai terminali presinaptici (Figura 7A). Registrazione simultanea dal neurone postsinaptico viene utilizzato per monitorare sIPSCs e determinare se la frequenza di eventi è aumentato di alta depolarizzazione K + (Figura 7B).
Per visualizzare la fusione delle vescicole nel boutons presinaptico abbiamo utilizzato topi che esprimono il synaptopHlourin costruire sotto il controllo del promotore Thy1 (etichettato spH21 topi). SynaptopHluorin in un costrutto molecolare, in cui eclittica pHlourin (un mutante GFP con pH maggiore sensibilità) 12 è legato alla proteina associata vescicola membrana (VAMP2) 13. Questa disposizione colloca il motivo pHlourin nel lume delle vescicole dove l'ambiente relativamente acido spegne fluorescenza. Su fusione delle vescicole questo motivo è esposto l'ambiente più neutrale extracellulare con un conseguente aumento della fluorescenza a puncta che corrispondono a vescicole / terminali presinaptici. Vibrodissociation dei neuroni dell'ippocampo di topo spH21 permette la visualizzazione di puncta fluorescenti delle dimensioni e della posizione prevista per i terminali GABAergici (Figura 8A). L'applicazione delle high-K + - contenente soluzione esterna aumenta la fluorescenza in questi terminali, e questo effetto è bloccata in presenza di una soluzione esterna in cui è ridotto il calcio extracellulare a 0,2 mm (Figura 8B). Così, la depolarizzazione indotta aumento della fluorescenza sembra riflettere accoppiamento eccitazione-secrezione a livello delle sinapsi dei neuroni GABAergici nella preparazione-Bouton.
La capacità di misurare transienti di calcio presinaptico e la fusione delle vescicole nei terminali degli assoni del neurone-bouton preparazione ci permette di esaminare gli effetti di neuromodulatori, farmaci d'abuso e sui meccanismi di plasticità sinaptica presinaptici coinvolti nella secrezione di accoppiamento eccitazione-esocitosi e / endocitosi. Queste tecniche possono anche essere combinato con altri strumenti molecolari e geneticamente topi per esaminare il ruolo delle proteine particolare nella funzione presinaptica e la modulazione / plasticità.
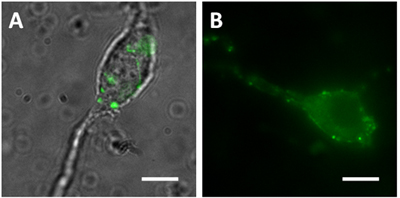
Figura 1. Vibrodissociated neuroni della regione CA1 dell'ippocampo (A) Fusione di immagine DIC uno° verde immagini di fluorescenza da un mouse GAD65. Immagine DIC è fusa per mostrare chiaramente le posizioni dei terminali verde (B) da una immagine a fluorescenza (spH21) topo synaptophluorin. Barra di scala = 10 micron

Figura 2 di calcio su indicatori procedura di caricamento: (A) cellula intera è caricata con AM-esterificati colorante; (B) a cellula intera registrazione diluisce colorante; (C) i terminali sono visualizzati come regioni di interesse (punte di freccia)..

Figura 3. Schema del setup sperimentale per il controllo simultaneo a cellula intera registrazione e immagini di calcio in terminali presinaptici in neuroni vibrodissociated. EMCCD = carica dell'elettrone moltiplicando dispositivo ad accoppiamento.

Figura 4. Rappresentante mostrando forme d'onda (A) potenziali d'azione spontanei da un neurone vibrodissociated CA1 e (B) le risposte potenziale di membrana a iperpolarizzante e depolarizzanti iniezioni di corrente in corrente-clamp registrazioni da un neurone CA1.
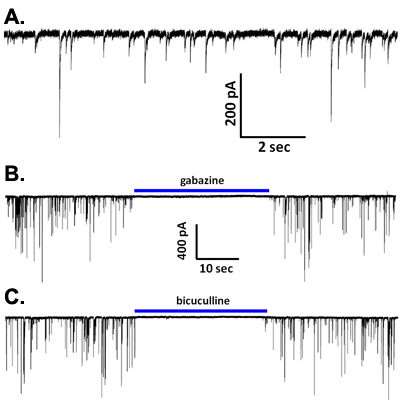
Figura 5. (A) Rappresentante di forme d'onda iPSCs spontanea da un neurone piramidale CA1. (BC) La iPSCs sono stati bloccati da entrambe le gabazine (10 mM; B) o bicucullina (20 mM; C).
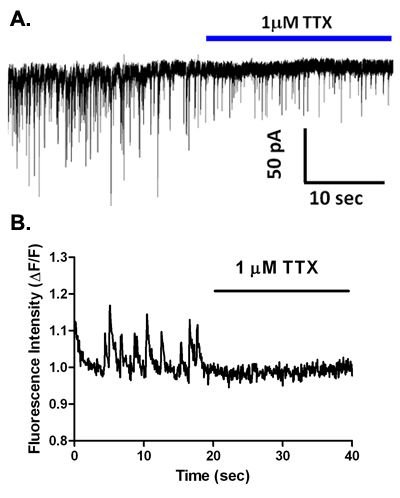
Figura 6. TTX inibisce spontanea la trasmissione sinaptica GABAergici, ed elimina i transitori di calcio presinaptico nella preparazione vibrodissociated dell'ippocampo. (A) Registrazione da un neurone vibrodissociated prima e durante l'applicazione TTX. Si noti la diminuzione della frequenza e l'ampiezza di sIPSCs. (B) transienti di calcio osservata in un Fluo-4-terminale presinaptico caricato su un neurone vibrodissociated prima e durante l'applicazione TTX. Si noti la perdita completa dei transitori.
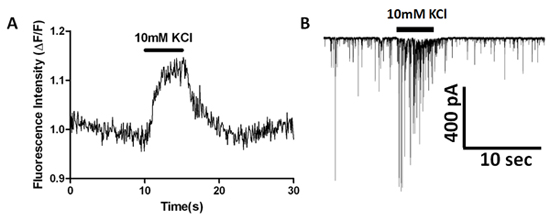
Figura 7. Simultanea di immagini indicatore di calcio e sIPSC a cellula intera registrazione che mostra gli effetti di alta K + stimolazione. (A) Fluorescenza misurati nel tempo da un bouton presinaptico caricato con Fluo-4:00 colorante. (B) contestuale aumento della frequenza e ampiezza sIPSC durante l'alta applicazione K +.

Figura 8. Ca 2 +-dipendente ad alta K + risposta boutons presinaptico di spH21 neuroni piramidali della regione CA1 dell'ippocampo. (A) immagine di fluorescenza di un neurone vibrodissociated. (B) High-K applicazione + (indicato dalla barra nera) ha determinato un aumento sostenuto della fluorescenza in presenza del nostro normale extracellulare di Ca 2 +, che contiene la soluzione (2 mM Ca 2 +). Nessun aumento è stato osservato fluorescenza a basso extracellulare di Ca 2 + (0,2 mM Ca 2 +). I dati nel grafico sono stati normalizzati per pre-high-k + i livelli di fluorescenza, e mostrano medio di risposta da 3 boutons.
Discussione
Vibrodissociation di successo richiede che le fette contengono neuroni sani e che gli spazi interstiziali sono sufficientemente flessibili da consentire neuroni per uscire dalla fetta senza danni tossici. Così, la tecnica funziona in modo ottimale alle prime età post-natale (P1-21), quando fette sano può essere fatto con materiali meno gliali / interstiatial che si trova a fette cervello adulto. Nella nostra esperienza, tuttavia, ottimizzando la preparazione fetta per la sopravvivenza neuronale nella fetta stesso può essere controproducente per la tecnica vibrodissociation. Mentre noi abitualmente preparare fette di registrazione in situ utilizzando freddo aCSF modificata, in cui saccarosio è stato sostituito per gran parte della Na + extracellulare e Ca 2 +, fette preparato per vibrodissociation possono essere preparati (per esempio taglio) nel nostro aCSF registrazione normale. Nel preparare fette per la registrazione da singoli neuroni nelle stesse fette abbiamo anche posto le fette in aCSF normale a 35 ° C subito dopo il sezionamento e lasciarli per 30-60 minuti a questa temperatura prima di tornare a temperatura ambiente. Tuttavia, fette preparato per vibrodissociation vengono spostati immediatamente a temperatura ambiente subito dopo taglio. Queste procedure forniscono un rendimento più elevato di neuroni sani dopo vibrodissociation, forse a causa della mancanza del tessuto interstiziale ditta che permette ai neuroni di essere più facilmente scosso allentato dalla stessa fetta. Non abbiamo modo esaustivo esame delle condizioni di preparazione fetta, come di routine ottenere neuroni sufficienti per la nostra registrazione ed esperimenti di imaging in un dato giorno. E 'possibile che ulteriori modifiche, come i cambiamenti nello spessore fetta o procedure preincubaton, potrebbe essere fatto per aumentare la produzione di neuroni sani. Trattamenti proteasi molto mite sono state provate in uno sforzo per aumentare la resa delle cellule e ottenere la tecnica di lavorare in animali anziani. Tuttavia, immancabilmente anche il trattamento della proteasi mite sembra disturbare la funzione sinapsi. Così, mentre la combinazione di proteasi e di dissociazione meccanica possono ancora essere trovati al lavoro non si è dimostrato affidabile in neuroni proencefalo fino ad oggi.
Va inoltre notato il rendimento relativamente basso di neuroni sani dopo vibrodissociation significa che la tecnica è soprattutto utile per lo studio abbondante sottotipi neuronali, soprattutto i neuroni di proiezione. La disponibilità di GFP-esprimere i topi in cui le piccole sottopopolazioni neuronali possono essere facilmente identificate aumenta la possibilità di studiare questi neuroni più rari. Tuttavia, a meno resa neuronale può essere migliorata notevolmente l'accumulo di dati su questi neuroni è probabile che sia relativamente lento.
Varie fasi hanno dimostrato di essere decisivo per il caricamento di successo di neuroni con il calcio-sensing coloranti. L'esposizione a AM-esterificati tintura viene eseguita a 37 ° C, e abbiamo avuto successo nel tentativo di tintura di carico a basse temperature. La concentrazione dei coloranti devono essere ottimizzati in termini di tempo di carico e la temperatura in quanto sembra che più alta concentrazione di colorante di caricamento abbassa la concentrazione di calcio nel boutons presinaptico. Abbiamo osservato che a concentrazioni più elevate di carico diminuisce la frequenza e l'ampiezza delle sIPSCs. Quando si carica sensibile al calcio, coloranti in terminali presinaptici di neuroni vibrodissociated, bisogna fare attenzione perché la capacità tampone del boutons piccolo presinaptico può essere diverso nel soma e le dimensioni dei boutons non sono coerenti. Neuron contenenti i piatti vengono lavati con HEPES-buffered soluzione esterna seguente colorante di caricamento e il tempo di recupero dopo il lavaggio è cruciale. Inoltre, per fare una buona tenuta per tutta la registrazione da cellula, le cellule devono essere accuratamente lavati per sbarazzarsi di molecole di colorante non interiorizzato dalla membrana cellulare esterna.
Oltre a utilizzare i neuroni vibrodissociated per l'imaging cellulare elettrofisiologia e di vivere, tecniche immunocitochimiche può essere applicato anche a queste cellule 11,12. Le celle possono essere facilmente fissate e colorate con una varietà di anticorpi, e marcatori cellulari di altri. L'utilizzo di queste cellule fornisce una preparazione pulita per la visualizzazione di espressione della proteina in GABAergico terminali presinaptici. Utilizzando topi che esprimono proteine fluorescenti sotto il controllo di promotori specifici per i neuroni GABAergici consente al ricercatore di identificare i singoli terminali sinaptici nella preparazione vibrodissociated (Figura 1). Marcatori fluorescenti immagini di questo tipo può consentire misurazioni morfologiche nei terminali utilizzando laser a base di microscopia e più recenti tecniche come STED (Emission Microscopy stimolazione Depletion). Visualizzazione con coloranti che riportano ciclismo delle vescicole sinaptiche è possibile anche con questa preparazione. Akaike e collaboratori hanno etichettato terminali GABAergici con il colorante styryl, FM1-43 per visualizzare i terminali nelle cellule viventi 4.
Dovrebbe anche essere possibile effettuare cella singola transcriptasi inversa PCR per profilo di espressione di RNA in vibrodissociatedneuroni. Questa tecnica è utilizzata abitualmente per enzimaticamente dissociati neuroni e neuroni cresciuti in coltura cellulare.
Divulgazioni
Riconoscimenti
Vorremmo riconoscere Drs. Ping Zhu e Susumu Koyama per la loro assistenza durante la configurazione iniziale della tecnica, e il Dr. Veronica Alvarez per l'assistenza nella formattazione del manoscritto. Questo studio è stato finanziato dalla Divisione di Intramurale Ricerca Clinica e Biomedica del NIAAA.
Materiali
| Name | Company | Catalog Number | Comments |
| Voce | Azienda | Catalogo | Commenti |
| Vibrante Slicer Tissue | Leica Microsystems Inc. | VT1200S | |
| Cellule Dish Cultura (35 mm) | BD Falcon | 353001 | |
| Fondo di Vetro Piatti | Willco-piatto | GWSB-5040 Oppure GWSB-3522 | 0,16-0,19 vetro mm di spessore per l'imaging |
| Manipolatore piezoelettrico | EXFO-Burleigh | LSS-3000 | Potrebbe anche usare relè, ecc |
| SD9 Piazza impulsi dello stimolatore | Grass Technologies | SD9K | Per l'attivazione manipolatore piezoelettrico |
| Dissezione stereoscopio | Selvatico Heerbrugg | TYP 374590 | Anche usare un'altra stereoscopio |
| Flaming / Brown micropipetta estrattore | Sutter strumento | P-97 | |
| Sottile parete di vetro Capillari | Mondo Strumenti di precisione | TW-150F-4 | Per la fiamma micropipetta di vetro sigillato e patch micropipetta |
| Sei Canale perfusione Valve Control Systems | Warner Instruments | VC-6 o VC-6M | |
| Perfusione Fast-Passo | Warner Instruments | SF-77B | |
| Microscopio invertito con obiettivi 20-63x | Nikon | TS200 Diaphot | |
| EMCCD Camera | ANDOR Tecnologia | ixon EM + DU-888 | |
| Eccitare fluorescenza illuminazione Light Source | EXFO Photonics Solutions Inc. | X-Cite 120PC | |
| Fluo-4, AM indicatore di calcio | Molecular Probes | F14201 |
Riferimenti
- Zhu, P. J., Lovinger, D. M. Ethanol potentiates gabaergic synaptic transmission in a postsynaptic neuron/synaptic bouton preparation from basolateral amygdala. J Neurophysiol. 96, 433-441 (2006).
- Zhu, P. J., Lovinger, D. M. Retrograde endocannabinoid signaling in a postsynaptic neuron/synaptic bouton preparation from basolateral amygdala. J Neurosci. 25, 6199-6207 (2005).
- Akaike, N., Moorhouse, A. J. Techniques: Applications of the nerve-bouton preparation in neuropharmacology. Trends Pharmacol Sci. 24, 44-47 (2003).
- Akaike, N., Murakami, N., Katsurabayashi, S., Jin, Y. H., Imazawa, T. Focal stimulation of single gabaergic presynaptic boutons on the rat hippocampal neuron. Neurosci Res. 42, 187-195 (2002).
- Ye, J. H., Wang, F., Krnjevic, K., Wang, W., Xiong, Z. G., Zhang, J. Presynaptic glycine receptors on gabaergic terminals facilitate discharge of dopaminergic neurons in ventral tegmental area. J Neurosci. 24, 8961-8974 (2004).
- Koyama, S., Matsumoto, N., Kubo, C., Akaike, N. Presynaptic 5-ht3 receptor-mediated modulation of synaptic gaba release in the mechanically dissociated rat amygdala neurons. J Physiol. 529, 373-383 (2000).
- Deng, C., Li, K. Y., Zhou, C., Ye, J. H. Ethanol enhances glutamate transmission by retrograde dopamine signaling in a postsynaptic neuron/synaptic bouton preparation from the ventral tegmental area. Neuropsychopharmacology. 34, 1233-1244 (2009).
- Murakami, N., Ishibashi, H., Katsurabayashi, S., Akaike, N. Calcium channel subtypes on single gabaergic presynaptic terminal projecting to rat hippocampal neurons. Brain Res. 951, 121-129 (2002).
- Zhu, P. J., Lovinger, D. M. Persistent synaptic activity produces long-lasting enhancement of endocannabinoid modulation and alters long-term synaptic plasticity. J Neurophysiol. 97, 4386-4389 (2007).
- Inada, H., Maejima, T., Nakahata, Y., Yamaguchi, J., Nabekura, J., Ishibashi, H. Endocannabinoids contribute to metabotropic glutamate receptor-mediated inhibition of gaba release onto hippocampal ca3 pyramidal neurons in an isolated neuron/bouton preparation. Neuroscience. 165, 1377-1389 (2010).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with ph-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptophluorin. Proc Natl Acad Sci U S A. 102, 6131-6136 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon