Method Article
Generazione e l'etichettatura di Murine osseo cellule dendritiche derivate dal midollo con nanocristalli Qdot per gli Studi inseguimento
In questo articolo
Riepilogo
Antigeni assorbimento delle cellule dendritiche e migrare verso gli organi immunitario di presentare antigeni alle cellule T trattati. Qdot nanocristalli etichettatura fornisce un segnale di lunga durata e stabile fluorescenti. Questo permette di tenere traccia delle cellule dendritiche a diversi organi mediante microscopia a fluorescenza.
Abstract
Le cellule dendritiche (DC) sono cellule che presentano l'antigene professionali (APC) ha trovato nei tessuti periferici e negli organi immunologiche come timo, midollo osseo, milza, linfonodi e placche di Peyer 1-3. DC presenti nel campione dei tessuti periferici dell'organismo per la presenza di antigeni, che occupano, di processo e presente nella loro superficie, nel contesto di molecole di istocompatibilità (MHC). Poi, antigene-caricato DC migrare verso gli organi immunologici quando queste presentano l'antigene ai linfociti T trattati innescare risposte immunitarie specifiche. Un modo per valutare le capacità migratorie di DCS è di etichettarli con coloranti fluorescenti 4.
Con la presente ci dimostrano l'utilizzo di nanocristalli Qdot fluorescenti di etichettare derivate dal midollo osseo murino DC. Il vantaggio di questa etichettatura è che Qdot nanocristalli in possesso di stabile e di lunga durata fluorescenza che li rendono ideali per la rilevazione di cellule marcate nei tessuti recuperati. Per fare questo, le prime cellule saranno recuperati dal zucchine osso murini e coltivate per 8 giorni in presenza di granulociti e macrofagi fattore stimolante le colonie al fine di indurre la differenziazione DC. Queste cellule verranno poi etichettati con Qdots fluorescente da breve incubazione in vitro. Cellule colorate possono essere visualizzati con un microscopio a fluorescenza. Le celle possono essere iniettati in animali da laboratorio, a questo punto o può essere in cellule mature al momento in incubazione in vitro con stimoli infiammatori. Nelle nostre mani, la maturazione DC non ha determinato la perdita di segnale fluorescente né colorazione Qdot influire sulle proprietà biologiche dei PVS. Una volta iniettato, queste cellule possono essere identificate in organi immunitario con la microscopia a fluorescenza seguenti dissezione tipici e le procedure di fissaggio.
Protocollo
1. Dissezione di femori e tibie del mouse e della cultura di cellule del midollo osseo
- Sacrificio 2 topi da CO 2 asfissia e con attenzione sezionare tibie e femori senza tagliare le estremità delle ossa.
- Pulire le ossa da tutti i tessuti attaccati utilizzando carta velina. Fare attenzione a non rompere le ossa.
- Sterilizzare le ossa per immersione in etanolo al 70% per 10 minuti in una capsula di Petri 35 millimetri. Da questo momento, il lavoro all'interno di una cappa di biosicurezza per evitare la contaminazione delle colture cellulari.
- Recuperare le ossa dal etanolo e lasciarli asciugare per 5 minuti in una capsula di Petri all'interno del cabinet biosicurezza.
- Tagliare i femori a metà, e la tibia con la sua punta più sottile. Infondere la parte interna dell'osso con 1 ml di terreno RPMI (senza siero ma con antibiotici) utilizzando una siringa sterile in una piastra di Petri sterile.
- La sospensione cellulare viene raccolto e lavato 2X in RPMI medio di 10 min centrifugazione in una provetta da 15 ml per centrifuga a 1.100 RPM in una centrifuga refrigerata (4 ° C) con un rotore oscillante.
- Dopo l'ultimo lavaggio, risospendere le cellule in 2 ml di tampone di lisi ACK e incubare per 5 minuti a temperatura ambiente per eliminare i globuli rossi.
- Aggiungere 13 ml di RPMI con 10% FBS, risospendere e lavare 2X in questo mezzo con le stesse impostazioni, come descritto in 1.6.
- Contare le celle, regolare a 2 x 10 5 cellule / ml con RPMI 10% FBS, e aggiungere rm-GM-CSF (20 ng / ml concentrazione finale) 5.
- Aggiungere 10 ml di questa sospensione ad una sterile, qualità microbiologica, 10 centimetri piatto di Petri, e la cultura in un incubatore CO 2 (37 ° C, 5% CO 2).
- Tre giorni dopo, aggiungere altri 10 ml di RPMI 10% FBS con 20 ng / l di rmGM-CSF a ciascuno dei piatti preparati.
- Tre giorni dopo, 10 ml di sospensione cellulare vengono recuperati da ciascuna piastra di Petri, centrifugato come in 1.6, risospeso nello stesso volume di RPMI 10% FBS con rmGM-CSF e restituito alla piastra Petri. Le cellule sono coltivate per 2 giorni aggiuntivi in CO 2 incubatore.
2. La raccolta e l'etichettatura dei PVS
- Dopo 8 giorni di coltura le cellule debolmente aderenti sono recuperati dal lavare i piatti di Petri con terreno fresco. Questo protocollo rende circa 2-4 x10 8 DC nelle nostre mani. Le celle possono essere analizzati per fenotipo DC mediante citometria di flusso.
- Cellule raccolte vengono poi etichettati con il kit 655 celle Qtracker Etichettatura rigorosamente seguendo le istruzioni del produttore.
- Abbiamo ottenuto ottimi risultati etichettatura derivate dal midollo osseo murino DC con Qdots ad una concentrazione 10 nM. Per fare questo, aliquote di componenti Etichettatura Qtracker cellulare Kit A e B sono mescolati in volumi uguali, incubate per 5 minuti a temperatura ambiente, e subito diluito 1 / 100 in un mezzo fresco con vortex per 30 s.
- A macchia 5 x 10 6 DC, mescolare 5 ml di ciascuno i componenti del kit A e B in una provetta Eppendorf e incubare per 5 minuti a temperatura ambiente. Quindi, aggiungere 1 ml di incubare RPMI 10% FBS, e vortex per 30 secondi.
- Aggiungere 0,5 ml di sospensione cellulare contenente 5 x10 6 DC, e incubare a 37 ° C per 60 min.
- Poi, lavare le cellule 2X in RPMI 10% FBS (1.100 rpm). Le celle possono essere risospese in RPMI per la cultura più o in PBS per l'iniezione nei topi sperimentali.
3. Valutazione della DC etichettati
- L'etichettatura delle cellule possono essere valutati mediante microscopia a fluorescenza. Per fare questo, una goccia di sospensione cellulare viene aggiunto a un vetrino da microscopio, coperta con un coprioggetto di vetro, e valutata con un microscopio a fluorescenza tenendo conto che questi Qdots hanno spettri di emissione e di eccitazione di 565 nm e 405-525nm, rispettivamente (Fig. 3 )
- A questo punto, le cellule etichettate può essere usata per iniettare gli animali, o la maturazione può essere indotta da incubando queste cellule per 48 ore (37 ° C, 5 CO 2) in presenza di LPS (100 ng / ml) e TNF-( 20 ng / ml). Fluorescente etichettatura non è influenzato dalla maturazione DC (Fig. 4).
4. Rappresentante dei risultati:
Con la presente abbiamo descritto come preparare derivate dal midollo osseo murino DC e come li etichettati con Qdots fluorescenti. Fig. 1 riassume la procedura per ottenere le cellule, mentre la fig. 2 mostra la procedura di etichettarli con Qdots. Come mostrato in fig. 3, quasi tutte le cellule sono etichettati da questa procedura, e questo non è influenzato dalla maturazione DC con fattori infiammatori (Fig. 4). Fig. 5 mostra che Qdot macchiato di DC (Fig.5a) si comportano simili a cellule non colorate quando vengono trattati con un cocktail infiammatorio. Entrambe le preparazioni cellulari similmente upregulate espressione delle molecole co-stimolatorie (Fig. 5b), e producono quantità simili di IL-6 (fig. 5c) e l'ossido nitrico (Fig. 5d) sugli stimoli maturazione. Questo concorda con preceOU dati pubblicati indicano che Qdot colorazione non influisce sulla capacità di DC di trasformarsi in cellule mature capaci di suscitare risposte immunitarie [6]. Queste cellule possono quindi essere utilizzati per l'iniezione animali da esperimento. Come mostrato in fig. 6, 2 giorni dopo l'iniezione endovenosa di DC etichettati in topi, siamo stati in grado di rilevare Qdot macchiato di cellule nella milza. Questo è anche in accordo con precedenti dati pubblicati mostrano l'utilizzo di nanocristalli Qdot per valutare la migrazione delle DC in vivo [6] di imaging non invasiva e di citometria a flusso.
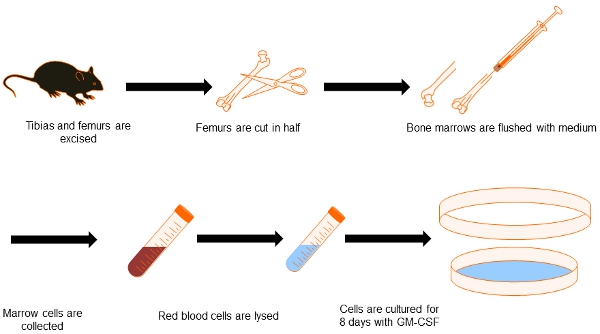
Figura 1. Diagramma di flusso della generazione di corrente continua dal midollo osseo. Con la presente si raffigurano il processo per ottenere dal midollo osseo DC. Entrambe le tibie e femori sono sezionati e puliti dal tessuto circostante. Suggerimenti ossa sono conservate e l'interno delle ossa sono lavata con media. Dopo aver eliminato i globuli rossi, le cellule del midollo osseo sono coltivate per 8 giorni in presenza di GM-CSF per differenziarle in PVS.
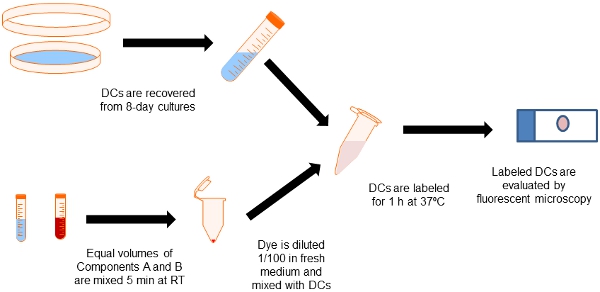
Figura 2. Diagramma di flusso della procedura di etichettatura. Aliquote uguali di componenti Etichettatura Qtracker cellulare Kit A e B sono mescolati in un tubo eppendorf. Le cellule dendritiche sono raccolti da culture osso di 8 giorni midollo con GM-CSF e miscelato con la tintura di etichettatura per 60 minuti a 37 ° C. Quindi le cellule vengono lavate in media per eliminare le particelle di etichettatura in eccesso.

Figura 3. Microfotografia fluorescente di DC subito dopo l'etichettatura. Una goccia di cellule marcate è stato depositato su un vetrino e coperta da un coprioggetto. Poi, i campioni sono stati valutati in un microscopio a fluorescenza e le immagini sono state acquisite attraverso un 5,0 Colore Micropublisher fotocamera digitale CCD (Qimaging, Surrey, BC Canada).
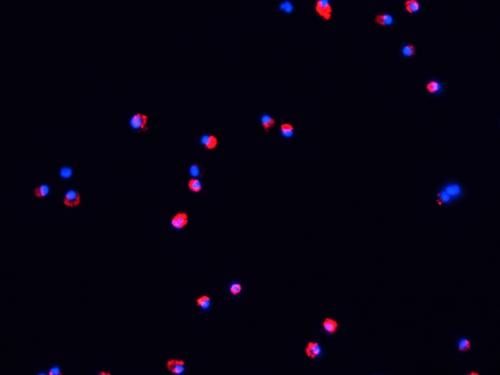
Figura 4. Microfotografia fluorescente di DC dopo 48 ore di maturazione in vitro. DC etichettati sono state coltivate per 48 ore con LPS (100 ng / ml) e TNF-α (20 ng / ml) su vetrini su un incubatore CO 2 (37 ° C, 5% CO 2). Poi, i campioni sono stati lavati con PBS (5 min, 2X), fissate con acetone (15, min 4 ° C) e di contrasto con DAPI. Le cellule sono state valutate in un microscopio a fluorescenza come sopra.
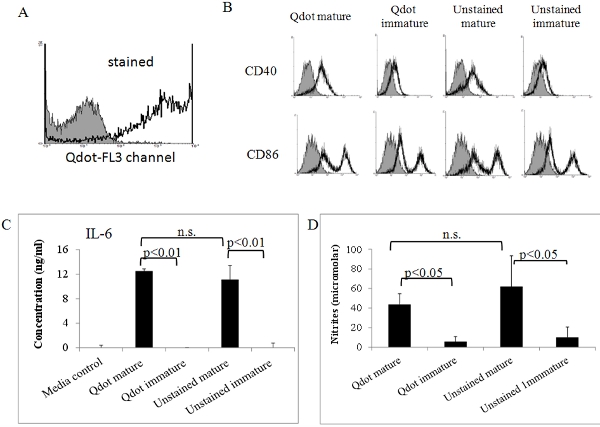
Figura 5. L'attività biologica del Qdot DC macchiato maturo. DC etichettati maturato in vitro di cui sopra sono stati analizzati mediante citometria di flusso (A) e (B). (A) Qdot macchiato di cellule dare un segnale forte nella (PerCP) canale FL3. Ombreggiato istogramma: controllo senza macchia. (B) DC Qdot macchiato e senza macchia sono stati ulteriormente colorate con anticorpi specifici contro la maturazione marker CD86 e CD40, e controlli isotipo. Le cellule sono state poi analizzate in un citofluorimetro FACSort (Becton Dickinson, San Jose, CA). Inoltre, IL-6 (C) e l'ossido nitrico (NO) sono stati determinati in surnatanti di maturità Qdot macchiati di DC e controlli. I livelli di IL-6 e l'ossido di azoto sono stati determinati per mezzo di analisi e test ELISA Griess come abbiamo descritto precedentemente 7, 8. Tutti i dati hanno mostrato in questa figura è rappresentativa di due o tre esperimenti indipendenti che mostrano risultati simili. I dati sono stati analizzati mediante ANOVA utilizzando il software GraphPad.
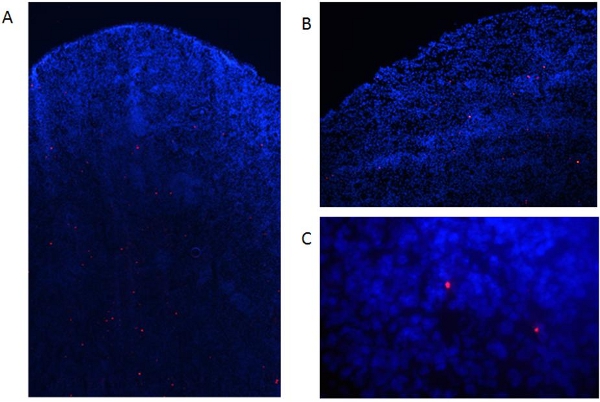
Figura 6. Rilevamento delle DC marcati nei tessuti sezionati. Etichettati DC mature (1x10 6 celle) sono state iniettate endovena in topi C57BL / 6. (A) Due giorni dopo i topi sono stati sacrificati e milza raccolti, congelati a scatto, integrati in ottobre, e 8 sezioni mM preparati utilizzando un criostato. Poi, i campioni sono stati fissati con acetone (15, min 4 ° C) e di contrasto con DAPI. Le cellule sono state valutate in un microscopio a fluorescenza come sopra Fig. 6a:. Ingrandimento 40X, Fig. 6b: ingrandimento 100X, fig. 6C, ingrandimento 400X.
Discussione
Murine mieloidi) DC sono stati ampiamente utilizzati per determinare l'efficacia e il miglioramento della DC a base di vaccini; indagare DC: le interazioni delle cellule T o di sviluppo corrente continua, e determinare il loro ruolo nelle varie patologie 9-11. Con la presente si mostra come generare DC da precursori recuperato zucchine osso di tibie e femori. Noi recuperare le ossa senza tagliare le punte, che ci permette di sterilizzare loro da immersione in etanolo al 70%, riducendo così la probabilità di contaminazione. Per differenziare i controller di dominio a partire da cellule del midollo osseo usiamo solo GM-CSF come descritto in precedenza 5. Anche se alcuni protocolli di utilizzare anche IL-4, è stato riferito che questa citochina non è necessaria quando si lavora con alti livelli di GM-CSF 12. Infatti, abbiamo già dimostrato che questi controller di dominio sono in grado di indurre risposte immunitarie 13. Inoltre, la cura deve essere presa per recuperare le cellule solo vagamente aderente da 8 giorni di culture lavando i piatti di Petri con il mezzo da quando le cellule allegato mostrano un fenotipo più monociti-like. Qui si mostra l'etichettatura dei PVS con particelle fluorescenti Qdot. Tale etichettatura ha alcuni vantaggi rispetto ad altri metodi. In primo luogo, le particelle Qdots sono facilmente incorporato nelle cellule. In secondo luogo, il segnale fluorescente è molto alta e non è influenzata dal maturazione DC. In terzo luogo, la fluorescenza non è persa quando le cellule o tessuti sono fissati con solventi come l'acetone, contrariamente a quanto succede se GFP è usato per codificare DC 14, dando maggiore flessibilità al momento di scegliere protocolli di colorazione. Infine, il segnale di fluorescenza ad alta dato da queste particelle permette di visualizzare le cellule dei tessuti, nonostante l'auto-fluorescenza. Come descritto in precedenza 6, colorazione Qdot non ha influenzato la capacità di maturazione di queste cellule. Con la presente ci dimostrano che Qdot macchiati DC si comportano in modo simile a come non macchiato DC, upregulating molecole co-stimolatorie, e la produzione di IL-6 e l'ossido nitrico in risposta a stimoli infiammatori. Sebbene DC sono cellule specializzate nello scatenare la risposta immunitaria, hanno dimostrato di partecipare in condizioni patologiche come il cancro e l'aterosclerosi 4, 15, 16. Sono stati inoltre affermato di partecipare al processo di angiogenesi 17, 18, anche suggerito come strutturalmente partecipare alla sviluppo di nuovi vasi 19, 20. Così, i metodi che permettono di DC monitoraggio in vivo, e determinare la loro localizzazione geografica in diversi tessuti 4, 21, 22 sono molto preziosi.
Divulgazioni
Riconoscimenti
Questo lavoro sostenuto in parte dal NIH sotto Grant CA137499 R15-01 (PC) e un fondo di avvio da Ohio State University (FB).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| C57BL / 6 topi | Jackson laboratori | Le femmine, 6-8 settimane di età | |
| RPMI | Invitrogen | 11875-119 | |
| Siero fetale bovino, qualificato | Invitrogen | 10437-028 | |
| Antibiotico-antimicotico | Invitrogen | 15240-096 | |
| PBS | Invitrogen | 10010-049 | |
| Buffer di lisi ACK | Lonza Walkersville, Inc | 10-548E | |
| Ricombinante murino GM-CSF | Peprotech Inc | 315-03 | |
| Qtracker 655 celle Kit Etichettatura | Invitrogen | Q25021MP | |
| Lipopolisaccaride | Invivogen | tlrl-eblps | |
| Ricombinante murino TNF alfa | Peprotech | 315-01A | |
| Anticorpi CD86 | BD Biosciences | 553691 | |
| Anticorpi CD40 | BD Biosciences | 553791 | |
| Sistema reagente Griess | Promega | G2930 | |
| IL-6 la cattura anticorpale | eBioscience | 13-7061-81 | |
| IL-6 rilevazione degli anticorpi | eBioscience | 13-7062-81 |
Riferimenti
- Banchereau, J., Briere, F., Caux, C., Davoust, J., Lebecque, S., Liu, Y. J., Pulendran, B., Palucka, K. Immunobiology of dendritic cells. Annu Rev Immunol. 18, 767-811 (2000).
- Bonasio, R., von Andrian, U. H. Generation, migration and function of circulating dendritic cells. Curr Opin Immunol. 18, 503-511 (2006).
- Lanzavecchia, A., Sallusto, F. The instructive role of dendritic cells on T cell responses: lineages, plasticity and kinetics. Curr Opin Immunol. 13, 291-298 (2001).
- Conejo-Garcia, J. R., Benencia, F., Courreges, M. C., Kang, E., Mohamed-Hadley, A., Buckanovich, R. J., Holtz, D. O., Jenkins, A., Na, H., Zhang, L. Tumor-infiltrating dendritic cell precursors recruited by a beta-defensin contribute to vasculogenesis under the influence of Vegf-A. Nat Med. 10, 950-958 (2004).
- Lutz, M. B., Kukutsch, N., Ogilvie, A. L., Rossner, S., Koch, F., Romani, N., Schuler, G. An advanced culture method for generating large quantities of highly pure dendritic cells from mouse bone marrow. J Immunol Methods. 223, 77-92 (1999).
- Noh, Y. W., Lim, Y. T., Chung, B. H. Noninvasive imaging of dendritic cell migration into lymph nodes using near-infrared fluorescent semiconductor nanocrystals. Faseb J. 22, 3908-3918 (2008).
- Benencia, F., Courreges, M. C., Conejo-Garcia, J. R., Mohamed-Hadley, A., Zhang, L., Buckanovich, R. J., Carroll, R., Fraser, N., Coukos, G., Franco, L. G. HSV oncolytic therapy upregulates interferon-inducible chemokines and recruits immune effector cells in ovarian cancer. Mol Ther. 12, 789-802 (2005).
- Gilboa, E., Vieweg, J. Cancer immunotherapy with mRNA-transfected dendritic cells. Immunol Rev. 199, 251-263 (2004).
- Grolleau-Julius, A., Abernathy, L., Harning, E., Yung, R. L. Mechanisms of murine dendritic cell antitumor dysfunction in aging. Cancer Immunol Immunother. 58, 1935-1939 (2009).
- Yrlid, U., Svensson, M., Johansson, C., Wick, M. J. Salmonella infection of bone marrow-derived macrophages and dendritic cells: influence on antigen presentation and initiating an immune response. FEMS Immunol Med Microbiol. 27, 313-320 (2000).
- Lutz, M. B., Schnare, M., Menges, M., Rossner, S., Rollinghoff, M., Schuler, G., Gessner, A. Differential functions of IL-4 receptor types I and II for dendritic cell maturation and IL-12 production and their dependency on GM-CSF. J Immunol. 169, 3574-3580 (2002).
- Benencia, F., Courreges, M. C., Coukos, G. Whole tumor antigen vaccination using dendritic cells: comparison of RNA electroporation and pulsing with UV-irradiated tumor cells. J Transl Med. 6, 21-21 (2008).
- Probst, H. C., Tschannen, K., Odermatt, B., Schwendener, R., Zinkernagel, R. M., Van Den Broek, M. Histological analysis of CD11c-DTR/GFP mice after in vivo depletion of dendritic cells. Clin Exp Immunol. 141, 398-404 (2005).
- Fainaru, O., Adini, A., Benny, O., Adini, I., Short, S., Bazinet, L., Nakai, K., Pravda, E., Hornstein, M. D., D'Amato, R. J., Folkman, J. Dendritic cells support angiogenesis and promote lesion growth in a murine model of endometriosis. Faseb J. 22, 522-529 (2008).
- Bobryshev, Y. V., Lord, R. S., Rainer, S., Jamal, O. S., Munro, V. F. Vascular dendritic cells and atherosclerosis. Pathol Res Pract. 192, 462-467 (1996).
- Nakai, K., Fainaru, O., Bazinet, L., Pakneshan, P., Benny, O., Pravda, E., Folkman, J., D'Amato, R. J. Dendritic cells augment choroidal neovascularization. Invest Ophthalmol Vis Sci. 49, 3666-3670 (2008).
- Huarte, E., Cubillos-Ruiz, J. R., Nesbeth, Y. C., Scarlett, U. K., Martinez, D. G., Buckanovich, R. J., Benencia, F., Stan, R. V., Keler, T., Sarobe, P. Depletion of dendritic cells delays ovarian cancer progression by boosting antitumor immunity. Cancer Res. 68, 7684-7691 (2008).
- Fernandez Pujol, B., Lucibello, F. C., Zuzarte, M., Lutjens, P., Muller, R., Havemann, K. Dendritic cells derived from peripheral monocytes express endothelial markers and in the presence of angiogenic growth factors differentiate into endothelial-like cells. Eur J Cell Biol. 80, 99-110 (2001).
- Gottfried, E., Kreutz, M., Haffner, S., Holler, E., Iacobelli, M., Andreesen, R., Eissner, G. Differentiation of human tumour-associated dendritic cells into endothelial-like cells: an alternative pathway of tumour angiogenesis. Scand J Immunol. 65, 329-335 (2007).
- Bobryshev, Y. V., Lord, R. S. Mapping of vascular dendritic cells in atherosclerotic arteries suggests their involvement in local immune-inflammatory reactions. Cardiovasc Res. 37, 799-810 (1998).
- Bobryshev, Y. V., Lord, R. S. Co-accumulation of dendritic cells and natural killer T cells within rupture-prone regions in human atherosclerotic plaques. J Histochem Cytochem. 53, 781-785 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon