È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Ricostituzione in vitro di Active T. castaneum telomerasi
In questo articolo
Riepilogo
Gli sforzi per isolare la subunità catalitica della telomerasi, TERT, in quantità sufficienti per studi strutturali, sono stati accolti con scarso successo da oltre un decennio. Qui, vi presentiamo i metodi per l'isolamento dei ricombinanti Tribolium castaneum TERT ( Tc TERT) e la ricostituzione del principio attivo T. castaneum Ribonucleoproteina telomerasi (RNP) complesso In vitro.
Abstract
Gli sforzi per isolare la subunità catalitica della telomerasi, TERT, in quantità sufficienti per studi strutturali, sono stati accolti con scarso successo da oltre un decennio. Qui, vi presentiamo i metodi per l'isolamento dei ricombinanti Tribolium castaneum TERT (Tc TERT) e la ricostituzione del T. attivo castaneum telomerasi ribonucleoproteina (RNP) complessi in vitro.
La telomerasi è una trascrittasi inversa specialisti 1 che aggiunge ripete DNA brevi, chiamate telomeri, porre fine al 3 'dei cromosomi lineari 2 che servono per proteggerli da end-to-end di fusione e di degrado. A seguito di replicazione del DNA, un breve segmento è perso alla fine del cromosoma 3 e senza telomerasi, le cellule continuare a dividere fino alla fine raggiungendo il limite Hayflick 4. Inoltre, la telomerasi è latente nella maggior parte delle cellule somatiche 5 in adulti, ma è attiva nelle cellule tumorali 6, dove si promuove l'immortalità delle cellule 7.
L'enzima telomerasi minimo è costituito da due componenti principali: la subunità proteiche (TER), che comprende la subunità catalitica dell'enzima e parte integrante di RNA (TER), che contiene il TERT modello utilizza per sintetizzare i telomeri 8,9. Fino al 2008, solo le strutture per i domini telomerasi individuo era stato risolto 10,11. Un importante passo avanti in questo campo è venuto dalla determinazione della struttura cristallina dei 12 attivi, subunità catalitica di T. castaneum telomerasi, Tc TERT 1.
Qui, vi presentiamo i metodi per la produzione di grandi quantità del principio attivo, TERT solubile Tc per studi strutturali e biochimici, e la ricostituzione del complesso RNP telomerasi in vitro per analisi attività della telomerasi. Una panoramica dei metodi sperimentali utilizzati è mostrata in Figura 1.
Protocollo
1. Espressione di ricombinante TERT Tc
- Inoculare 6 L di 2YT multimediali (6 x 2 L Perplesso beute contenenti 1 l di brodo 2YT in ciascuno) da sei piatti freschi di cellule trasformate pLysS Rosetta (DE3) contenente la sintesi Tc TERT plasmide con un TEV cleavable N-terminale hexahistidine- tag.
- Crescere le cellule a 37 ° C sotto agitazione a 220 rpm in un OD 600 di 0,5-0,6.
- Indurre l'espressione delle proteine con l'aggiunta di 1 mM IPTG.
- Ridurre la temperatura a 30 ° C, lenta agitazione a 150 rpm, e consentono alle cellule di esprimere la proteina per 4-5 h.
- Celle di raccolta per centrifugazione a 4 ° C e 3500 rpm per 30 min.
- Risospendere ogni L 1 pellet di cellule in 20 ml di tampone contenente 25 mM Tris, pH 7,5, 10% glicerolo, 0,5 M KCl, 15 mM imidazolo, 5 mM β-mercaptoetanolo, e 0,1 mM fenilmetil sulfonil fluoruro (PMSF) e benzamidine.
- Flash congelare risospeso miscela di cellule dal lento stillicidio delle cellule in un tubo di plastica da 50 ml conica riempita con azoto liquido in modo che ogni goccia si blocca al momento dell'impatto nel liquido N 2. Conservare cellule congelate a -80 ° C fino al momento di purificazione delle proteine.
2. Purificazione del Tc TERT
- Scongelare le cellule a temperatura ambiente fino a consistenza liquida viene raggiunta e poi passare a bicchieri di metallo in ghiaccio per sonicazione.
- Sonicare cellule in ghiaccio per 2 minuti a intervalli di 30 secondi con 30 secondi si ferma, a circa 51 W di potenza.
- Spin down cellule lisate a 18.000 rpm per 20 min per separare le frazioni proteiche solubili e insolubili e rimuovere con attenzione il sopranatante per cromatografia Nickel affinità.
- Equilibrare la Ni-NTA (nichel-nitrilotriacetico acido) colonna con tampone contenente 25 mM Tris, pH 7,5, 10% glicerolo, 0,5 M KCl, 15 mM imidazolo, 5 mM β-mercaptoetanolo, e 0,1 mM PMSF e benzamidine.
- Carico surnatante sopra la resina e raccogliere il flusso attraverso.
- Lavare la colonna con tampone contenente 25 mM Tris, pH 7,5, 10% glicerolo, 500 mM KCl, 15 mM imidazolo, 5 mM β-mercaptoetanolo, e 0,1 mM PMSF per rimuovere tutte le proteine residue e non specificamente legato.
- Eluire Tc TERT del Ni-NTA resina utilizzando un gradiente di imidazolo di 15 - 300 mm e raccogliere 3 frazioni ml per l'analisi SDS PAGE.
- Utilizzare l'analisi PAGE per determinare quali contengono frazioni proteiche Tc TERT e concentrare queste frazioni in un Amicon 30 kDa (Millipore) filtro.
- Concentrato Tc frazioni TERT ad un volume inferiore a 10 ml per un'ulteriore purificazione.
- Il TERT Tc è ulteriormente purificato nel corso degli colonna a scambio cationico (HS poros, Applied Biosystems) pre-equilibrata con tampone contenente 25 mM Tris, pH 7,5, 10% glicerolo, 500 mM KCl, 1 mM DTT.
- Caricare il mix di proteine sulla colonna HS poros e lavarlo per rimuovere tutte le proteine e acidi nucleici contaminanti.
- Lavare la colonna con tampone contenente 500 mM KCl seguita da 700 mM KCl per rimuovere eventuali contaminanti rimanenti.
- Eluire la proteina Tc TERT fuori la colonna HS poros con buffer di 1 M KCl. A questo punto la proteina deve essere superiore al 99% puro.
- Rimuovere eventuali aggregati proteici passando la proteina in un Superdex-200 colonne dimensionamento (dimensione esclusione cromatografia - GE Healthcare), pre-equilibrata con tampone contenente 25 mM Tris, pH 7,5, 10% glicerolo, 500 mM KCl, 1 mM TCEP.
3. Tribolium castaneum scarabeo cultura
- Il T. castaneum coleotteri dove inizialmente come un dono dal Dott. S. Brown, Divisione di Biologia, Kansas State University.
- Inizio T. cultura castaneum con l'aggiunta di 100 coleotteri adulti a un contenitore con 28,5 g di farina e 1,5 g di lievito secco panettiere.
- Conservare culture scarabeo a temperatura ambiente e in un ambiente buio e umido per tre o quattro settimane per consentire la riproduzione e la crescita. Posizionare un bicchiere contenente acqua nella zona di stoccaggio coleottero per assicurare un ambiente umido.
- Raccogliere le larve scarabeo come necessario per l'isolamento di RNA. Lasciare le larve ancora a maturare agli adulti, mantenendoli nella stessa cultura.
- Ogni mese, trasferire i coleotteri più attivi (non più di un centinaio) in un pallone nuovo contenente farina e lievito fresco per ricostituire il loro approvvigionamento di cibo.
4. T. castaneum RNA totale isolamento
- Vendemmia 20 larve di scarabeo dalla cultura (ogni cultura dovrebbe contenere da 500-1000 larve), separandoli da coleotteri adulti e la farina / lievito madre. Eliminare le particelle di farina o lievito attaccato al scarabei prima della macinazione di loro.
- Sterilizzare l'area panchina, la malta e il pestello (si pensi trattare i guanti pure) utilizzato per questa procedura con RNaseZap (Ambion, Inc.) per rimuovere tutte le tracce di ribonucleasi prima della macinatura i coleotteri.
- Grind larve in N 2 liquido in una polvere fine con un mortaio e pestello e transfer la polvere in una provetta da centrifuga da 50 ml, mantenendo il liquido N 2 per garantire che la polvere rimane congelato fino a quando il tampone di estrazione è aggiunto.
- Lasciare che il liquido in eccesso N 2 a evaporare dalla polvere. Dopo che il liquido è evaporato N 2, omogeneizzare la polvere coleottero in 200 ml di tampone di estrazione (per 20 larve di scarabeo) contenente 25 mM Tris-HCl, 5 mM β-mercaptoetanolo, 1 mM EGTA, 0,1 benzamidine mm, 200 mm KCl, 10 % glicerolo, 10 mM imidazolo e 20U di RNasin, pH 7,5 e incubare in ghiaccio per 30 minuti.
- Centrifugare l'omogeneizzato a 15.000 rpm per 20 minuti a 4 ° C, raccogliere il surnatante e flash congelare il campione in un liquido N 2. Se necessario, i campioni possono essere conservati a -80 ° C durante la notte.
- Estrarre l'RNA totale secondo il RNeasy Mini Kit (Qiagen).
5. Ricostituzione in vitro della telomerasi castaneum Tribolium
- Mix 20 mg di ricombinante His-tag Tc TERT con 50 ml di T. castaneum RNA totale nel buffer vincolante contenente 25 mM Tris-HCl, 200 mM KCl, 10% glicerolo, 5 mM β-mercaptoetanolo, e 10 mM imidazolo, pH 7,5.
- Incubare la TERT Tc - miscela di RNA totale per due ore a 22 ° C in T. lisato castaneum in presenza di inibitore RNasin per evitare la degradazione dell'RNA.
- Purificare il complesso nel corso di un Ni-NTA colonna per rimuovere le impurità lisato e RNA in eccesso.
6. Ripetere il protocollo di amplificazione telomerasi (TRAP) test
- Mix 4 mg di Ni-NTA purificata T. telomerasi castaneum in 50 microlitri allungamento tampone contenente 20 mM Tris-HCl (pH - 8,3), 7,5 mM MgCl 2, 63 mM KCl, 0,05% Tween 20, 1 mM EGTA, 0,01% BSA, 0,5 mM dNTPs, 1 mM TCAS-TS DNA primer (5'-AAGCCGTCGAGCAGAGTC-3 '), e incubare la miscela a 30 ° C per 60 minuti per consentire l'allungamento degli ACT-TS fondo DNA dal ricostituito T. castaneum telomerasi.
- Estrarre il allungata DNA a singolo filamento (ssDNA) con l'aggiunta di un uguale volume di fenolo cloroformio alla miscela di reazione. Agitare la miscela delicatamente fino a quando l'emulsione è omogenea.
- Centrifugare il campione a 12.000 giri per cinque minuti a 4 ° C per separare il ssDNA da sostanze contaminanti.
- Trasferire lo strato superiore acquoso del campione in una provetta eppendorf da 1,5 ml, aggiungere una concentrazione finale di 10 mM NaOAc (pH 5,0), 1 mM di MgCl 2 e 66,4% EtOH e quindi consentire il campione di precipitare durante la notte a -20 ° C.
- Spin il campione a 15.000 rpm per 30 minuti a 4 ° C per far sedimentare il ssDNA precipitato. Decantare la soluzione con una pipetta e poi aggiungere 200 ml di EtOH 70% al campione di lavare rimanenti NaOAc e MgCl 2 dal campione. Centrifugare il campione per cinque minuti alla stessa velocità e la temperatura di ri-pellet del campione.
- Decantare la soluzione EtOH utilizzando una pipetta e rimuovere ogni traccia residua di etanolo, consentendo il tubo eppendorf di incubare aperto a temperatura ambiente per tre minuti. Avendo presente nel campione di etanolo interferisce con la fase di amplificazione PCR.
- Risospendere il pellet ssDNA (contenente il prodotto allungata telomerasi e il TCAS-TS primer) in 50 ml di tampone di reazione di PCR contenente 10 mM Tris-HCl (pH 8), 50 mM KCl, 2 mM MgCl 2, 100 mM dNTPs (dATP, dGTP e dTTP), 10 mM [32 P] dCTP, 1 mM TCAS-CX primer (5'-GTGTGACCTGACCTGACC-3 ') e 1,25 U di Taq DNA polimerasi.
- PCR amplifica i prodotti telomerasi allungamento (29 cicli di 94 ° C per 30 secondi, 50 ° C per 30 secondi e 72 ° C per 1 minuto), in modo che siano visibili su un gel di poliacrilamide al 12%.
- Pre-eseguire il gel al 12% con Tris-Borato-EDTA (TBE) in esecuzione tampone contenente Tris 44,5 mm, 44,5 mM di acido borico, 1 mM EDTA, pH 8 per trenta minuti prima di eseguire i campioni PCR. Dopo la pre-esecuzione e caricamento del gel con le reazioni di PCR, eseguire il gel a 185 volt per 1,5-2 ore a 4 ° C o su ghiaccio.
- Asciugare il gel e utilizzare la piastra ai fosfori di imaging per visualizzare l'attività.
7. Rappresentante dei risultati:
Un esempio di Tc purificato TERT dopo cromatografia dimensione esclusione è mostrato nella Figura 2. La proteina concentrata dopo la depurazione viene eseguito su un 12% di SDS-poliacrilammide gel ed è dimostrato di essere più puro al 99% (Figura 2A). L'esclusione dimensioni (S200) cromatogramma è prevista anche (Figura 2B) per dimostrare la purezza e la mancanza di inerti dal campione proteico purificato. Una resa di 5 mg di proteina dopo tutti i passaggi di purificazione sono stati completati e 'solitamente ottenuto anche se la resa finale può variare.
UNA TRAPPOLA saggio rappresentativo per il ricostituito T. telomerasi castaneum è mostrato in figura 3 come precedentemente riportato da Mitchell et al. 12. Il graduale scala di prodotti telomerasi può essere visto in corsia 1, tuttaviasono assenti in entrambe le telomerasi RNasi trattati e il sito attivo TERT mutante (D251A) campioni in corsie 2 e 3 rispettivamente.
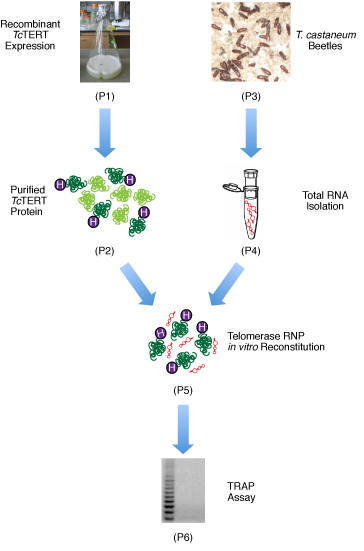
Figura 1. Diagramma di flusso delle fasi coinvolte nella ricostituzione della ricombinante Tc TERT. In primo luogo, il ricombinante Tc TERT è over-espressa in E. coli. La proteina viene poi purificato da nichel, di scambio cationico, e di esclusione cromatografia dimensioni. Il T. coleotteri castaneum sono coltivati in casa e le loro larve sono utilizzati per isolare l'RNA totale. Il Tc TERT purificato e l'RNA totale sono poi mescolati a ricostituire il complesso RNP telomerasi, e un saggio TRAP successivo è utilizzato per confermare il complesso RNP è un telomerasi attive.
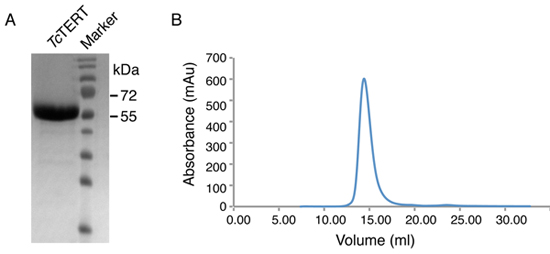
Figura 2. Dimensioni cromatogramma esclusione e analisi SDS PAGE di proteine Tc TERT. (A) 12% SDS-poliacrilammide gel della proteina Tc TERT dopo cromatografia dimensione esclusione. La proteina Tc TERT (70 kDa) migra più velocemente sul gel SDS PAGE perché ha un elevato punto isoelettrico (pI - 9,8). (B) cromatogramma esclusione Dimensioni (Superdex S200) della proteina Tc TERT.

Figura 3. Saggi TRAP del ricostituito in vitro Tribolium telomerasi castaneum adattato da Mitchell et al. 12. Corsia 1: wild type Tc TERT e RNA totale isolato da larve di scarabeo. Corsia 2: wild type Tc TERT e RNasi trattati RNA totale larve e estratti cellulari. Corsia 3: attivo il sito mutante Tc TERT (D251A) e larve di scarabeo larve RNA totale.
Access restricted. Please log in or start a trial to view this content.
Discussione
Il metodo presentato qui permette la produzione di grandi quantità della subunità catalitica di T. castaneum TERT telomerasi nelle solubile, forma attiva per studi strutturali e biochimici. Il metodo di Tc TERT sovra-espressione è sensibile ai cambiamenti sottili di temperatura o la densità delle cellule da quelle di cui sopra e possono influenzare notevolmente i livelli di espressione della proteina. In particolare, abbiamo trovato che inducono le cellule per l'espressione delle proteine ?...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Riconoscimenti
La ricerca qui presentata è stata supportata dal Dipartimento della Salute della Pennsylvania, Il Medical Ellison, V e I fondamenti Smeraldo.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
|---|---|---|---|
| Rosetta (DE3) plysS Cellule | Novagen | 70956 | |
| 2YT brodo | Teknova | Y0215 | |
| IPTG | Oro Biotecnologie | I2481C | |
| Misonix Sonicator 3000 | Qsonica, LLC. | ||
| Akta Purificatore FPLC | GE Life Sciences | ||
| Ni-NTA Superflow Resina | Qiagen | 30410 | |
| Amicon Ultra-15 dispositivo centrifuga Filtro | Millipore | UFC903008 | |
| POROS 50 HS scambio cationico forte Imballaggio | Applied Biosystems | 1-3359-06 | |
| POROS 50 HQ scambio cationico forte Imballaggio | Applied Biosystems | 1-2559-06 | |
| Superdex 200 10/300 Dimensione-esclusione Colonna | GE Life Sciences | 17-5175-01 | |
| Fenolo: cloroformio: Isoamyl 25:24:1 con 10 mM Tris, pH 8, 1 mM EDTA | Sigma | P3803-100 ml | |
| RNaseZap | Ambion | AM9780 | |
| Ricombinante l'inibitore della ribonucleasi Rnasin | Promega | N251B | |
| RNeasy Mini Kit | Qiagen | 74104 | |
| DNA oligonucleotidi | Integrated DNA Technologies |
Riferimenti
- Gillis, A. J., Schuller, A. P., Skordalakes, E. Structure of the Tribolium castaneum telomerase catalytic subunit TERT. Nature. 455, 633-637 (2008).
- Greider, C. W., Blackburn, E. H. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts. Cell. 43, 405-413 (1985).
- Harley, C. B., Futcher, A. B., Greider, C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 345, 458-460 (1990).
- Hayflick, L. The Limited in vitro Lifetime of Human Diploid Cell Strains. Exp Cell Res. 37, 614-636 (1965).
- Blackburn, E. H. Telomeres: no end in sight. Cell. 77, 621-623 (1994).
- Kim, N. W. Specific association of human telomerase activity with immortal cells and cancer. Science. 266, 2011-2015 (1994).
- Bodnar, A. G. Extension of life-span by introduction of telomerase into normal human cells. Science. 279, 349-352 (1998).
- Greider, C. W., Blackburn, E. H. The telomere terminal transferase of Tetrahymena is a ribonucleoprotein enzyme with two kinds of primer specificity. Cell. 51, 887-898 (1987).
- Greider, C. W., Blackburn, E. H. A telomeric sequence in the RNA of Tetrahymena telomerase required for telomere repeat synthesis. Nature. 337, 331-337 (1989).
- Jacobs, S. A., Podell, E. R., Cech, T. R. Crystal structure of the essential N-terminal domain of telomerase reverse transcriptase. Nat Struct Mol Biol. 13, 218-225 (2006).
- Rouda, S., Skordalakes, E. Structure of the RNA-binding domain of telomerase: implications for RNA recognition and binding. Structure. 15, 1403-1412 (2007).
- Mitchell, M., Gillis, A., Futahashi, M., Fujiwara, H., Skordalakes, E. Structural basis for telomerase catalytic subunit TERT binding to RNA template and telomeric DNA. Nat Struct Mol Biol. 17, 513-518 (2010).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon