Method Article
HLA-Ig celle in base Antigen Presenting artificiale per Efficiente Ex vivo Estensione dei diritti dell'uomo e CTL
In questo articolo
Riepilogo
Un nuovo metodo DC indipendente per l'induzione e l'espansione di antigene-specifica delle cellule T è descritta. HLA-A2 Ig Cellule artificiali basati Antigen Presenting (aAPC) vengono caricati con HLA-A2 peptidi limitato ad ampliare in modo efficace CTL di specificità antigenica diversi. Questa tecnologia ha un grande potenziale per CTL-immunoterapia adottiva.
Abstract
CTL con ottima funzione effettrice giocano un ruolo critico nel mediare la protezione contro varie infezioni intracellulari e cancro. Tuttavia, gli individui possono presentare soppressivi microambiente immunitario e, in contrasto con l'attivazione di CTL, le loro cellule autologhe che presentano l'antigene possono tendere a tolerize o anergize CTL antigene specifico. Come risultato, anche se ancora in fase sperimentale, CTL-immunoterapia adottiva si è evoluto fino a diventare un promettente trattamento per varie malattie come il cancro e le infezioni da virus. In esperimenti iniziali ex vivo ampliato CMV (citomegalovirus) CTL specifici sono stati utilizzati per il trattamento delle infezioni da CMV nei pazienti immunocompromessi trapianto allogenico di midollo osseo. Mentre è comune avere pericolose per la vita viremia CMV in questi pazienti, nessuno dei pazienti trattati ampliato CTL sviluppare malattie legate CMV, che implica l'anti-CMV immunità è stabilito dal adoptively trasferiti CTL 1. Risultati promettenti sono stati osservati anche per il melanoma e può essere estesa ad altri tipi di cancro 2.
Mentre ci sono molti modi per ex vivo stimolare e ampliare CTL umane, di approcci attuali sono limitati dai limiti di costo e tecnico. Ad esempio, il gold standard attuale si basa sull'uso di DC autologhe. Questo richiede che ogni paziente di donare un significativo numero di leucociti ed è anche molto costoso e laborioso. Inoltre, dettagliata caratterizzazione in vitro di DC ampliato CTL ha rivelato che questi hanno solo non ottimale funzione effettrice 3.
Qui vi presentiamo una efficiente sistema di aAPC base per l'espansione ex vivo di CMV umano CTL specifici per l'immunoterapia adottiva (Figura 1). Il aAPC sono state fatte da accoppiamento cellula magnetica con perline di dimensioni umane HLA-A2-Ig dimero e anti-CD28mAb 4. Una volta aAPC sono fatti, possono essere caricati con peptidi di interesse, e rimangono funzionali per mesi. In questo rapporto, aAPC sono stati caricati con un peptide dominante da CMV, pp65 (NLVPMVATV). Dopo coltura purificata umano CD8 + CTL da un donatore sano con aAPC per una settimana, aspirazione specifici CTL può essere aumentata drammaticamente nella specificità fino al 98% (Figura 2) e amplificato più di 10.000 volte. Se più CMV-specifici CTL sono richiesti, l'ulteriore espansione può essere facilmente ottenuto con stimolazione ripetitiva aAPC. Caratterizzazione fenotipica e funzionale mostra queste cellule espanse hanno fenotipo un effettore-memoria e una notevole quantità di entrambi TNFa e IFNγ (Figura 3).
Protocollo
1. Fare, HLA-A2-Ig base aAPC
- Preparare un tampone sterile borato
- Sciogliere l'acido borico in acqua per fare 0.1M. Regolare il pH a 7,0.
- Filtrare attraverso un filtro 0.22μm sterile e conservare a 4 ° C.
- Preparare tampone sterile Bead Lavare
- Prendere 956ml PBS w / o magnesio o di calcio.
- Aggiungere 30 ml di siero umano AB.
- Aggiungi EDTA concentrazione finale 2mm.
- Aggiungi 0.1gsodium azide.
- Filtrare attraverso un filtro di 0,22 micron sterile e conservare a 4 ° C.
- Prendere 1 ml di Invitrogen M-450 perle di resina epossidica a magazzino, circa 400 milioni di perline (sfere possono essere contati da emocitometro), e messo in una sterile, flaconcino di vetro tappo a vite.
- Mettete la fiala contro una calamita Dynal MPC-1, mentre le perline aderire al lato del flaconcino, togliere il surnatante tramite aspirazione. Lavare una volta con perle di 1 ml di tampone borato.
- Perline risospendere in una miscela di tampone borato da 1 ml e 20 mg di HLA-A2-Ig dimero e 20 mg di mAb anti-CD28 umano (clone 9,3).
- Proteine per coniugazione tallone: mettere il flacone di vetro sul rotore e ruotare a 4 ° C per 24 ore.
- Porre il tubo in MPC-1 magnete e rimuovere tutti tampone borato.
- Lavare le perle due volte con 1 ml di tampone di lavaggio Bead.
- Incubare le perline in 1 ml tampone di lavaggio perlina, ruotare a 4 ° C per 24 ore. Perché tampone di lavaggio contiene microsfere di siero umano AB, bloccherà tutto il sito residuo legame con le proteine sulla perline.
- Rimuovere il surnatante dal flacone di vetro, sostituire con 1 ml di tampone fresco Lavare Bead.
2. Controllo della qualità dei aAPC e peptide carico, stoccaggio
- Aggiungere ~ 5 × 10 5 perline di FACS 100μl tampone di lavaggio in tubi di FACS, e la macchia con 1ml di anti-mouse IgG1-PE (riconoscere la parte Fc di HLA-A2-Ig) e 1ml di anti-topo IgG2a-FITC (riconoscere la parte Fc di mAb anti-CD28). Dopo la colorazione per 20 minuti in FACS lavaggio tampone, lavare di nuovo e leggere il risultato colorazione immediatamente citofluorimetro (Figura 4).
- Peptide carico sul perle: lavare le perle due volte in flaconcino di vetro con 1 ml di PBS sterile. Risospendere con 1 ml di PBS sterile quindi aggiungere 10μl di CMV peptide (1mg/ml)
- Contare le perline da emocitometro, e l'etichetta del flaconcino con data e concentrazione.
- aAPC sono pronti per l'uso dopo almeno 3 giorni di incubazione peptide a 4 ° C, per consentire un tempo sufficiente di legame peptidico sul HLA-A2-Ig dimero. Le sfere possono essere conservato a 4 ° C e rimangono funzionali per almeno 6 mesi.
3. CTL isolamento umano
- Raccogliere ~ 100 ml di sangue fresco periferico di sano HLA-A2 donatore positivo in 10 tubi di eparina sodica Vacutainer BD. Utilizzare una 21-gauge o più grande per evitare l'emolisi.
- Centrifugare a 300xg per 10 minuti a temperatura ambiente
- Rimuovere con cura lo strato superiore al plasma per aspirazione. Il plasma può essere usato come supplemento per il terreno di coltura.
- Sostituire il plasma raccolto con PBS sterile e trasferire il sangue in una sterile T75 fiasco cultura o provette coniche da 50 ml. Mescolare il sangue con PBS ben pipettando su e giù.
- Una volta che tutto il sangue viene raccolto, preparare altri quattro tubi conici da 50 ml e aggiungere 15 ml di Ficoll-Paque Plus.
- Lentamente overlay 30-35ml di cellule del sangue sulla parte superiore del Ficoll di ciascun tubo. Mantenere l'interfaccia distinte tra Ficoll e le cellule del sangue.
- Centrifugare a 500xg per 20 minuti a temperatura ambiente. Girare il freno "off" e l'accelerazione più basso possibile di mantenere una chiara interfaccia tra gli strati.
- Usando una pipetta seriological, aspirare con cura lo strato PBMC e raccogliere il PBMC in una fresca 50ml tubo conico. Quando tutti i PBMC vengono raccolti aggiungere 30 ml di PBS e far girare a 400xg per 10 minuti. Scartare il surnatante e lavare una volta con 30 ml di PBS per rimuovere tutti i residui di Ficoll.
- Procedere alla isolamento delle cellule CD8 + T utilizzando Miltenyi umane CD8 + kit di isolamento delle cellule T secondo il protocollo del produttore. Questo kit arricchisce molto per CD8 + (di solito> 95%) mediante deplezione CD8 - cellule.
- Contare le cellule T CD8 +. La purezza attesi dovrebbero essere superiore al 95%. A conferma di ciò 2x10 uso 5 celle ed eseguire una CD4/3/8 analisi FACS. Il CTL rimanente può essere utilizzata subito per l'antigene specifico per la stimolazione aAPC oppure possono essere congelati per un uso futuro.
4. Nel sistema di coltura in vitro aAPC base
- Preparare un terreno di coltura
- Per TF (fattore di crescita delle cellule T, realizzato in laboratorio 4) 2X terreno di coltura: medium RPMI completo più il 5% del donatore autologo plasma e l'8% fattore di crescita delle cellule T. plasma autologo può essere sostituito da inattivato al calore umano siero AB.
- Risospendere 1 milioni CTL a 8ml di media cultura TF 2X più 8ml di completo media RPMI, aggiungere 1 × 10 6 aAPC, mescolare bene.
- Utilizzare un multi-canale pipetter alle cellule sulla piastra da 96 pozzetti U fondo piastre di coltura dei tessuti. (160 microlitri per pozzetto)
- Cellule in coltura a 37 ° C, 5% CO 2 incubater per 7 giorni. Nutrire le cellule il giorno 4 con 80 microlitri / e medio TF 2X.
- Le cellule sono pronte per essere raccolte il giorno 7. Dopo la raccolta, posto le cellule contro il magnete e rimuovere il vecchio aAPC.
- Specificità antigenica può essere determinata colorazione tetramero secondo il protocollo del produttore. Fenotipo colorazione e colorazione delle citochine intracellulari sono eseguite in conformità alle nostre 3 precedente studio.
- Cellule raccolte possono essere saltuariamente con aAPC di nuovo nelle stesse condizioni. Numero di cellulare e specificità antigenica è previsto un aumento dopo stimolazione ripetuta.
5. Rappresentante dei risultati:
Un esempio di aAPC dopo coniugazione HLA-A2 Ig e anti-CD28 è mostrata in Figura 4. Coniugazione di proteine di successo è evidente da un chiaro spostamento di colorazione degli anticorpi corrispondenti. Mentre la frequenza di specifici CTL CMV nel sangue periferico è tipicamente 0,5-1%, dopo una sola settimana di aAPC-mediata stimolazione, la specificità può raggiungere il 55 - 93% (Figura 2 e 3). L'espansione del CTL antigene specifico può essere molto variabile tra i diversi donatori, ma i risultati sono riproducibili all'interno dello stesso donatore. Per estrapolazione, l'espansione delle cellule CMV specifiche possono essere migliaia di volte rispetto ai livelli precursore direttamente ex vivo (dati non riportati). Colorazione intracellulare delle citochine (Figura 3) mostra che questi CTL espanso sono polifunzionali, piuttosto che esausto, dopo la coltura cellulare e la proliferazione prolungato significativo.

Figura 1. Diagramma di flusso rappresentante di aAPC espansione basata ex vivo di CTL umane per l'immunoterapia adottiva in HSCT allogenico
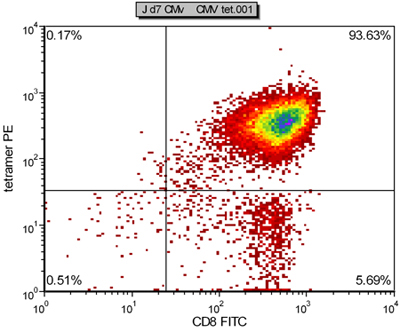
Figura 2. Rappresentante tetramero risultato colorazione dei CTL CMV specifiche generate da aAPC dopo una settimana di cultura
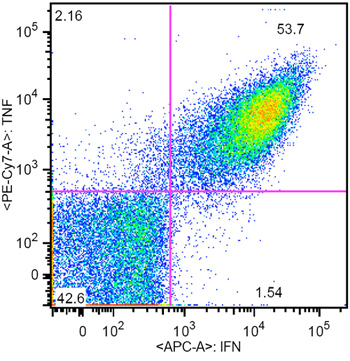
Figura 3. Rappresentante intracellulare risultato colorazione citochine di CTL CMV specifiche generate da aAPC (CMV è stata specificità 61%)
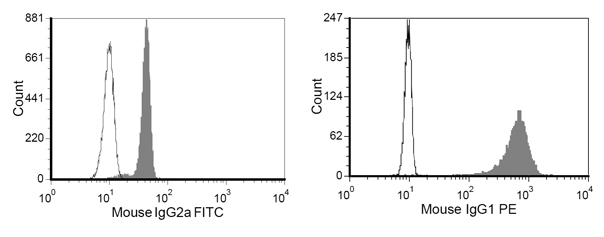
Figura 4. Risultato colorazione rappresentante di M-450 perle di resina epossidica dopo coniugazione di proteine colorate con anticorpi anti-mouse IgG1-PE e anti-mouse IgG2-FITC
Discussione
Il sistema aAPC che descriviamo qui è un sistema efficiente per l'espansione ex vivo di CTL umana contro una varietà di antigeni. Particolare cura deve essere presa per quanto riguarda la qualità della coniugazione di proteine e la distribuzione anche di aAPC e CTL nella cultura piastra da 96 pozzetti. Utilizzando questo approccio siamo stati in grado di espandere CTL per più di 8 settimane, durante i quali abbiamo ampliato antigene-specifici CTL fino a un milione di volte 4. Ci sono stati vari sistemi APC artificiali che utilizzano linee cellulari o altre piattaforme acellulare 5, tuttavia, secondo i dati pubblicati ogni sistema ha il suo profilo unico per quanto riguarda l'espansione e la specificità supportare le applicazioni differenti. Importante, poiché la qualità del CTL è importante quanto la quantità, la polifunzionalità del CMV-specifici CTL generati dal nostro sistema sono tenuti a conferire superiore anti-virale efficienza.
Divulgazioni
Riconoscimenti
Vorremmo ringraziare Aaron Selya di discussione utile. Questo lavoro è stato sostenuto da NIH concedere AI29575, CA108835, AI077097 a JS, una borsa di studio pilota della Johns Hopkins Malaria Research Institute e il Dipartimento della Difesa concedere PC di MO 040972
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente | Azienda | Numero di catalogo | |
|---|---|---|---|
| Vacutainer tubo (contiene eparina) | Becton Dickinson | 367874 | |
| Umane CD8 + kit di isolamento delle cellule T | Miltenyi | 130-094-156 | |
| Dynabeads M-450 epossidica | Invitrogen | 140,11 | |
| Dynal MPC-1 Magnete | Invitrogen | 120-01D | |
| Ficoll-Paque Plus. | GE Healthcare | 17-1440-03 | |
| RPMI 1640 medium | Gibco | 11875 | |
| HLA-A2-Ig dimero X | Becton Dickinson | 551263 | |
| iTAgMHC tetramero (HLA-A2-CMV)-PE | Beckman Coulter | T20099 | |
| Falcon 96-ben chiaro piastrina | Becton Dickinson | 353077 | |
| Ratto anti-topo IgG2a-FITC | Becton Dickinson | 553390 | |
| Capra anti-topo IgG1-PE | Invitrogen | P21129 | |
| Siero umano di tipo AB | Atlanta biologici | S40110 | |
| Topo anti-umano CD8a-FITC | Sigma-Aldrich | F0772 | |
| Topo anti-umano CD8a-APC | Becton Dickinson | 340684 | |
| Topo anti-umano IFNγ-FITC | Becton Dickinson | 340449 | |
| Topo anti-umana TNF-PE | Becton Dickinson | 340512 |
Riferimenti
- Walter, E. A. Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N Engl J Med. 333, 1038-1038 (1995).
- Rosenberg, S. A. Adoptive cell transfer: a clinical path to effective cancer immunotherapy. Nat Rev Cancer. 8, 3669-3669 (2008).
- Oelke, M. Ex vivo induction and expansion of antigen-specific cytotoxic T cells by HLA-Ig-coated artificial antigen-presenting cells. Nat Med. 9, 619-619 (2003).
- Oelke, M. Artificial antigen-presenting cells: artificial solution for real diseases. Trends Mol Med. 11, 412-412 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon