Method Article
Valutazione della captazione nanoparticelle nei tumori in tempo reale utilizzando intravitale Imaging
In questo articolo
Riepilogo
Vi presentiamo un nuovo approccio per quantificare la localizzazione delle nanoparticelle nei vasi di tumori umani xenotrapiantati utilizzando dinamica, imaging in tempo reale intravitale in un modello di embrione aviaria.
Abstract
Le attuali tecnologie per l'imaging del tumore, come l'ecografia, risonanza magnetica, PET e CT, sono in grado di produrre immagini ad alta risoluzione per la valutazione di assorbimento delle nanoparticelle nei tumori a livello microscopico 1,2,3, mettendo in evidenza l'utilità di un modello di xenotrapianto adeguata in cui per eseguire analisi dettagliate assorbimento. Qui, usiamo imaging ad alta risoluzione intravitale per valutare l'assorbimento delle nanoparticelle in xenotrapianti di tumori umani in un modello di embrione modificato senza guscio di pollo. Il modello di embrione di pollo è particolarmente adatto per queste analisi in vivo in quanto supporta la crescita di tumori umani, è relativamente poco costoso e non richiede anestesia o la chirurgia 4,5. Le cellule tumorali forma pienamente xenotrapianti vascolarizzato entro 7 giorni una volta impiantati nella membrana corioallantoidea (CAM) 6. I tumori risultanti sono visualizzati da non invasive di imaging in tempo reale e ad alta risoluzione che può essere mantenuta per un massimo di 72 ore con un impatto minimo su entrambi l'host o sistemi di tumore. Nanoparticelle con una vasta gamma di formati e formulazioni somministrato distale al tumore possono essere visualizzati e quantificabili, perché il flusso attraverso il flusso sanguigno, fuoriuscito da vasi sanguigni del tumore che perde, e si accumulano nella sede del tumore. Descriviamo qui l'analisi delle nanoparticelle derivate da virus del mosaico del Cowpea (CPMV) decorati con coloranti fluorescenti nel vicino infrarosso e / o polimeri di polietilene glicole (PEG) 7, 8, 9,10,11. Dopo somministrazione per via endovenosa, queste nanoparticelle virali sono rapidamente internalizzati dalle cellule endoteliali, con conseguente etichettatura globale del sistema vascolare sia all'esterno che all'interno del tumore 7,12. PEGilazione delle nanoparticelle virale aumenta la loro emivita plasmatica, si estende il loro tempo in circolazione, e migliora in ultima analisi, il loro accumulo nei tumori attraverso la maggiore permeabilità e ritenzione (EPR) effetto 7, 10,11. La velocità e il grado di accumulo di nanoparticelle in un tumore è misurata nel tempo utilizzando un software di analisi delle immagini. Questa tecnica fornisce un metodo per visualizzare e quantificare sia le dinamiche di nanoparticelle nei tumori umani.
Protocollo
1. Inoculazione di tumore in CAM embrione aviaria
- Preparare conchiglia meno embrioni di pollo fecondate, come descritto 8.
- Il 9 ° giorno di sviluppo embrionale, assemblare un micro-iniettore con un 18-gauge collegato su siringa da 1 ml. Tagliare un pezzo di 5-6 centimetri di tubo Tygon (1 / 32 "di diametro interno, 3 / 32" di diametro esterno, 1 / 32 "spessore della parete) e inserire con cautela bisello dell'ago nel tubo. Circa 4-5 cm di tubo dovrebbe si estendono dalla punta dell'ago (figura 1a).
- Riempire la siringa e il tubo con la sospensione cellulare. Quindi, inserire un ago di vetro microiniezione alla fine del tubo e con attenzione rimuovere eventuali bolle d'aria.
- Iniettare Giorno 9 embrioni (figura 1b) in un ambito di dissezione con un illuminatore con 10,000-100,000 cellule del cancro come un bolo all'interno del CAM (Figura 1c). Iniettare lentamente e con attenzione le cellule in modo che l'ago è nel posto giusto per le cellule di formare un bolo visibile all'interno della CAM. Le cellule che a goccia sulla superficie CAM può essere pulito con applicatore Kimwipe o altro.
- Ritorna embrioni incubatore umidificato a 38 ° C al 60% di umidità e permettere tumore di crescere e vascolarizzano (fino a 7 giorni).
2. Preparazione di nanoparticelle
- Per preparare fluorescente nanoparticelle CPMV per l'iniezione in embrione di pollo; diluire le nanoparticelle virale (come sintetizzato in 8 in PBS, pH 7,4, ad una concentrazione di 100 mg / ml miscela Vortex bene prima dell'uso e centrifugare per un minuto di togliere qualunque. aggregati. sonicazione può essere utile anche a seconda coniugati e il grado di aggregazione. Stock di CPMVs fluorescente sono stabili per almeno 1 anno se conservato a 4 ° C al buio. Controllare periodicamente le scorte da mettere un paio di gocce su un vetrino e controllo per fluorescenza. microscopia elettronica a trasmissione (TEM) può essere utilizzato anche per determinare se le particelle rimaste intatte dopo coniugazione.
- In breve, un microgrammo di nanoparticelle virale (in un volume finale di 2 mL) possono essere aggiunti alle reti in rame rivestito. Successivamente, aggiungere un uguale volume di acetato di uranile 2% per 1 minuto al microscopio elettronico (Philips EM 410).
3. Iniezione endovenosa di fluorescenza marcata con nanoparticelle virale
- Il Giorno 16, assemblare micro-iniettore come descritto sopra. Redigere il volume desiderato di nanoparticelle virale attraverso il tubo nella siringa (> 200 mL). Rimuovere con attenzione eventuali bolle d'aria. Inserire l'ago di vetro microiniezione alla fine del tubo. Assicurarsi che l'ago è lungo e affusolato possibile (Figura 2a). Se l'ago è troppo schietto, non sarà in grado di penetrare l'ectoderma e non riuscirà a penetrare il vaso. Se l'ago è troppo forte, la punta crollerà quando penetrare nei tessuti.
- Per via endovenosa iniettare 100 ml di 1 mg / ml di fluoresceina destrano (70.000 MW Da, Invitrogen) in embrione cuscinetto tumore distale dal sito desiderato da visualizzare (Figura 3d). Cannulazione successo della vena CAM è evidente dalla compensazione di sangue nel percorso del flusso di iniezione (Figura 2b). Valutare vascolare perdita 1 ora dopo l'iniezione.
- Iniettare per via endovenosa 50 ml di 1 mg / ml di soluzione di CPMV-Alexa Fluor 647 (CPMV AF-647) o pegilato CPMV-Alexa Fluor 647 (CPMV-PEG-AF 647) in embrioni contenenti i tumori con perdite vascolari distali dal sito desiderato essere visualizzati.
- Tumori immagine subito e ogni ora dopo l'iniezione utilizzando un microscopio Zeiss Examiner Z1 verticale dotata di un disco di Yokogawa filatura, Hamamatsu Imagem 9100-12 EM-CCD.
4. In tempo reale intravitale di imaging
- Per assemblare l'unità di riproduzione embrione, applicare un sottile strato di grasso per vuoto attorno alla circonferenza del porto di imaging sul lato inferiore del coperchio della fotounità embrione, e si adattano a 18 mm di vetro coprioggetto sul porto.
- Posizionare l'embrione in modo che il coprioggetto coprirà l'area desiderata per l'imaging. Abbassare lentamente il coperchio fino a quando il coprioggetto fa solo contatto con l'embrione, e quindi avvitare il coperchio sull'unità per tenerlo in posizione (Figura 2c).
- Aggiungere acqua riscaldata a 37 ° C all'interno dell'unità embrione di imaging fuori del piatto che contiene l'embrione, e poi si porta il complesso sulla scena di un microscopio confocale verticale con la camera interna ambientali equilibrati a 37 ° C.
- Posizionare l'unità di riproduzione che contiene l'embrione sotto il microscopio a fluorescenza Spinning disco confocale (Figura 2 sexies). L'unità imaging terrà l'embrione al suo posto e tenere il campo visivo durante l'acquisizione di immagini fisse, consentendo sia tridimensionale stack Z e time-lapse immagini da catturare. Noi acquisire e analizzare tridimensionale time-lapse immagini utilizzando Perkin Elmer (ex Improvvisazione) pacchetto software Volocity (Figura 3a). Acquisire ad alta risoluzione tridimensionale pila di vascolarizzazione del tumore e circostanti per visualizzare detailed analisi strutturale a specifici tempi punti. Acquisire tridimensionale pile a intervalli regolari di tempo i punti di mappa dettagliata dei cambiamenti strutturali nel sistema vascolare del tumore. Tumori immagine ogni ora dopo l'iniezione.
- Quantificare l'assorbimento delle nanoparticelle virale calcolando la media Alexa Fluor (AF) 647 del segnale all'interno di regioni selezionate nel tumore o nello stroma (non tumorali zona) software per immagini utilizzando la quantificazione come Volocity (Perkin Elmer). Il tumore al rapporto stroma è stato calcolato dividendo la media AF 647 segnale nel tumore oltre la media AF 647 segnale nello stroma. Un tumore / stroma rapporto superiore a 1 indica che la nanoparticella è stato preso dal tumore.
5. Rappresentante dei risultati:
Nell'esempio qui descritto, abbiamo iniettato le cellule HT-29 cancro al colon a formare un bolo di circa 1 mm di grandezza entro il giorno 9 CAM di embrioni di pollo (Figura 1b). Dopo l'inoculazione, gli embrioni sono stati coltivati per 7 giorni in un incubatore umidificato per consentire una crescita sufficiente e la vascolarizzazione del tumore (Figura 1c). Gli embrioni sono stati iniettati per via endovenosa con un peso di destrano a basso molecolare per confermare vascolarizzazione del tumore, ei tumori sono stati visualizzati al microscopio Zeiss AxioExaminer Z1 verticale (Figura 2d).
Dopo somministrazione endovenosa di CPMV-AF 647 o CPMV-PEG-AF 647 nanoparticelle (Figura 3a e b), ad alta risoluzione in tempo reale di imaging confocale (Figura 2 sexies) ha rivelato che sia CPMV e CPMV-PEG nanoparticelle rapidamente etichettato l'intero sistema vascolare, ma l'assorbimento di CPMV-PEG da parte del tumore è stata di circa 3 volte superiore CPMV dopo 12 ore (Figura 3a). L'assorbimento relativo di tumore nanoparticelle è stata determinata utilizzando software per l'analisi dell'immagine (Volocity da Perkin Elmer). Regioni di interesse sono stati selezionati all'interno e all'esterno del tumore (nel vano stromali) e l'intensità media di fluorescenza di ogni stato determinato. I dati vengono espressi come tumore / stroma rapporto.
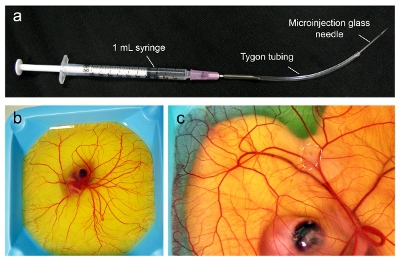
Figura 1. Microiniezione dei tumori nel CAM di un embrione aviaria. (A) L'apparecchio microiniezione viene assemblata dai componenti, come indicato. (B) gli embrioni aviaria al giorno 9 sono pronti per essere inoculati con tumore quando la CAM si è diffusa per coprire l'intera superficie. (C) Al giorno 16, il tumore è cresciuto fino a 1 cm di diametro (linea tratteggiata) ed è pronto per l'iniezione di nanoparticelle.
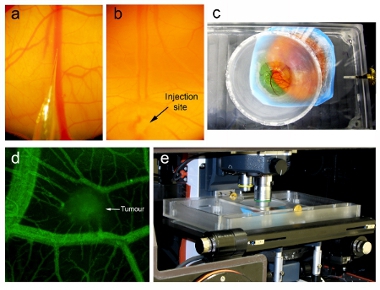
Figura 2. Iniezione di nanoparticelle e di imaging intravitale. Iniezione sotto un microscopio che mostra la dissezione (a) la punta dell'ago microinjector pronto per essere iniettato nella vena CAM e (b) l'ago microinjector inserito nella vena (indicato dalla freccia) e nanoparticelle iniettate nel flusso sanguigno (visto da compensazione di sangue). (C) Imaging unit contenente embrione aviaria con il coprioggetto interfacciato direttamente con il CAM. (D) Prima dell'iniezione nanoparticelle, vascolarizzazione tumorale viene valutata utilizzando l'imaging intravitale dopo l'iniezione di fluorescina destrano. (E) Imaging unit contenente l'embrione posizionato sul palcoscenico di un microscopio confocale in posizione verticale all'interno di una temperatura regolata impostata recinto a 37 ° C.
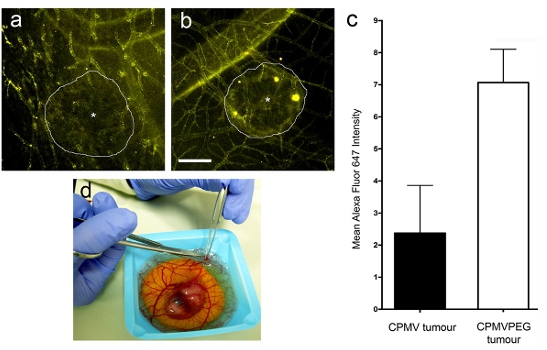
Figura 3. Visualizzazione intravitale di assorbimento delle nanoparticelle nei tumori umani. I tumori sono visualizzate 7 ore dopo l'iniezione di (a) CPMV-AF647 e (b) CPMV-PEG-AF647. d) Escissione del tumore dall'embrione aviaria per successive analisi.
Discussione
La membrana corioallantoidea (CAM) dell'embrione aviaria è un modello utile per valutare la dinamica vascolare e la farmacocinetica di tumori umani. La struttura e la posizione del CAM consente l'acquisizione di immagini di alta qualità e si adatta di molti generi di xenotrapianti tumorali senza procedure chirurgiche invasive. Inoltre, xenotrapianti tumorali del cancro impiantati nella membrana corioallantoidea diventare vascolarizzato entro 7 giorni, offrendo un rapido, poco costoso e mezzo semi-high-throughput per valutare l'accumulo di nanoparticelle nei tessuti tumorali. Dal xenotrapianti cancro impiantati nel CAM di shell-meno embrioni di pollo sono accessibili al ottica ad alta risoluzione di un microscopio confocale o verticale epifluorescenza, informazioni contestuali e temporali per quanto riguarda l'assorbimento delle nanoparticelle nel sistema vascolare del tumore può essere facilmente ottenuto. Xenotrapianti cancro in questo modello tendono a crescere lateralmente attraverso la CAM, provocando tumori che sono di grandi dimensioni pur rimanendo meno di 200 m di profondità. Questo li rende particolarmente adatto per l'imaging intravitale perché standard di microscopi epifluorescenza può effettivamente penetrare l'intera massa tumorale. Al contrario, i tumori impiantati in entrambi i siti superficiali o ortotopico all'interno del mouse proliferano in tre dimensioni, rendendo difficile localizzare con precisione le nanoparticelle in profondità all'interno di questi tumori con tecniche non invasive. Abbiamo utilizzato questo modello per valutare la diffusione di punti quantici, liposomi, nanoparticelle di ossido di ferro e in un certo numero di xenotrapianti tumorali umani, mettendo in evidenza il potenziale di questo modello per essere adatto per l'analisi in vivo di una vasta gamma di formulazioni di nanoparticelle.
Divulgazioni
Riconoscimenti
Questo studio è stato supportato da CCSRI di Grant # 700537 e CIHR Concessione # 84535 di JDL e NIH / NCI concedere # CA120711-01A1-01A1 e CA120711 ad AZ. Tutti gli esperimenti sono stati eseguiti in conformità con i regolamenti e linee guida della cura degli animali e utilizzo Comitato Istituzionale presso la University of California di San Diego, cura degli animali e Usa presso la University of Western Ontario.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente Nome / attrezzature | Azienda | Numero di catalogo | Commenti |
|---|---|---|---|
| Uova fecondate livorno | Frey `s Hatchery, St. Jacobs | N / A | |
| Dremel utensile rotante | Dremel | Può utilizzare qualsiasi modello | |
| Ruote di taglio Dremel no. 36 | Dremel | 409 | |
| Sportsman hatcher | Berry Hill | 1550HA | |
| Sportsman incubatore | Berry Hill | 1502EA | |
| Etanolo | 70% (vol / vol) | ||
| Polistirolo pesa barche | VWR | 12577-01 | |
| Piazza Petri | Simport, VWR | 25378-115 | |
| Rubbermaid contenitore in gomma con coperchio | Guillevin | RH3-228-00-BLU | fori in lati |
| Verticale pipetta estrattore | David Kopf Instruments | modello 720 | Impostazioni: 16,3 (riscaldamento) e 2.3 (solenoide) |
Sodio tubi in vetro borosilicato capillari | Sutter strumento | BF100-58-10 | (OD, 1,0 mm, ID 0,58 millimetri, 10 cm lunghezza) |
| 1X Dulbecco modificato (DMEM) | Invitrogen | 11995073 | |
| Dulbecco | Invitrogen | 14190250 | pH 7,4 |
| PBS (D-PBS) (1X), liquido | |||
| Tripsina, 0,05% (1X) 4NA con EDTA, liquido | Invitrogen | 25300054 | |
| Siero bovino fetale | Invitrogen | 12483-020 | Calore inattivare |
| Emocitometro | Hausser scientifico, VWR | 15170-090 | |
| Centrifuga | Eppendorf modello 5810R | 5811 000.010 | |
| Messa a punto di forcipe | VWR | 25607-856 | |
| Tygon R-3603 tubi | VWR | 63009-983 | 50 ft (1/32-inch diametro interno, 3/32-inch diametro esterno, spessore parete 1/32-inch |
| Aghi ipodermici per preparazioni iniettabili 18-gauge aghi | BD | 305195 | Scatola da 100 |
| Siringhe da 1 ml per preparazioni iniettabili | BD | 309602 | Scatola da 100 |
| Fibra ottica microscopio illuminatore | Amscope | HL 250-AY | 150W |
| Kimwipes | VWR | 10805-905 | |
| Semi V. unguiculata (California occhio nero no. 5) | Burpee | 51771A | |
| Luci di crescita interna | Sunlite, Alimentazione giardiniere | ||
| Metil-PEO4 NHS-estere | Perforare | PI22341 | |
| MPEG-NHS, PEG succinimidile estere, MW 2000 | NANOCS | PEG1-0002 | |
| Alexa Fluor 647 acido carbossilico (succinimidile estere) | Invitrogen | A20006 | |
| Oregon verde 488 Estere di succinimidile * 6-isomero * | Invitrogen | O-6149 | |
| Dimetilsolfossido (DMSO) | Sigma | D8418 | |
| Monoidrogeno fosfato dibasico | Sigma | 379980 | K2HPO4 (per il buffer phopshate) |
| Diidrogeno fosfato monobasico | P5655 | KH2PO4 (per il buffer phopshate) | |
| Superose 6 Dimensioni esclusione colonna | GE Healthcare delle scienze della vita | 17-0673-01 | |
| Akta Explorer 100 Cromatografo | GE Amersham Pharmacia | WS-AKTA100 | |
| Akta kit di alta portata | GE Healthcare delle scienze della vita | 18-1154-85 | |
| Saccarosio | Sigma | S0389 | |
| Ultracentrifuga | Beckman | ||
| Ti rotore SW 28 | Beckman | 342204 | Altalena secchio |
| 50,2 Ti rotore | Beckman | 337901 | Angolo fisso |
| Amicon Ultra-15 Unità di centrifuga Filtro | Millipore | UFC910008 | 100 kDa tagliare |
| In disuso | Biorad | ||
| destrano, fluoresceina, 70.000 MW, anionici | Invitrogen | D1823 | |
| Spinning microscopio a fluorescenza confocale disco | Quorum; Yokogawa CSU 10, Yokogawa | N / A | |
| Epifluorescenza a grande campo microscopio | Quorum; Zeiss Axio Examiner, Zeiss | N / A | |
| Hamamatsu Imagem 9100-12 EM-CCD | Quorum; Hamamatsu | N / A | |
| Unità di temperatura custodia per microscopio | Materie plastiche di precisione | N / A | |
| Vuoto grasso | VWR | 59344-055 | |
| Coprioggetto di vetro circolare nr. 1 (18 mm) | VWR | 16004-300 | |
| Volocity software | Perkin Elmer | ||
| Chick embrione recinto | abitudine fabbricata | ||
| Forbici delicato | VWR | 25608-203 | |
| Formalina | Bioshop | FOR201.500 | Uso in fumehood |
| Taglio ottimale | Fisher; Tissue Tek | 1437365 | |
| Temperatura (OCT) | |||
| Stampi di plastica | Pescatore | 22-038217 | |
| VWR VistaVision HistoBond adesivo diapositive | VWR | 16004-406 | |
| Prolungare oro con DAPI | Invitrogen | P36931 | |
| Lame monouso per criostato | Pescatore | 12-634-2 | |
| Criostato | Leica CM 3050 S | 14047033518 |
Riferimenti
- Halin, C., Mora, J. R., Sumen, C., von Andrian, U. H. In vivo imaging of lymphocyte trafficking. Annu Rev Cell Dev Biol. 21, 581-603 (2005).
- Judenhofer, M. S. Simultaneous PET-MRI: a new approach for functional and morphological imaging. Nat Med. 14, 459-465 (2008).
- Weissleder, R., Pittet, M. J. Imaging in the era of molecular oncology. Nature. 452, 580-589 (2008).
- Chambers, A. F., Ling, V. Selection for experimental metastatic ability of heterologous tumor cells in the chick embryo after DNA-mediated transfer. Cancer Res. 44, 3970-3975 (1984).
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clin Exp Metastasis. 22, 225-236 (2005).
- Zijlstra, A., Lewis, J., Degryse, B., Stuhlmann, H., Quigley, J. P. The inhibition of tumor cell intravasation and subsequent metastasis via regulation of in vivo tumor cell motility by the tetraspanin CD151. Cancer cell. 13, 221-234 (2008).
- Lewis, J. D. Viral nanoparticles as tools for intravital vascular imaging. Nature medicine. 12, 354-360 (2006).
- Leong, H. S. Intravital imaging of embryonic and tumor neovasculature using viral nanoparticles. Nature protocols. 5, 1406-1417 (2010).
- Chatterji, A. New addresses on an addressable virus nanoblock; uniquely reactive Lys residues on cowpea mosaic virus. Chemistry & biology. 11, 855-863 (2004).
- Brunel, F. M. Hydrazone ligation strategy to assemble multifunctional viral nanoparticles for cell imaging and tumor targeting. Nano letters. 10, 1093-1097 (2010).
- Steinmetz, N. F., Manchester, M. PEGylated viral nanoparticles for biomedicine: the impact of PEG chain length on VNP cell interactions in vitro and ex vivo. Biomacromolecules. 10, 784-792 (2009).
- Steinmetz, N. F., Cho, C. F., Ablack, A., Lewis, J. D., Manchester, M. CPMV nanoparticles target surface vimentin on cancer cells. Nanomedicine. , (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon