Method Article
Trasduzione di cellule umane con Polymer-complessato Lentivirus Ecotropic per Enhanced biosicurezza
In questo articolo
Riepilogo
Lentivirus sono un valido strumento di ricerca per esplorare la funzione del gene, tuttavia, i ricercatori potrebbero voler evitare la produzione di codifica lentivirus pantropic oncogeni noti o sospetti. In alternativa, vi presentiamo un protocollo più sicuro per l'utilizzo del lentivirus ecotropic su cellule umane modificate per esprimere la mSlc7a1 ecotropic recettore.
Abstract
Staminali tumorali e studi di biologia cellulare spesso richiedono trasduzione virale delle cellule umane con oncogeni noti o sospetti, sollevando problemi di sicurezza maggiori per il personale di laboratorio. Lentivirus Pantropic, come comunemente utilizzati VSV-G pseudotype, sono uno strumento prezioso per studiare la funzione del gene perché possono trasdurre molti tipi di cellule, comprese le cellule non si dividono. Tuttavia, i ricercatori potrebbero voler evitare la produzione e la centrifugazione di virus oncogeni pantropic codifica per esigenze di più alto livello la gestione di biosicurezza e le questioni di sicurezza. Diversi oncogeni potenti, tra cui c-Myc e SV40 T antigene di grandi dimensioni, sono noti per aumentare la produzione di cellule staminali pluripotenti indotte (IPSC). Tutti gli altri noti cambiamenti genetici che inducono IPSC (Oct4, Sox2, Klf4, Nanog, LIN28, e la perdita della funzione di p53) hanno anche i link al cancro, che li rende di preoccupazione per la sicurezza relativamente elevata.
Anche se questi tumori correlati virus sono utili per studiare la riprogrammazione cellulare e pluripotenza, devono essere usati in modo sicuro. Per affrontare questi problemi di biosicurezza, abbiamo dimostrato un metodo per la trasduzione di cellule umane con lentivirus ecotropic, con enfasi sulla riduzione dei costi e gestione conveniente. Abbiamo prodotto lentivirus ecotropic con titolo sufficientemente elevato per trasdurre superiore al 90% del esprimono i recettori delle cellule umane esposte al virus, convalidando l'efficacia di questo approccio.
Lentivirus è spesso concentrata per ultracentrifugazione, tuttavia, questo processo richiede diverse ore e può produrre aerosol infettivi a uomo ricercatori biomedici. In alternativa, le particelle virali possono essere più sicuro sedimentano sulla cellule per complessazione con solfato di condroitina e polibrene (CS / PB). Questa tecnica aumenta il titolo funzionale virale fino a 3 volte nelle cellule che esprimono stabilmente recettore retrovirus murino, con trascurabili tempo aggiunto e costo. Trasduzione di fibroblasti cutanei umani (HDFS) è al massimo migliorata utilizzando CS / PB concentrazioni di circa 4 volte inferiore al valore ottimale riportato in precedenza per le linee di cellule tumorali, suggerendo che la concentrazione polimero deve essere titolato per il tipo di destinazione delle cellule di interesse. Abbiamo quindi descritto l'uso di methylthiazolyldiphenyl-tetrazolio bromuro (MTT) al dosaggio per la tossicità dei polimeri in un nuovo tipo di cellula. Osserviamo vitalità equivalente di HDFS dopo trasduzione virale utilizzando complessazione polimero o la dose standard di polibrene (PB, 6 mg / ml), con l'indicazione minima tossicità acuta.
In questo protocollo, si descrive l'utilizzo di lentivirus ecotropic per la sovraespressione di oncogeni nelle cellule umane, riducendo i rischi di biosicurezza e l'aumento del tasso di trasduzione. Abbiamo anche dimostrare l'uso di complessazione polimero per migliorare la trasduzione, evitando di aerosol centrifugazione formazione di particelle virali.
Protocollo
1. Lentivirus production, harvest, and freezing
- Consult your institutional safety official before beginning this protocol, and follow their recommended safety guidelines.
- Day 1. Start with healthy, rapidly growing 293T cells to produce virus. Plate the cells at 5 x 106 cells per 10 cm plate. Use antibiotic-free 293T medium (high-glucose DMEM with 10% FBS and 4 mM L-glutamine) for virus production.
- Day 2. In the late afternoon, transfect 293T cells as follows (numbers given are for one 10 cm plate). Let all reagents warm up to room temperature. Pipette 375 μl OptiMEM into a microcentrifuge tube, then add 25 μl Fugene HD. Do not allow undiluted Fugene to contact the surface of the tube.
- In a microcentrifuge tube, mix:
- 5 μg transfer plasmid (Slc7a1, target vector, or fluorescent control vector)
- 3.75 μg packaging plasmid (pCMV-dR8.91 or psPax2)
- 1.25 μg envelope plasmid (pMD2.G for pantropic, pHCMV-EcoEnv for ecotropic)
- serum-free OptiMEM to 100 μl
- Combine the two tubes and incubate the mixture 20-30 minutes at room temperature.
- Change the medium on the 293T cells to 10 ml fresh antibiotic-free 293T medium. Add the Fugene/plasmid mix drop-wise to the plate and incubate overnight at 37°C, 5% CO2.
- Day 3. Change medium on the 293T cells to 10 ml fresh antibiotic-free 293T medium. Be gentle, because 293T cells adhere only loosely and can slough off by media pipetted too forcefully onto the monolayer. Incubate for two days in a humidified incubator for virus production.
- Day 5. Harvest virus and filter with a 0.45 mm low protein binding filter. Use immediately or dispense into single-use aliquots and freeze at -80°C. Frozen pantropic and ecotropic virus should be re-titered after it has been stored for six months and one month, respectively.
- Titer the virus as follows, using cells that are relatively amenable to transduction. Transduce cells with fluorescent control virus overnight using serial dilutions (e.g. 1:10, 1:100, 1:1000) in fresh medium with 6 μg/ml PB. Change to fresh medium the next day. Allow the cells two days after transduction to begin expressing the fluorescent protein, then determine the fraction of transduced cells by FACS. Calculate the titer in transforming units (TU) per ml, based on dilutions that yield < 15% transduction to minimize multiple transduction events.

2. Transduction of human target cells with murine retrovirus receptor Slc7a1
- Select a multiplicity of infection (MOI) = 2 to ensure that most cells will be transduced. For target cells that are resistant to transduction such as HDFs, a higher MOI will be required; we dilute the viral supernatant only 1:2 to achieve transduction of a majority of the cells.
- Transduce target cells overnight with viral supernatant diluted in fresh culture medium with 6 μg/ml PB, which increases transduction by enhancing electrostatic interaction between the virus and target cell.1 Ideally one should use a minimal volume of virus, such as 1 ml for a 35 mm plate, because diffusion is a limiting factor in transduction efficiency.
- Culture cells for at least 48 hours after removing virus before transducing them with ecotropic virus, in order to ensure sufficient expression of the Slc7a1 receptor.
- (Optional) It is possible to use blasticidin to select for stably transduced cells expressing Slc7a1, if desired. A blasticidin kill curve should be generated in advance to determine the lowest effective concentration, generally between 2 – 10 μg/ml, that kills all untransduced target cells in 7 days. About 2 days after removing the Slc7a1 virus, switch the transduced cells to medium containing blasticidin. Culture the cells in blasticidin-containing medium for 7 days, at which point all remaining cells will stably express the retrovirus receptor at which point they can be transduced with ecotropic virus as well as banked for future use as a stable Slc7a1-expressing line.
3. Polymer complex titration to determine toxicity
- Day 1. Plate cells at 5000 cells/well in a 96-well plate, allowing at least triplicate wells for each experimental group. Include untransduced cells in complete medium to provide a baseline value for healthy cells, as well as samples consisting of cells in serum-free medium to induce growth arrest as a control. In parallel, plate cells in an appropriate format (such as a 24-well plate) for microscopic or FACS-based analysis of transduction efficiency in each experimental condition.
- Day 2. Transduce cells in plates set up for both the MTT and FACS analyses with virus encoding GFP, at an MOI of 0.5 to transduce ~40% of target cells. Test varied concentrations of CS/PB (e.g. 50, 100, 200, 400, 600, and 800 mg/ml of each component), as well as 6 μg/ml PB, to determine optimal amounts. Generate polymer complexes as described in Part 4, below.
- Day 3. Remove virus-containing medium and replace with fresh medium. Return the plates to a humidified incubator.
- Day 5. Analyze FACS plate to determine the transduction efficiency with each polymer concentration.
- Day 6. Remove the medium from all wells of the MTT plate and replace with 100 μl MTT solution (1 mg/ml MTT in complete medium). Culture for three hours in a humidified incubator to allow MTT to be reduced in the mitochondria of metabolically active cells.
- Remove MTT solution and replace with 200 ml MTT solvent (0.1 N HCl, 0.1% Igepal CA-630 in isopropanol).
- Incubate for two hours at room temperature or until all of the purple MTT formazan precipitate is dissolved. Read the absorbance on a microplate reader at 570 nm, subtracting the background reading at 690 nm.
- Select the optimal polymer concentration that produces maximum enhancement of transduction, as determined by FACS, with minimal effect on metabolic activity, as determined by MTT. For HDFs, we selected 100 μg/ml CS/PB based on the data shown in the Representative Results, below.
4. Ecotropic transduction with polymer complexation
- Prepare sterile-filtered stock solutions of PB and chondroitin sulfate at 20 mg/ml in water. Aliquot and store at -20°C.
- Pipette viral supernatant into a microcentrifuge tube and dilute to the desired final concentration (e.g. MOI of 2) with fresh culture medium. Add equal volumes of PB and chondroitin sulfate (concentrations determined in step 3 above) in succession, flicking the tube to mix after each addition. The viral mixture will immediately become cloudy as precipitates form. Incubate the viral mixture at room temperature for 5 minutes to allow complex formation.
- Remove media from the receptor-expressing target cells, replace with the viral mix, and incubate overnight at 37°C, 5% CO2. After removing the viral mix, wash the surface of the cells twice with PBS to aid in removing viral complexes. Complete removal is not necessary; we have observed no adverse effects on cell health from residual polymer complexes.
5. Verifying specificity of ecotropic transduction
- When producing ecotropic virus for the first time, it is prudent from a safety perspective to verify that the virus is unable to transduce unmodified human cells. Transduce human cells with ecotropic lentivirus at relatively high concentration (only a 1 to 2-fold dilution of viral supernatant in fresh medium) overnight with 6 μg/ml PB or optimized CS/PB concentration.
- Remove virus-containing medium and replace with fresh medium. After incubating cells for 2 days, validate transgene expression by FACS using fluorescent vectors and/or by RT-PCR with transgene-specific primers.
6. Representative results:
Fig. 1A shows the lentivirus production process, and Fig. 1B shows transduction of human cells with ecotropic lentivirus, including pre-transduction with murine retrovirus receptor Slc7a1. For titering virus, we use a human rhabdomyosarcoma cell line stably transduced with Slc7a1 (Slc-hRMS). When using fluorescent control vectors to monitor transduction efficiency, we routinely achieve > 90% transduction efficiency of Slc-hRMS with ecotropic virus, as shown in Fig. 2A and 2B. Transduction rates of HDFs are generally lower because the cells have not been blasticidin-selected for receptor expression (Fig. 2C). Titers of ecotropic lentivirus are generally 10-20% of VSV-pseudotyped virus when measured on Slc-hRMS (Fig. 2D).
One freeze-thaw cycle reduces titer of ecotropic virus by 16 - 3%, equal to titer loss during a single freeze-thaw cycle of VSV-pseudotyped virus (p > 0.05). Contrary to previous reports,2 we observe no positive effect on virus titer from flash freezing in dry ice. Rather, we achieve higher post-thaw titers of either pseudotype by simply placing tubes of virus into a -80°C freezer (data not shown).
The MTT viability assay allows sensitive detection of growth arrest in target cells. Transduction with virus plus concentrations of CS/PB up to 800 μg/ml has no effect on HDF metabolism (Fig. 3A). Exposure to CS/PB without virus also has no toxic effect on cells (data not shown). FACS analysis of HDFs transduced with virus plus various concentrations of CS/PB shows enhancement of transduction compared to PB alone (Fig. 3B). The maximum enhancement occurs at 100 μg/ml CS/PB (Fig. 3C), several-fold lower than previously reported values.3 Thus, it is important to optimize conditions for any given target cell type.
Complexation with CS/PB enhances the observed titer roughly 3-fold in Slc-hRMS (Fig. 4A, p < 0.01). In practice, this yields a greater effect on transduction efficiency at low virus concentrations than at higher concentrations (Fig. 4B), which is most likely due to multiply transduced cells and receptor saturation at higher virus concentrations.
Transduction with ecotropic virus is specific for cells expressing murine retrovirus receptor. When transducing unmodified human cells with ecotropic virus, we have not observed fluorescence greater than the untransduced background whether using PB or CS/PB, as shown in Fig. 5A. Microscopically, HDFs show no transduction in the absence of receptor (Fig. 5B) while pre-transduction with receptor results in fluorescent cells (Fig. 5C).
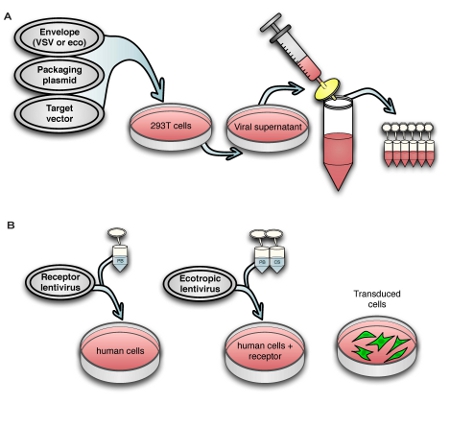
Figure 1. Schematic view of (A) the virus production process and (B) transduction of human cells with murine retrovirus receptor followed by ecotropic lentivirus.
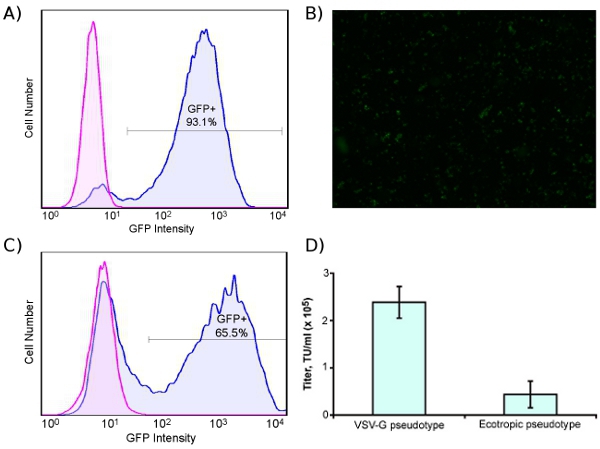
Figure 2. High-efficiency transduction of human cells with ecotropic lentivirus encoding GFP. Cells were pre-transduced with murine retrovirus receptor Slc7a1. (A) Human rhabdomyosarcoma cell line blasticidin-selected for Slc7a1 (Slc-hRMS), transduced (blue) or untransduced (pink) with GFP. (B) Fluorescent micrograph of ecotropic-transduced Slc-hRMS (4X). (C) HDFs transduced (blue) and untransduced (pink) with ecotropic GFP lentivirus; cells were transduced with Slc7a1 two days prior to ecotropic transduction. (D) Titer of VSV-G pseudotyped and ecotropic lentivirus, measured on Slc-hRMS.
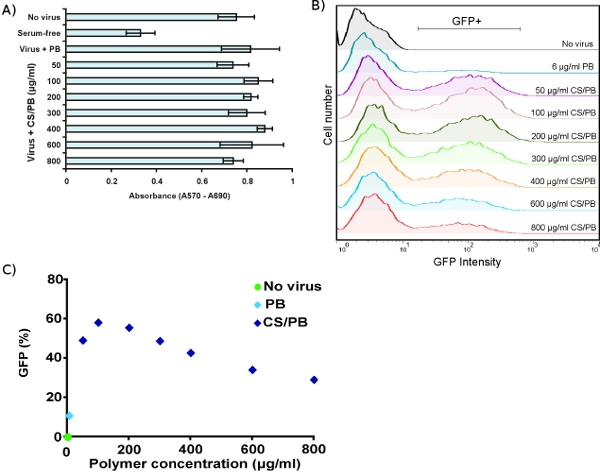
Figure 3. Optimizing chondroitin sulfate/polybrene (CS/PB) concentrations in human dermal fibroblasts. (A) Viability of HDFs measured by MTT assay after transduction in the presence of PB only or with varied concentrations of CS/PB. (B) Enhancement of transduction efficiency in HDFs by different concentrations of CS/PB, measured by FACS. (C) Quantification of transduction enhancement, showing that maximum transduction occurs at 100 μg/ml CS/PB.
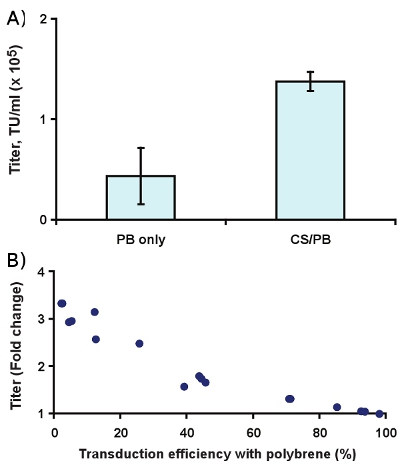
Figure 4. Effect of 400 μg/ml CS/PB on transduction of Slc-hRMS with ecotropic lentivirus. (A) Titer enhancement, and (B) fold change in transduction rate compared to 6 μg/ml polybrene alone.
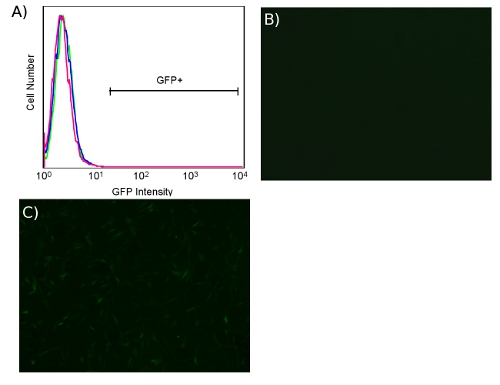
Figure 5. Lack of ecotropic transduction of HDFs in the absence of murine retrovirus receptor Slc7a1. (A) FACS plot of BJ human fibroblasts, untransduced (pink) or transduced (blue) with ecotropic GFP lentivirus in both cases in the absence of receptor Slc7a1. BJ human fibroblasts transduced with ecotropic GFP lentivirus, without (B) and with (C) pre-transduction with receptor Slc7a1 (4X).
Discussione
Ricombinante gammaretrovirus ecotropic basato sul virus della leucemia murina Moloney (MLV) e il suo recettore mSlc7a1 sono ben studiati e ampiamente disponibili, siano stati utilizzati per oltre 20 anni per fornire transgeni alle cellule murine. Gammaretrovirus Ecotropic è stato usato più di recente per fornire oncogeni alle cellule umane;. Nell'ambito della riprogrammazione cellulare, l'uso di mSlc7a1 per evitare la generazione di virus oncogeni amphotropic ospitare umano è ben consolidata 4,5 Tuttavia, lentivirus offre vantaggi significativi rispetto gammaretrovirus nella trasduzione popolazioni di cellule refrattario, compresi 6 celle primarie, che sono spesso obiettivi auspicabili per la riprogrammazione, in quanto il lentivirale pre-integrazione di trasduzione del complesso permette di non dividere le celle 7.
Lentivirus sono state prodotte con decine di pseudotypes diversi, tra cui MLV, nel tentativo di alterare tropismo del virus, la tossicità, e altre proprietà. 8 MLV-pseudotyped lentivirus ecotropic è stato utilizzato per trasdurre cellule di topo, 9 ma raramente è stato utilizzato su cellule umane 10. Proponiamo quindi l'uso di MLV-pseudotyped lentivirus ecotropic come un veicolo sicuro, conveniente e altamente efficiente per fornire oncogeni noti o sospetti, tra cui i fattori di riprogrammazione cellulare, alle cellule umane.
È fondamentale notare che questo protocollo non del tutto elimina la necessità di produrre e utilizzare lentivirus pantropic, anzi, questo protocollo separa l'oncogene (s) dal virus pantropic, isolante ricercatori potenziale di auto-inoculazione con cancro-correlata virus. Il mSlc7a1 proteina e il suo omologo umano hSlc7a1 sono espresse ubiquitariamente trasportatori di aminoacidi senza tumorigenicità note o la capacità di conferire un vantaggio selettivo di crescita su cellule riceventi, 11 mSlc7a1 realizzazione di rischio relativamente basso per incorporazione in amphotropic virus. Questo passo ha aggiunto può essere particolarmente utile nei laboratori privi di virus o strutture dedicate coltura dei tessuti del livello richiesto biosicurezza.
In alcune situazioni può essere possibile eliminare completamente l'uso di virus pantropic dalla trasfezione del plasmide Slc7a1 direttamente nelle cellule bersaglio, tuttavia, molte cellule che sarebbe utile obiettivi di questa tecnica sono refrattari alla trasfezione. In alternativa, la capacità di isolare Slc7a1-trasdotte dalla selezione blasticidin significa che VSV-G lentivirus pseudotyped può essere utilizzato una sola volta per generare uno stock di cellule che esprimono recettori, dopo di che virus ecotropic può essere utilizzato di routine per trasdurre queste cellule per molti esperimenti. I ricercatori dovrebbero sempre seguire le loro linee guida di sicurezza istituzionali per lavorare con qualsiasi lentivirus, indipendentemente dal suo tropismo.
I titoli del virus ecotropic ottenuti con questo protocollo sono moderatamente inferiori VSV-pseudotyped virus, in genere il 10-20% del titolo virus pantropic, in accordo con precedenti studi. 9 Questi titoli sono stati misurati in cellule umane trasdotte stabilmente con Slc7a1, in modo che il minore titolo osservato per ecotropic virus può essere in parte a causa di variegata espressione del gene del recettore nelle cellule bersaglio. Tuttavia, la titoli virale raggiunto nel nostro protocollo sono più che sufficienti per la maggior parte delle applicazioni e portare alla trasduzione della maggior parte delle cellule, in alcuni casi> 90% delle cellule.
Centrifugazione basati su tecniche sono comunemente utilizzati per concentrare le particelle virali. Tuttavia, centrifugazione richiede diverse ore, genera aerosol infettivi, e può causare una perdita significativa di particelle virali. 12 In alternativa, la complessazione con CS / PB può essere usato per migliorare la trasduzione senza alterare tropismo virale. 3 Questo metodo è rapido (5 minuti ) e poco costoso (0,03 dollari per 10 ml di virus), mentre circa triplicando il titolo osservato. Non occorrono attrezzature o reagenti proprietari sono tenuti, e abbiamo osservato minima tossicità acuta dopo l'esposizione di HDFS di CS / PB, in accordo con precedenti lavori in altre linee cellulari. 13 Un potenziale svantaggio di questo protocollo è che alcuni complessi microscopicamente visibili polimero aderire le cellule per diversi giorni in coltura. Non possiamo escludere la possibilità che questi complessi, anche se non apertamente tossico per le cellule, possono avere effetti più sottili sui processi cellulari.
Qui abbiamo descritto una metodologia per la sicura ed efficiente trasduzione cellule umane con fattori oncogenici. Questo approccio dovrebbe essere di grande utilità per i ricercatori che studiano oncogeni e biologia delle cellule staminali comprese le cellule iPS.
Divulgazioni
Riconoscimenti
Il finanziamento per questo progetto è stato fornito dal California Institute per la Medicina Rigenerativa.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
|---|---|---|---|
| pLenti6/UbC/mSlc7a1 | Addgene | 17224 | MLV recettore murino |
| pMD2.G | Addgene | 12259 | VSV-G busta |
| pCMV-dR8.91 | D. Trono di laboratorio 14 | Packaging plasmide (equivalente psPax2 plasmide è disponibile presso Addgene, cat. Numero 12260) | |
| pHCMV-EcoEnv | Addgene | 15802 | Busta Ecotropic |
| FUGW | Addgene | 14883 | GFP plasmide di controllo |
| OptiMEM | Invitrogen | 31985 | |
| Fugene HD | Roche | 04 709 705 001 | |
| Hexadimethrine bromuro (polibrene) | Sigma-Aldrich | H9268 | |
| Condroitin solfato di sodio sale da cartilagine di squalo | Sigma-Aldrich | C4384 | |
| Blasticidin S | Pescatore | BP 2647100 | |
| Methylthiazolyldiphenyl-tetrazolio bromuro (MTT) | Sigma-Aldrich | M2128 | |
| Igepal CA-630 | Sigma-Aldrich | I3021 |
Riferimenti
- Davis, H. E., Rosinski, M., Morgan, J. R., Yarmush, M. L. Charged polymers modulate retrovirus transduction via membrane charge neutralization and virus aggregation. Biophys J. 86, 1234-1242 (2004).
- Marino, M. P., Luce, M. J., Reiser, J. Small- to large-scale production of lentivirus vectors. Methods Mol Biol. 229, 43-55 (2003).
- Landazuri, N., LeDoux, J. M. Complexation of retroviruses with charged polymers enhances gene transfer by increasing the rate that viruses are delivered to cells. J Gene Med. 6, 1304-1319 (2004).
- Ohnuki, M., Takahashi, K., Yamanaka, S. Generation and characterization of human induced pluripotent stem cells. Curr Protoc Stem Cell Biol. 4, 4A.2-4A.2 (2009).
- Hotta, A. EOS lentiviral vector selection system for human induced pluripotent stem cells. Nat Protoc. 4, 1828-1844 (2009).
- Reiser, J. Transduction of nondividing cells using pseudotyped defective high-titer HIV type 1 particles. Proc Natl Acad Sci U S A. 93, 15266-15271 (1996).
- Cullen, B. R. Journey to the center of the cell. Cell. 105, 697-700 (2001).
- Cronin, J., Zhang, X. Y., Reiser, J. Altering the tropism of lentiviral vectors through pseudotyping. Curr Gene Ther. 5, 387-398 (2005).
- Schambach, A. Lentiviral vectors pseudotyped with murine ecotropic envelope: increased biosafety and convenience in preclinical research. Exp Hematol. 34, 588-592 (2006).
- Koch, P., Siemen, H., Biegler, A., Itskovitz-Eldor, J., Brustle, O. Transduction of human embryonic stem cells by ecotropic retroviral vectors. Nucleic Acids Res. 34, e120-e120 (2006).
- Yoshimoto, T., Yoshimoto, E., Meruelo, D. Molecular cloning and characterization of a novel human gene homologous to the murine ecotropic retroviral receptor. Virology. 185, 10-17 (1991).
- Cepko, C. Large-scale preparation and concentration of retrovirus stocks. Curr Protoc Mol Biol. Chapter 9, Unit 9.12-Unit 9.12 (2001).
- Doux, J. M. L. e., Landazuri, N., Yarmush, M. L., Morgan, J. R. Complexation of retrovirus with cationic and anionic polymers increases the efficiency of gene transfer. Hum Gene Ther. 12, 1611-1621 (2001).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J Virol. 72, 9873-9880 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon