È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Analisi Citometria a flusso di cellule immunitarie all'interno aorte Murine
In questo articolo
Riepilogo
Questo articolo presenta un metodo basato citometria di flusso per studiare la composizione immunitario dei aorte. Il documento illustra anche una tecnica aggiuntiva che consente di esaminare avventizia circostante e parete del vaso a parte. Questo metodo apre la possibilità di eseguire analisi fenotipica dei leucociti aortica e applicare diversi saggi immunologici per gli studi di aterosclerosi.
Abstract
L'aterosclerosi è un processo infiammatorio cronico delle imbarcazioni medie e grandi dimensioni che è caratterizzata dalla formazione di placche composto da cellule schiumose, cellule del sistema immunitario, cellule muscolari lisce ed endoteliali, piastrine, matrice extracellulare, e un nucleo ricco di lipidi con necrosi estesa e fibrosi dei tessuti circostanti. 1 Il braccio innata e adattiva della risposta immunitaria sono coinvolti nello sviluppo di iniziazione, e la persistenza di aterosclerosi. 2, 3 Vi è un corpus significativo di prove che diversi sottoinsiemi di cellule immunitarie, come i macrofagi, dendritiche cellule, linfociti T e B, sono presenti all'interno della aorte di topi sani e aterosclerosi a rischio 4. Inoltre, le cellule immunitarie si trovano nel avventizia aortica circostante che suggerisce un ruolo importante di questo tessuto nell'aterogenesi 2.
Da qualche tempo, la rilevazione quantitativa di diversi tipi di cellule immunitarie, il loro stato di attivazione, e la composizione cellulare all'interno della parete aortica è stato limitato mediante RT-PCR e metodi immunoistochimici per lo studio dell'aterosclerosi. Pochi tentativi sono stati fatti per eseguire citometria a flusso utilizzando aorte umane, e una serie di problemi, come un autofluorescenza alto, sono stati riportati 5,6. Placche aterosclerotiche umane sono stati digeriti con collagenasi 1, e celle libere sono stati raccolti e colorate per CD14 + / CD11c + per evidenziare macrofagi derivati da cellule schiumose. In questo studio, un canale "finto" è stato usato per evitare falsi positivi colorazione. 6 materiali necrotiche accumulano durante il processo di digestione dar luogo a una grande quantità di detriti che genera una autofluorescenza alta nei campioni aortica. Per risolvere questo problema, un gruppo di controlli negativi e positivi è stato proposto, ma solo doppia colorazione potrebbe essere applicata in questi campioni. Abbiamo sviluppato un nuovo flusso di citometria metodo basato su 7 per analizzare la composizione delle cellule immunitarie e caratterizzare l'attivazione, la proliferazione, la differenziazione delle cellule del sistema immunitario in buona salute e aterosclerosi dell'aorta a rischio. Questo metodo permette l'indagine della composizione cellule immunitarie della parete aortica e apre possibilità di utilizzare un ampio spettro di metodi immunologici per le indagini degli aspetti immunitario di questa malattia.
Protocollo
1. Isolamento di aorte murino
Approvazione del comitato istituzionale IACUC della procedura è richiesto di lavorare con i topi.
- Preparare heparinzed PBS con l'aggiunta di 1000 unità di eparina sodica a 50 ml di PBS e invertendo il tubo per mescolare. Preparare una provetta vuota per la raccolta del sangue e un tubo di raccolta contenente PBS per ogni aorta da raccogliere. Mantenere tutte le provette su ghiaccio.
- Eparinizzare una siringa di sangue disegno (0,1 ml di 1000 U / ml di sodio eparina), preparare gli strumenti chirurgici (due paia di pinzette ricurve, un paio di forbici da dissezione, e un paio di microshears), e un palcoscenico per sezionare la dissezione.
- Eutanasia di un mouse utilizzando l'anidride carbonica in una camera ha approvato i seguenti NIH e istituzionali Politiche comitato IACUC per quanto riguarda l'eutanasia roditori. Verificare la presenza di efficacia prima di trasferire il mouse alla fase dissezione.
- Brevemente immergere il mouse con il 70% di etanolo e fissare il mouse alla fase dissezione. Prelievo di sangue dal mouse tramite puntura cardiaca.
- Aprire la cavità addominale e toracica. Usando una siringa da 10 ml con un ago da 25 g, il sistema vascolare del tutto profumato con PBS contenente 2% di eparina per rimuovere completamente il sangue dai vasi mediante puntura cardiaca. Assicurarsi che non c'è sangue nei tessuti aortica. La perfusione deve essere eseguito lentamente con poca pressione per garantire che tutte le placche nella parete del vaso rimangono intatti.
- Sezionare e rimuovere gli organi viscerali, gli organi genito-urinario, diaframma e la milza, lasciando i reni, cuore, aorta e intatto.
- Con attenzione sezionare tessuti adiposi e para-aortici linfonodi lontano dalla aorta, lasciando l'aorta e avventizia intatto. Raccogliere l'aorta tutto compreso dell'arco aortico, ascendente, discendente, toracica, addominale e porzioni. Posizionare l'aorta isolata in un tubo di raccolta con PBS. Durante la procedura di isolamento, cercare di mantenere umido il vaso.
2. Preparazione di sospensioni singola cella
- Creare un 1X Aorta soluzione enzimatica dissociazione stock (ADES) (125 U / ml Collagenasi tipo XI, 60 U / ml tipo ialuronidasi 1-s, 60 U / ml DNasi I, e 450 U / ml Collagenasi tipo I, in 2,5 ml di PBS, modificato da Galkina et al. 7). Tutti gli enzimi sono di Sigma-Aldrich. Posizionare la soluzione enzimatica magazzino dal ghiaccio.
- Rimuovere la PBS dal tubo di raccolta che contiene l'aorta. Aggiungere 2,5 ml di 1X ADES ad ogni aorta. Tagliare la aorte in piccoli pezzi per facilitare la digestione enzimatica o lasciare intatto l'aorta. Incubare la aorte con la soluzione enzimatica 1X per 1 ora a 37 ° C (più lenta agitazione è opzionale).
- Dopo l'incubazione 1 ora, preparare sospensioni singola cellula dall'aorta digerito dalla tosatura della aorte a parte e passare attraverso un filtro a 70 micron cella in 5 ml in polipropilene FACS tubi (BD Falcon). Agglomerare le cellule mediante centrifugazione (400xg, 5 minuti, 4 ° C).
- Risospendere le cellule in 1 ml di FACS tampone (PBS integrato con BSA 1% e 0,05% NaN 3) e determinare il numero di cellule presenti nella sospensione cellulare aortica con trypan blu, un emocitometro, e un microscopio ottico. Il numero totale di cellule ottenute dopo la digestione dipende dall'età del mouse e la dieta o la gravità di aterosclerosi.
3. Citometria a flusso colorazione
- Etichetta un numero adeguato di nuovi tubi di FACS. In generale, gli esperimenti di citometria a flusso dovrebbe avere un non-macchiato provetta di controllo, serie di tubi unico colore, appropriato fluorescenza-meno-uno di controllo (FMO) 8, isotipo controlli del caso, e una serie di tubi sperimentale. Dato che ci sono un numero limitato di leucociti aortica che può essere isolato, leucociti splenico può essere utilizzato per eseguire colorazione singolo controllo.
- Usiamo un protocollo standard citometria a flusso per macchiare sospensioni cellulari aortica. In breve, il trasferimento di una aliquota di 0,5-1x10 6 celle da una sospensione cellulare aortica in un tubo FACS (s). Aggiungere 1 ml di FACS buffer e agglomerare le cellule per centrifugazione. Eliminare il surnatante dalle cellule pellet per decantazione.
- Preparare la soluzione blocco Fc e cocktail di anticorpi per i tubi sperimentale, fluorescenza-meno-uno tubi, tubi e isotipo. Aggiungere 100μl di Fc blocco nel buffer di FACS (14.2μg/ml, clone 2.4G2) a tutti i tubi e film dito o vortice delicatamente per risospendere le cellule. Incubare i campioni per 15-20 minuti a temperatura ambiente.
- Preparare colorazione anticorpi, colorazione isotipo o FMO cocktail colorazione controllo. Determinare la concentrazione ottimale di anticorpi in esperimenti di titolazione preliminare. In presenza di blocco Fc, aggiungere cocktail di anticorpi (100ul/0.5-1.0x10 6 celle) per i tubi campione. Incubare per 20-30 minuti a 4 ° C al buio.
- Aggiungere 1ml di tampone FACS a ciascuna provetta, vortice di mescolare, e agglomerare le cellule per centrifugazione. Ripetere la procedura ancora una volta.
- Decantare il surnatante e risospenderele cellule in pellet 300μl del 2% PFA. Eseguire gli esempi su un citofluorimetro.
- Nota: in genere gli anticorpi anti-CD45 (antigene leucocitario comune marcatore) si aggiunge a tutti i campioni per gate CD45 + leucociti dopo 7 Inoltre, CD45 FMO e controlli isotipo dovrebbe essere utilizzato inizialmente per posizionare il CD45 + leucociti cancello. CD45 espressione può variare tra i leucociti.
- Nota: Per rilevare la bassa densità che esprimono antigeni di superficie o antigeni evento basso, usare "fluorocromi brillante" come R-ficoeritrina (PE) o Allophycocyanin (APC). Inoltre, gli eventi rari può essere rilevato da mettere in comune diverse aorte abbinati insieme, ma se più di un milione di cellule sono utilizzate, la quantità di anticorpi utilizzati per test deve essere aumentata proporzionalmente.
- Nota: Per assicurarsi che non vi siano contaminazioni di sangue minimo nella aorte isolate e di conseguenza nella sospensione cellulare aortica, in alcuni esperimenti di colorazione aggiuntiva è stata effettuata per TER-119, 7 un antigene espresso da globuli rossi (RBC). Il numero di globuli rossi di globuli bianchi (WBC) nel sangue è di circa 10x10 6 cell / mL a 8x10 3 celle / mL. In base all'espressione del TER-119 nei campioni aortica, la percentuale di derivati dal sangue umano i globuli bianchi nel campione può essere calcolato. Di solito abbiamo meno di 0,02% di derivati dal sangue dei globuli bianchi nei campioni aortica. (Fig.1)
- Nota: Poiché il trattamento enzimatico può influenzare l'espressione di antigeni di superficie, la resistenza alla digestione enzimatica dovrebbe essere determinata per gli antigeni di interesse. In breve, linfonodi periferici (PLN) o piccoli pezzi di milza vengono incubate con o senza cocktail di enzimi per 1 ora a 37 ° C. Dopo 1 ora, l'espressione degli antigeni è determinata mediante citometria di flusso. Il cocktail di enzimi non ha effetto su antigeni di superficie multiple (Fig.2) 7. In alcuni casi, il trattamento enzimatico portato ad una significativa perdita di espressione dell'antigene. Questo problema può essere aggirato utilizzando marcatori cellulari alternative.
- Nota: Live / morti colorazione vitalità cellulare può essere eseguita dopo il punto 4 se lo si desidera. Utilizzano in genere Live / Dead kit fissabile cellule morte Stain (Invitrogen, Molecular Probes). Per colorare le cellule con colorante Live / Dead, creare una soluzione 1x Live / Dead con l'aggiunta di 1ml di ri-sciolto dal vivo / morto tintura in 1 ml di PBS e agitare per mescolare. Aggiungere 100-200 ml di colorante 1x Live / Dead to live / morti singolo, cocktail, FMO e campioni di controllo isotipico. Incubare i campioni con il colorante a temperatura ambiente per 10 minuti al buio. Il tubo di controllo unico per Live / Dead dovrebbe essere incubato a 56 ° C al buio per 10 minuti per uccidere le cellule da shock termico. Lavare le cellule con 1 ml di PBS e agglomerare le cellule per centrifugazione. Riprendi il protocollo al punto 5.
- Nota: colorazione intracellulare per gli antigeni intracellulari e citochine è compatibile con questo protocollo. In breve, la colorazione intracellulare può essere effettuata utilizzando la fissazione delle cellule / reagenti permeabilizzazione da BD Pharmingen, eBioscience, o laboratori Caltag - a seconda degli antigeni di interesse. Per fissare e permeabilize le cellule per la colorazione intracellulare, eseguire la fissazione / permeabilizzazione passo, seguendo le istruzioni del produttore, dopo la fase di colorazione extracellulare (sezione 3 punto 5). Dopo la fase di lavaggio intracellulare, riprendere il nostro protocollo al passo 6 (sezione 3 punto 6).
4. Analisi di citometria a flusso isolati circostanti avventizia e della parete dei vasi
Come leucociti possono migrare verso l'avventizia aortica e placche aterosclerotiche all'interno della parete aortica, per esaminare leucociti avventiziale e aortica mediante citometria a flusso un protocollo per l'isolamento e l'esecuzione di citometria a flusso su questi due siti anatomici è stato sviluppato 9. In breve, prima della aorte tutto vengono digeriti con ADES (sezione 2, punto 2) l'avventizia aortica è parzialmente digerito e rimossa dal resto della nave. Una volta che l'avventizia è stato rimosso e messo da parte, il resto della aorta viene digerito con ADES per liberare leucociti dalla parete del vaso.
- Aortica avventizia isolamento protocollo
- Dopo la compilazione della 1X ADES (sezione 2 punto 1), preparare 2,5 ml / aorta di soluzione 1X aortica digestione enzimatica avventizia (AADES) (781,25 U Collagenasi II e 14,0625 U elastasi in 2.5mls PBS (Worthington biochimici Corp., Lakewood, NJ )). 9 Posizionare soluzione di riserva sul ghiaccio fino al momento dell'uso.
- Rimuovere la PBS dal tubo di raccolta che contiene l'aorta. Aggiungere 2,5 ml di 1X AADES ad ogni aorta. Non tagliare il aorte in piccoli pezzi. Incubare la aorte con la soluzione 1X enzima avventizia per 10-20 minuti a 37 ° C.
- Dopo la digestione 10-20 minuti, trasferire l'aorta parzialmente digerito dal 1X AADES a una piastra di Petri con PBS fresco. Con molta attenzione, usando due paia di pinzette ricurve, sbucciare lo strato avventiziale via from l'aorta come una singola unità.
- Nota: i tempi di digestione più lunghi rendono più facile rimuovere l'avventizia, tuttavia, se l'avventizia è troppo digerito sarà strappo.
- Quando l'avventizia è stato completamente rimosso, trasferire l'avventizia e l'aorta per separare i tubi FACS. Aggiungere 1 ml di PBS al tubo avventizia, e posizionare il tubo in ghiaccio. Aggiungere 2,5 ml di soluzione 1X aorta dissociazione enzimatica al tubo aorta e l'aorta incubare per 40 minuti a 37 ° C.
- Nota: Per facilitare la digestione enzimatica, l'aorta può essere suddiviso in parti più piccole, a questo punto.
- Dopo la digestione 40 minuti, mettere il tubo aorta su ghiaccio e preparare sospensioni singola cellula dall'aorta avventizia e dal taglio della aorte e avventizia a parte e passare attraverso un filtro a 70 micron cella in 5 ml in polipropilene FACS tubi (BD Falcon). Agglomerare le cellule mediante centrifugazione (400xg, 5 minuti, 4 ° C). Tornare alla sezione 2 4 step e riprendere il protocollo.
5. Rappresentante Risultati
Qui vi presentiamo una serie di figure che dimostra citometria a flusso colorazione per analizzare la composizione immunitario di aorte complesso, la parete del vaso aortico e l'avventizia aortica circostante. In primo luogo, abbiamo dimostrato una trama rappresentante FACS che mostra una colorazione TER-119 sul sangue intero e isolato sospensione cellulare aortica (Fig. 1). TER-119 cellule positive rossi del sangue il 18% delle cellule nella sospensione cellulare aortica, che indica che solo il 0,014% delle cellule isolate da cellule in sospensione aortica sono derivati dal sangue umano. Si tratta di un esperimento di controllo importante che dimostra chiaramente che le navi digerito, ma che non circola nel sangue periferico è la fonte della maggior parte dei leucociti analizzati nel sospensione cellulare aortica. Inoltre, per convalidare il metodo, abbiamo valutato gli effetti del cocktail aorta dissociazione enzimatica su antigeni di superficie splenocyte (Fig. 2). Il cocktail di enzimi non ha effetti sulla espressione di antigeni diversi, tra cui, CD45, CD19, CD3, TCRαβ, TCRγδ e molti altri antigeni di superficie 7.
CD45 colorazione in collaborazione con Live / Dead colorante vitalità e controlli appropriati isotipo sono utilizzati per rilevare e sub-gate popolazioni di maggiore interesse e di escludere detriti cellulari durante l'analisi. Nella, Fig.3 aortica vivere CD45 + leucociti sono stati gated per determinare la percentuale di IFN + Υ cellule T all'interno del aorte congiunta di due giovani ApoE - / - topi. Per sottolineare la versatilità di questo metodo, utilizzando lo schema di gating presentato in Fig.3, presentiamo in Fig.4 colorazione intracellulare rappresentante per CD68 + CD11b + macrofagi e IFNγ + + TCRαβ celle da due ApoE - / - topi alimentati con dieta occidentale per 12 settimane. Come previsto, nella parte occidentale della dieta alimentato ApoE - / - aorte, la maggior parte dei leucociti all'interno dell'aorta sono macrofagi (40% CD68 + CD11b +) o altre cellule mieloidi (CD11b + basso CD68 e CD11b + CD68-). Inoltre, le cellule Th1 costituiscono una parte importante del aortica infiltrati TCRαβ cellule T (Fig. 4). Come la percentuale complessiva dei leucociti aortica e sottoinsiemi leucociti varia a seconda dell'età del mouse e la gravità di aterosclerosi, la strategia di gating ottimale per le popolazioni di maggiore interesse devono essere empiricamente determinato
Per dimostrare la fattibilità di isolare avventizia aortica per la colorazione citometria a flusso, presentiamo rappresentante colorazione dei leucociti CD45 + per sospensioni cellulari aortica e avventizia (Fig. 5). In breve, tre di età compresa tra ApoE - / - aorte topo fossero digeriti e raggruppate come descritto in precedenza (punti 2 e 4). Infiltrazione dei leucociti CD45 + sono state rilevate in entrambi i avventizia (18% di sospensione cellulare) e l'aorta restante (11% della sospensione cellulare).
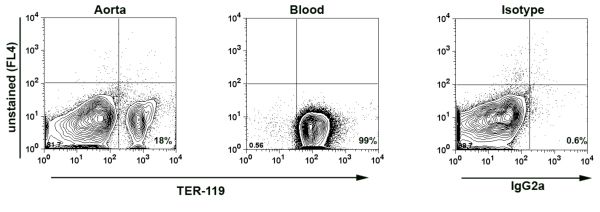
Figura 1. TER-119 colorazione in sospensione aortica digerito cellulare. Aorta è stato perfuso mediante puntura cardiaca con PBS contenente 2% di eparina. Poi l'aorta è stato digerito con il cocktail di enzimi per 1 ora a 37 ° C. Aortica sospensione cellule e campione di sangue (come controllo positivo) sono state colorate con anticorpi anti-TER-119-PE Abs e analizzati mediante citometria di flusso. TER-119-positivo conto globuli rossi per il 18% di tutte le cellule in sospensione cellulare aortica indicano che solo il 0,014% di tutti i leucociti isolati da aorte possono essere derivati dal sangue leucociti.

Figura 2. Enzyme-cocktail di trattamento non ha effetti sul CD45 (in alto) o CD19 (in basso) espressione sui linfociti. sospensioni cellulari da non trattati (A, B) e trattati con l'enzima-cocktail (C, D) LN sono stati ottenuti, e colorati con APC-Cy7-coniugato anti-CD45 e APC-coniugato anticorpi monoclonali anti-CD19. (A, C) I numeri rappresentano le percentuali dei leucociti CD45 + nel cancello R1. (B, D) I numeri rappresentano le percentuali di CD45 + / CD19 + linfociti. I profili sono gate sui leucociti CD45 +.
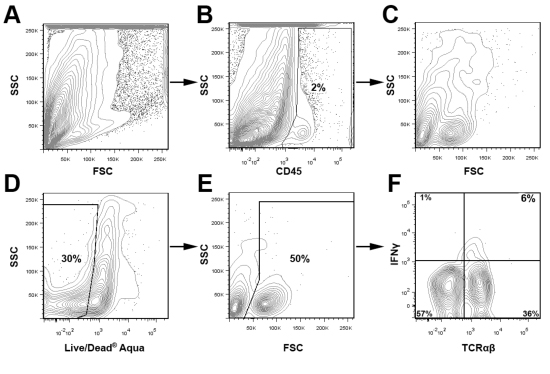
Figura 3 strategia di gating per l'analisi dei leucociti due aorte aortica sono stati isolati e messi a disposizione dai soggetti aterosclerotiche ApoE -.. / - Topi e sospensioni cellulari aortica sono state preparate come descritto sopra. Le sospensioni cellulari sono state colorate per CD45 (PerCP), TCRαβ (CIC), IFNγ (eFluor 450), e Live / Dead Aqua, e analizzati utilizzando un Cytek DXP 8 Colore aggiornato BD FACS Calibur. In breve, leucociti CD45 + sono stati gated (B) e ulteriormente analizzati (CF). Le cellule morte sono stati rimossi dalla analisi basata su Live / Dead colorazione Aqua (D) e le trame FSC (E). Vivere leucociti aortica sono stati poi esaminati per TCRαβ e IFNγ espressione (F).
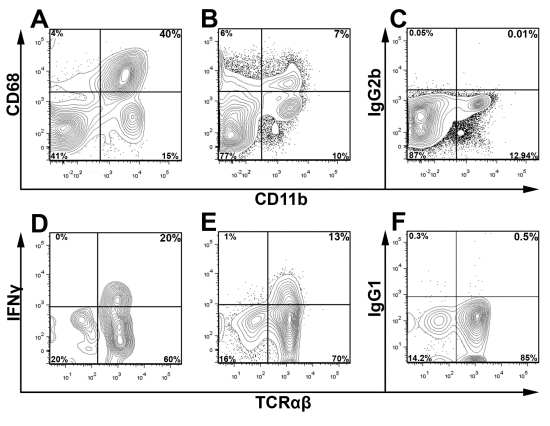
.. Sospensioni cellulari Figura 4 colorazione intracellulare per gli antigeni intracellulari e citochine sono state preparate da un intero ApoE - / - dell'aorta e della milza come descritto. Aortica (A) e sospensioni delle cellule della milza (B, C) sono state colorate per CD45, CD11b e CD68 o un controllo isotipico utilizzando BD Cytofix / Cytoperm ™ Kit (BD Biosciences). Le cellule sono state gate sui leucociti CD45 + e detriti è stata esclusa in base ai profili scatter in avanti e laterale. Per la colorazione IFNγ intracellulare, sospensioni cellulari aortica e della milza sono stati coltivati per cinque ore in RPMI 1640 integrato con Golgi stop, PMA, e ionomicina C, come descritto in precedenza. 9 stimolata aortica singolo (D) e milza (E, F) Le sospensioni cellulari sono state successivamente colorate con CD45 (PerCP), TCRαβ (CIC), CD3 (APC-Cy7), Live Aqua Morto, e IFNγ (eFluor 450; E) o un isotipo (IgG1-eF450, F). Cellule T (DF) sono stati gated da vivere CD3 + CD45 + leucociti (CD45 + Live / Dead Aqua-) ed esaminati per TCRαβ e IFNγ.
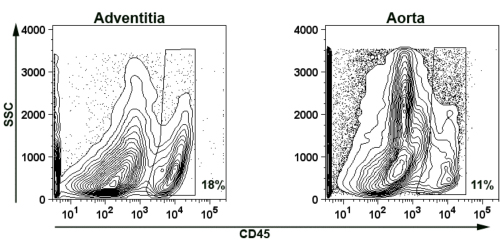
.. Figura 5 immagine rappresentante di aortica avventizia murini isolati e parete vascolare aortica rappresentante citometria a flusso complotto contro dimostra la presenza di cellule T CD45 + nel avventizia e aortica muro di età compresa tra ApoE - / - topi. SSC-side scatter. Per eliminare autofluorescenza da detriti e dei tessuti necrotici, complotti sono stati gated per FSC> 750. Per evitare ulteriori autofluorescenza doppiette i cancelli sono stati istituiti come FSC <3500, SSC <3500. Le percentuali indicano le cellule CD45 + alle porte della città.
Discussione
Qui, vi presentiamo un metodo di citometria a flusso basato per lo studio della composizione delle cellule immunitarie di aorte murini. Il principale vantaggio di questo metodo è la capacità di analizzare aortica cellule del sistema immunitario ad un livello singola cellula e di caratterizzare lo stato di attivazione dei leucociti aortica. Questo metodo non si limita a aorte murina e noi (dati non pubblicati) e altri 10 utilizzati questo approccio per analizzare campioni umani come arteria mammaria interna,...
Divulgazioni
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institutes of Health di sovvenzione: PO1 HL55798 (a KL) e dell'American Heart Association Scientist Development Grant 0525532U (a EG).
Materiali
| Name | Company | Catalog Number | Comments |
| Materiale | Numero di catalogo | Azienda | |
| Collagenasi XI | C7657 | Sigma-Aldrich | |
| Ialuronidasi | H3506 | Sigma-Aldrich | |
| DNasi I, di tipo 2 | D4527 | Sigma-Aldrich | |
| Collagenasi I | C0130 | Sigma-Aldrich | |
| Collagenasi II | LS004174 | Worthington Corporation biochimici | |
| Elastasi | LS002292 | Worthington Corporation biochimici |
Riferimenti
- Lusis, A. J. Atherosclerosis. Nature. 407, 233-2341 (2000).
- Galkina, E., Ley, K. Immune and inflammatory mechanisms of atherosclerosis. Annu Rev Immunol. 27, 165-197 (2009).
- Hansson, G. K., Libby, P. The immune response in atherosclerosis: a double-edged sword. Nat Rev Immunol. 6, 508-519 (2006).
- Galkina, E., Ley, K. Leukocyte influx in atherosclerosis. Curr Drug Targets. 812, 1239-1248 (2007).
- Bonanno, E., Mauriello, A., Partenzi, A., Anemona, L., Spagnoli, L. G. Flow cytometry analysis of atherosclerotic plaque cells from human carotids: a validation study. Cytometry. 39, 158-165 (2000).
- Liu-Wu, Y., Svenningsson, A., Stemme, S., Holm, J., Wiklund, O. Identification and analysis of macrophage-derived foam cells from human atherosclerotic lesions by using a "mock" FL3 channel in flow cytometry. Cytometry. 29, 155-164 (1997).
- Galkina, E., Kadl, A., Sanders, J., Varughese, D., Sarembock, I. J., Ley, K. Lymphocyte recruitment into the aortic wall before and during development of atherosclerosis is partially L-selectin dependent. J Exp Med. 203, 1273-1282 (2006).
- Tung, J. W., Parks, D. R., Moore, W. A., Herzenberg, L. A., Herzenberg, L. A. New approaches to fluorescence compensation and visualization of FACS data. Clin Immunol. 110, 277-283 (2004).
- Smith, E., Prasad, K. M., Butcher, M. Blockade of interleukin-17A results in reduced atherosclerosis in apolipoprotein E-deficient mice. Circulation. 121, 1746-1755 (2010).
- Eid, R. E., Rao, D. A., Zhou, J. Interleukin-17 and interferon-gamma are produced concomitantly by human coronary artery-infiltrating T cells and act synergistically on vascular smooth muscle cells. Circulation. 119, 1424-1432 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon