Method Article
Microiniezione degli ovociti mouse, Maturazione e Ploidia valutazione
In questo articolo
Riepilogo
Ovociti sono inclini a aneuploidia a causa di errori nella segregazione dei cromosomi durante la maturazione meiotica. Uova aneuploidi può causare infertilità, aborti o disturbi dello sviluppo, come la sindrome di Down. Qui, descriviamo i metodi per introdurre materiali di scelta in ovociti e metodi per lo studio maturazione meiotica e valutare ploidia.
Abstract
Gli errori nella segregazione dei cromosomi portare a cellule aneuploidi. Nelle cellule somatiche, aneuploidia è associata con il cancro, ma in gameti, aneuploidia porta alla sterilità, aborti o disturbi dello sviluppo, come la sindrome di Down. Gameti aploidi forma attraverso la specie-specifici programmi di sviluppo che sono accoppiati a meiosi. La prima divisione meiotica (MI) è unica per meiosi perché cromatidi fratelli restano attaccati mentre cromosomi omologhi sono segregati. Per ragioni non pienamente compreso, questa divisione reductional è incline ad errori ed è più comunemente la fonte di aneuploidia di errori nella meiosi II (MII) o di errori in 1,2 meiosi maschile.
Nei mammiferi, l'arresto ovociti in profase di infarto miocardico con un grande vescicola germinale intatto (GV, nucleo) e solo riprendere la meiosi quando ricevono segnali ovulatorio. Una volta riprende la meiosi, MI ovociti completa e sottoposti ad una divisione cellulare asimmetrica, arrestando di nuovo in metafase di MII. Le uova non si completerà MII finché non vengono fecondati dagli spermatozoi. Ovociti possono anche subire la maturazione meiotica utilizzando stabilito in condizioni di coltura in vitro 3. Poiché la generazione di mutanti di topi transgenici e geni-bersaglio è costoso e può richiedere lunghi periodi di tempo, la manipolazione dei gameti femminili in vitro è una strategia più economico e risparmio di tempo.
Qui, descriviamo i metodi per isolare profase arrestato ovociti di topo e per la microiniezione. Qualsiasi materiale di scelta possono essere introdotti nel citoplasma dell'ovocita, ma perché meiotically-competente ovociti sono trascrizionalmente silente cRNA 4,5, e non il DNA, deve essere iniettato per gli studi di espressione ectopica. Per valutare la ploidia, descriviamo le nostre condizioni per la maturazione in vitro degli ovociti MII alle uova. Storicamente, cromosoma-tecniche di spandimento sono usati per contare il numero cromosoma 6. Questo metodo è tecnicamente impegnativa ed è limitata solo a identificare hyperploidies. Qui, descriviamo un metodo per determinare ipo-e hyperploidies utilizzando uova intatte 7-8. Questo metodo utilizza monastrol, un inibitore della chinesina-5, che crolla del fuso bipolare in un mandrino monopolare 9 cromosomi separando così in modo che cinetocori individuo può essere prontamente individuato e contati utilizzando un siero anti-CREST autoimmuni. Poiché questo metodo viene eseguito nelle uova intatte, i cromosomi non sono persi a causa di un errore dell'operatore.
Protocollo
1. Topo ovocita collezione
- Per massimizzare il numero di follicoli antrali isolati gli uni dagli mouse, intraperitoneale iniettare topi femmina sessualmente matura (usiamo di 6 settimane di età CF-1 nei topi da Harlan) con 5 UI di siero di cavalla gravida di gonadotropina (PMSG).
- Preparare il mezzo di raccolta (MEM / PVP) (3 ml / mouse) aggiungendo milrinone a 2,5 micron e riscaldarlo a 37 ° C. Milrinone è un inibitore della fosfodiesterasi che mantiene arresto meiotico, una volta gli ovociti vengono rimossi dai follicoli. In alternativa, 3-isobutil-1-methylxanthine (IBMX) (0,2 mm) o dibutyryl-adenosina monofosfato ciclico (dbcAMP) (100 mg / ml) può essere utilizzato. Preparare il terreno di coltura con l'aggiunta di glutamina (1 mm) e milrinone (2,5 mM) a 1 ml di CZB e lasciarlo equilibrare nell'incubatrice per almeno un'ora. Impostare il microgocce di ognuno in una piastra di Petri e sovrapposizione con olio minerale. Il piatto CZB viene messo in incubatrice mentre la MEM / PVP piatto rimane al di fuori di una diapositiva più caldo. Altra raccolta e mezzo di coltura che sono disponibili in commercio (M2 e M16 da supporti speciali o Sigma) sono utilizzati di routine.
- Circa 48 ore dopo PMSG adescamento, il sacrificio del mouse utilizzando CO 2 sedazione seguita da dislocazione cervicale, sezionare le ovaie e metterli in un vetro d'orologio contenente preriscaldata MEM / PVP + milrinone (MEM / PVP + M).
- Utilizzando una siringa da insulina da 1 ml, ancora le ovaie al piatto e rilasciare i follicoli antrali di pungere più volte con 27-gauge (o cucire) aghi che sono fissati insieme.
- Mentre si guarda attraverso un microscopio dissezione, raccogliere complessi cumulo-ovocita usando una bocca a comando pipetta di vetro. E 'utile avere un microscopio con un sacco di contrasto. In alternativa, il supporto contenente i tessuti e le cellule possono essere pipettati su un coperchio di un piatto di plastica Petri. Solo raccogliere grandi follicoli antrali e non più piccoli pre-antrale follicoli o ovociti denudati. Una volta raccolti, i complessi trasferimento ad un MicroDrop di MEM / PVP + M che si trova sulla scorrimento più calde e sotto olio.
- Utilizzando una pipetta di piccole dimensioni (leggermente più grande del diametro del ovocita), pipettare su e giù per i complessi di staccare cellule del cumulo. Trasferire gli ovociti denudata con una pipetta in un più ampio MicroDrop di CZB + milrinone (CZB + M) e posto nell'incubatrice.
- Permettono di recuperare gli ovociti per almeno 1 ora in incubatrice prima della manipolazione.
2. Microiniezione ovocitaria
- Fai pipette iniezione tirando in vetro borosilicato tubo capillare in un estrattore meccanico. Usiamo un Flaming-Brown micropipetta estrattore (modello P-97) con le seguenti impostazioni: P = 500, di calore = 300, Pull = 150, Vel = 100, Tempo = 150.
- Preparare la piattaforma microiniezione mettendo una goccia 5 ml di MEM / PVP + M il più vicino possibile ad una goccia 0,5 ml di materiale iniezione di scelta (siRNA per esempio, cRNA, oligonucleotide morfolino, ecc) su un 1-scivolo e da camera che ha la camera dei media rimosso. Coprire con olio minerale e posto sul palco microscopio (Fig. 1).
- Luogo di iniezione e pipette tenendo nei supporti e la posizione nella goccia di MEM / PVP + M. Accendere i serbatoi di azoto che sono collegati al picoinjector e anti-vibrazioni tavolo. Aprire la punta della pipetta di iniezione con delicatezza toccando contro la pipetta tenendo mentre il riempimento con il mezzo. Se l'apertura è troppo grande, il mezzo si muove dentro e fuori rapidamente e l'ago si uccidono la cellula. Pipette con troppo piccolo di un'apertura spesso intasano facilmente.
- Ovociti trasferimento (5-10) dal termostato al MEM / PVP + M cadere sulla piattaforma. Prima di iniettare, impostare la picoinjector. Noi utilizzare i seguenti parametri sul nostro picoinjector (Modello PLI-100 da Harvard Apparatus): PBal = 2,5-3,5 psi, PInj = 7,8 psi, PClear = 10-12 psi, tempo = 3s. Ciò si traduce in un volume di iniezione di 5-10 pL.
- Tenendo premuto CLEAR, spostare l'ago per l'iniezione per la caduta di materiale e di riempimento. Restituirlo alla caduta media.
- Utilizzare la pipetta di partecipazione agli catturare un ovocita e allineare l'ago di iniezione, degli ovociti e pipetta tenendo lungo l'asse delle ascisse.
- In alto ingrandimento, far avanzare la pipetta di iniezione attraverso l'ovocita facendo attenzione ad evitare il nucleo. Una volta che la membrana plasmatica è trafitto, premere iniettare. Dopo l'iniezione, ritirare l'ago. Rilasciare l'ovocita e ripetere. Una volta che tutti gli ovociti vengono iniettati, li riporta ai incubatrice. Tenere in CZB + M per quantità di tempo desiderato, questo tempo dipende lo scopo sperimentale (siRNA e cioè knockdown morfolino (fino a 24 ore), l'iperespressione (3-12 h)). Si prega di notare che l'incubazione più lungo di 24 ore sarà compromesso maturazione meiotica.
3. Maturazione degli ovociti
- Dopo l'incubazione lavare gli ovociti attraverso alcune gocce di CZB (media maturazione) e trasferirlo in una MicroDrop di media stagionatura sotto olio e mettere in incubatrice.
- Consentire 16 h per t completa maturazione o metafase della meiosi II.
4. Ploidia analisi
- Preparare CZB + monastrol (100 mM) e il luogo 750 microlitri nel pozzetto di un piatto cultura organo che ha l'acqua nell'anello esterno.
- Lavare le uova con alcune gocce di CZB + monastrol e trasferirli nel piatto cultura organo. Posto in incubatrice per 1 h.
- Fissare le uova con il trasferimento in un vetro d'orologio contenente il 2% paraformaldeide in PBS per 20 minuti a temperatura ambiente. Trasferimento in un altro vetro d'orologio con il blocco soluzione. Questo piatto può essere conservato a 4 ° C fino elaborati.
- Trasferimento a soluzione permeabilizzazione (PBS + 0,3% di BSA + TritonX-100 0,1% + 0,02% NaN 3) in un vetro d'orologio per 15 minuti a temperatura ambiente. Sciacquare attraverso diversi grandi volumi di soluzione di blocco (PBS + 0,3% di BSA + 0,01 Tween-20 + 0,02% NaN 3).
- Il resto della procedura viene eseguita sul coperchio di una piastra a 96 pozzetti in una camera umidificata a temperatura ambiente che è protetta dalla luce. Le gocce (~ 25 mL) sono collocati all'interno delle rientranze circolare. Trasferimento uova a bloccare una soluzione per 15 minuti.
- Per centromeri etichetta, uova trasferimento in una goccia di soluzione contenente il blocco CREST anti-siero a 1:40. Incubare per almeno 1 h. Lavare con 3 gocce di soluzione di blocco, incubare 15 minuti ciascuno.
- Trasferimento uova per una goccia di soluzione contenente il blocco Cy5-o-Alexa Fluor-594-coniugato anti-IgG umane (1:200) e incubare per 1h. Ripetere il lavaggio passi come sopra tranne per l'ultimo passo, includono Sytox Verde (1:5.000) nella soluzione bloccante per rilevare cromosomi. Montare in 5 ml di Vectashield. Per evitare lo schiacciamento delle uova, mettere 4 piccole macchie di vaselina negli angoli di dove il coprioggetto sarà. Collocare un coprioggetto sopra e sigillare con smalto. Conservare in una scatola di scorrimento a 4 ° C fino a quando l'elaborazione tramite microscopia confocale.
- Mentre l'imaging con un obiettivo 100X, cattura 0,4 micron passi nella Z-plane e di immagine dell'intera regione del mandrino metafase. Conte centromeri utilizzando software di imaging come immagine J (NIH).
5. Rappresentante dei risultati:
Figura 2 è un Z-proiezione da un uovo euploid. In metafase di MII, uova euploid topo contengono 20 coppie di cromosomi e quindi hanno 40 centromeri. Occasionalmente cromosomi non riescono a diffondersi nonostante il trattamento monastrol. Questa situazione rende difficile contare affidabile centromeri e quindi non includono queste uova nelle nostre analisi. Occasionalmente, può essere difficile determinare se un CREST-immunoreattive "spot" è di 1 o 2 centromeri. Utilizzando programmi come J immagine è utile perché si può analizzare ogni Z-sezione mentre notando attentamente l'orientamento dei cromosomi, il numero di sezioni in cui viene rilevato un "spot" e l'intensità dei pixel i "punti" hanno. A seconda di dove il fuso meiotico è posizionato rispetto al corpo polare, le regioni del DNA possono sovrapporsi e questi campioni non devono essere inclusi nell'analisi.
Non manipolata, in vivo, uova ovulato dai topi riproduttivo giovani hanno bassi tassi di aneuploidia (~ 1-2%). Tuttavia, per motivi non compresi, microiniezione e nelle procedure di maturazione in vitro possono aumentare questo tasso verso l'alto del 10%. Pertanto, è fondamentale che gli ovociti iniettati di controllo sono inclusi in ogni studio microiniezione.

Figura 1. Piatto microiniezione impostare. Una diapositiva da camera con 5 gocce l di MEM / PVP + M appena sopra 0.5μl gocce di soluzione di iniezione. Coprire con olio minerale. In questo esempio ci sono 3 gocce per 3 diverse soluzioni di iniezione e la diapositiva è seduto sul palco di un microscopio. A sinistra si trova l'ago microiniezione e di destra è la pipetta in mano. Notare che vi è un riflesso della porta-aghi.
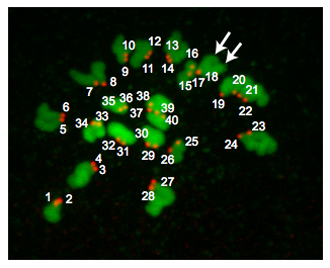
Figura 2. Risultati ploidia. A Z-proiezione di un uovo euploid metafase II. Il DNA è colorato in verde e cinetocori sono colorati in rosso. Le frecce indicano 2 bracci distinti cromatidi indicando che cinetocori (# 17 e # 18) si sovrappongono. Uova di topo Euploid contengono 20 coppie cinetocoro (40 totale "macchie"). Un uovo aneuploidi conterrebbe alcuna variazione su questo numero. Se questa procedura sono stati condotti su ovociti metafase MI, ci sarebbero 40 paia cinetocoro (80 totale "macchie").
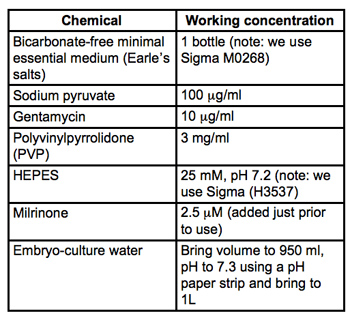
Tabella 1. Ricetta per mezzo di raccolta e di microiniezione (MEM / PVP + M). Tutti i materiali sono embrio-cultura grado e di Sigma-Aldrich. Filtro sterilizzare attraverso 0.22μm filtri PVDF (usiamo Stericups Milipore) e conservare a 4 ° C.
iles/ftp_upload/2851/2851table2.jpg "alt =" Tabella 2 "/>
Tabella 2. Ricetta per le medie CZB. Tutti i materiali sono embrio-cultura grado e di Sigma-Aldrich. Filtro sterilizzare attraverso 0.22μm filtri PVDF (usiamo Stericups Milipore) e conservare a 4 ° C.
Discussione
Microiniezione degli ovociti è un metodo potente per studiare i meccanismi che regolano la maturazione meiotica 10,11, 12, 13. Questo metodo offre un modo economico per verificare ipotesi prima di effettuare un grande investimento per lo sviluppo di modelli di topi transgenici e mirati. Raccolta degli ovociti e tecniche di microiniezione richiedono più tempo per padroneggiare procedure tipiche di biologia cellulare. Ostacoli specifici con raccolta spesso includono il controllo della pipetta bocca, tirando la corretta dimensione pipetta di vetro per la raccolta e la rimozione delle cellule somatiche e aumentando la velocità di raccolta per ridurre al minimo il tempo in cui gli ovociti sono al di fuori del termostato. Si consiglia di praticare molte volte prima di fare esperimenti. Trasferimento di ovociti tra microgocce pur mantenendo lo stesso numero di cellule è un ottimo modo per familiarizzare con questo metodo.
La morte cellulare si verifica comunemente durante l'apprendimento microiniezione. Ciò potrebbe verificarsi per una serie di motivi, tra cui l'iniezione di troppo grande di un volume di materiale (cioè l'apertura ago per l'iniezione è troppo grande), colpendo il nucleo con l'ago di iniezione, il piercing sul lato opposto della ovocita o che il materiale iniettato è tossico per l'ovocita. Pratica con l'iniezione di buffer in ovociti fino a quando il tasso di sopravvivenza è almeno del 50% è la chiave per padroneggiare questa tecnica. Se gli ovociti non riescono a maturare, è probabile che il milrinone non è stato diluito abbastanza. Si consiglia il risciacquo degli ovociti attraverso molti grandi gocce di milrinone senza CZB prima maturazione.
La ploidia microiniezione seguente analisi è uno dei tanti test per valutare la maturazione meiotica. Altre analisi di routine che usiamo in laboratorio comprendere il controllo della cinetica con cui il progresso ovociti attraverso la meiosi, immunofluorescenza per analizzare la formazione del fuso e l'allineamento dei cromosomi e l'attivazione uovo o la fecondazione in vitro per valutare le conseguenze dello sviluppo della manipolazione dell'ovocita 14,15, 16, 17.
Divulgazioni
Riconoscimenti
Questo lavoro è stato condotto nel laboratorio di Richard M. Schultz 's. Gli autori desiderano inoltre ringraziare Michael Lampson per concettualizzare il centromero-conteggio saggio e l'accesso al suo microscopio confocale. Teresa Chiang e Francesca Duncan assistito ad ottimizzare il centromero-conteggio test. Paula Stein è supportato da HD022681 (a RMS) e Karen Schindler è supportato da HD055822.
Materiali
Tabella di reagenti specifici:
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
|---|---|---|---|
| Milrinone | Sigma-Aldrich | M4659 | Risospendere in DMSO a 2,5 mm |
| Olio minerale | Sigma-Aldrich | M5310 | Utilizzare solo embrione testato, sterile, filtrata |
| CREST autoserum | Immunovision | HCT-0100 | |
| Sytox Verde | Invitrogen | 57020 | |
| Anti-umana Alexa 594 | Invitrogen | A-11014 | |
| Vectashield | Laboratori Vector | H-100 | |
| Paraformaldeide | Polysciences | 577773 | |
| Albumina da siero bovino | Sigma-Aldrich | A3294 | |
| PMSG | Calbiochem | 367222 | |
| Monastrol | Sigma-Aldrich | M8515 | Risospendere in DMSO a 100mm |
| Tween-20 | Sigma-Aldrich | 274348 | |
| TritonX-100 | Sigma-Aldrich | X-100 |
Tabella di attrezzature specifiche:
| Nome delle apparecchiature | Azienda | Numero di catalogo | Commenti |
|---|---|---|---|
| Boccaglio | Biodiseno | MP-001-Y | |
| Vetro d'orologio | Electron Microscopy Sciences | 70543-30 | |
| Siringa | BD | 309623 | 1ml, 27G 1 / 2 |
| 60 millimetri Petri Dish | Falco | 351007 | |
| Pipette Pasteur in vetro | Fisher Scientific | 13-678-200 | |
| Lato più caldo | Fisher Scientific | Qualsiasi modello standard | |
| Dissezione microscopio | Qualsiasi modello standard | ||
| Camera di diapositive | Nunc | 177372 | |
| Tubi capillari | Drummond | 1-000-0500 | Microcaps |
| Pipetta Puller | Flaming-Brown micropipetta estrattore | Modello P-97 | |
| Microscopio invertito | Nikon | Qualsiasi modello standard | |
| Micromanipolatori | Eppendorf | Qualsiasi modello standard | |
| Picoinjector | Harvard Apparatus | Modello PLI-100 | Qualsiasi modello standard |
| CO 2 serbatoi | Per incubatore | ||
| N2 serbatoio | Per la tavola e iniettore | ||
| Antivibranti tavolo | Produzione tecnico | Qualsiasi modello standard | |
| Incubatrice | Qualsiasi modello standard | ||
| Pipette tenendo | Eppendorf | 930001015 | Vacutip |
| Microscopio confocale | Leica | Qualsiasi modello standard | |
| Strumenti di dissezione | Strumenti della scienza multa | Qualsiasi modello standard | |
| Camera umidificata | Noi usiamo tupperware | ||
| Coperchio della piastra da 96 pozzetti | Nunc | 263339 | |
| Microscopio diapositive | Fisher Scientific | 12-544-3 | |
| Coprioggetto | Thomas scientifica | 6663-F10 | Lo spessore varia per microscopi particolare |
| Centro ben organo piatto cultura | Fisher Scientific | 353037 | 60 X 15mm |
Riferimenti
- Hunt, P. A., Hassold, T. J. . Science. 296 (5576), 2181-2181 (2002).
- Hassold, T., Hall, H., Hunt, P. . Hum Mol Genet. 16 Spec No. 2, R203-R203 (2007).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D. . Journal of reproduction and fertility. 86 (2), 679-679 (1989).
- Schultz, M. R. . Oogenesis and the control of meiotic maturation. , (1986).
- Moore, G. P., Lintern-Moore, S. . Biol Reprod. 18 (5), 865-865 (1978).
- Hodges, C. A., Hunt, P. A. . Chromosoma. 111 (3), 165-165 (2002).
- Schindler, K., Schultz, R. M. . Cell Cycle. 8 (7), 1090-1090 (2009).
- Chiang, T., Duncan, F. E., Schindler, K. . 20 (17), 1522-1522 (2010).
- Mayer, T. U., Kapoor, T. M., Haggarty, S. J. . Science. 286 (5441), 971-971 (1999).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5135-pdb prot5135 (2009).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5132-pdb prot5132 (2009).
- Reis, A., Chang, H. Y., Levasseur, M. . Nat Cell Biol. 8 (5), 539-539 (2006).
- Schuh, M., Ellenberg, J. . Cell. 130 (4), 484-484 (2007).
- Backs, J., Stein, P., Backs, T. . Proceedings of the National Academy of Sciences of the United States of America. 107 (1), 81-81 (2010).
- Schindler, K., Schultz, R. M. . Biol Reprod. 80 (4), 795-795 (2009).
- Kudo, N. R., Wassmann, K., Anger, M. . Cell. 126 (1), 135-135 (2006).
- Shoji, S., Yoshida, N., Amanai, M. . The EMBO Journal. 25 (4), 834-834 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon