È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Introduzione alla tecnica di distruzione mirata ad ultrasuoni microbolle
In questo articolo
Riepilogo
Ecografia distruzione mirata microbolle (UTMD) può essere utilizzato per dirigere site-specific di consegna di molecole bioattive, tra cui i geni terapeutici, di indirizzare gli organi accessibile a ultrasuoni, come il cuore e il fegato 1-6.
Abstract
In UTMD, molecole bioattive, come carica negativa vettori di DNA plasmide che codifica per un gene di interesse, vengono aggiunti i gusci di lipidi cationici mezzi di contrasto microbolle 7-9. Nei topi questi vettori che trasportano microbolle può essere somministrato per via endovenosa o direttamente al ventricolo sinistro del cuore. In animali più grandi possono anche essere infusa attraverso un catetere intracoronarico. La successiva consegna effettuata dalla circolazione per un organo bersaglio avviene per cavitazione acustica ad una frequenza di risonanza delle microbolle. Sembra probabile che l'energia meccanica generata dalla distruzione delle microbolle risultati transitori della formazione di pori o tra le cellule endoteliali del microcircolo della regione di destinazione 10. Come risultato di questo effetto sonoporazione, l'efficienza di trasfezione all'interno e attraverso le cellule endoteliali è rafforzata, e transgene codifica vettori sono depositati nel tessuto circostante. DNA plasmidico rimanendo in circolo è rapidamente degradato dalla nucleasi nel sangue, che riduce ulteriormente la probabilità di consegna non sonicato tessuti e conduce ad altamente specifici degli organi bersaglio trasfezione.
Protocollo
1. Microbolle magazzino preparazione
- In 10 ml di PBS mix di 200 mg di 1,2-dipalmitoil-sn-glicero-3-fosfatidilcolina e 50 mg di 1,2-dipalmitoil-sn-glicero-3-fosfatidiletanolamina con 1 g di glucosio.
- Riscaldare il miscuglio a bagno d'acqua bollente 20-30 minuti, mescolando pipetta ogni 5 minuti.
- La soluzione può essere conservato a 4 ° C per un massimo di 6 mesi.
2. Microbolle di preparazione
- Prendere un 250 microlitri della soluzione preparata magazzino microbolle e incubare a 40 ° C per 15 minuti.
- La pre-riscaldato soluzione microbolle viene poi trasferito in un microtubo 1,5 ml contenente 50 ml di glicerolo.
- 1-2 mg di DNA plasmidico purificato codifica per costruire l'espressione del gene di interesse (purificato in questo esempio da endotossine Qiagen libero MegaPrep kit, Qiagen, Germantown, MD, con una concentrazione ottimale di 4mg/ml). 2.4) PBS viene aggiunto a un volume finale di 500 microlitri. Endotossina libero maxipreps Qiagen vengono utilizzati, così come PBS sterile in modo da garantire la sterilità.
- L'aria nella microtubo viene poi sostituito con il gas Octafluoropropane.
- Il microtubo è poi agitato energicamente in un amalgamatore dentale per 20 secondi.
- Il subnatant DNA contenente residui e buffer che non è legato al microbolle viene poi accuratamente rimosso e lo strato di microbolle viene lavato tre volte con PBS sterile per rimuovere il DNA distaccati, e immessi sul ghiaccio tra ogni ciclo di lavaggio. Noi di solito raggiungere una efficienza di legame del 30-40%. Tutti i reagenti sono sterili e la cura è fatta per minimizzare la contaminazione.
- Il plasmide DNA legato microbolle vengono poi immessi sul ghiaccio per un massimo di due ore fino al momento dell'uso.
- Il subnatant rimosso dal microtubo dopo la miscelazione e la PBS lavaggi, può essere usato per determinare la concentrazione di DNA non legato, così come la quantità limite in base alla concentrazione nota iniziale, misurando la densità ottica di questa soluzione alla lunghezza d'onda di 260 nm utilizzando uno spettrofotometro.
3. Gli apparecchi di taratura
- Prima del primo utilizzo, un 1 trasduttore cavitazione MHz deve essere calibrato per assicurare un corretto indice meccanico e la ripetizione di impulso. Un sommergibile 1 MHz, 13mm, sfocata trasduttore è collegato ad una funzione 20 MHz / generatore di forme d'onda arbitrarie attraverso un amplificatore di potenza.
- Il trasduttore è posto in un contenitore di plastica pieno d'acqua, rivolte direttamente a un idrofono, che è stato collegato ad un oscilloscopio a 500 MHz tramite un amplificatore di carica.
- Forma d'onda, frequenza, ampiezza, ciclo burst, e di amplificazione di potenza possono essere modificati per ottenere il ciclo proprio dovere e indice meccanico ottimale per la cavitazione microbolle. Per questo particolare esperimento, abbiamo calibrato il sistema ad un indice meccanico pari a ~ 1,3 a 1 MHz.
4. Consegna microbolle & UTMD
- Prima della consegna microbolle e UTMD, topi C57BL / 6 sono stati anestetizzati con 100mg/kg xylazina ketamina e 5mg/kg mediante iniezione IP.
- Consegna microbolle è stato somministrato per via endovenosa attraverso una iniezione diretta nel ventricolo sinistro del cuore o attraverso il cateterismo coda vena. Per l'iniezione diretta cardiaco, un volume di 100 microlitri della plasmide DNA caricato soluzione microbolle viene iniettato attraverso un ago 30 gauge inserito anteriore 4 ° spazio intercostale, sotto visualizzazione ultrasonica nel ventricolo sinistro del cuore.
- Il bolo soluzione microbolle derivanti dalla iniezione interventricolare sinistro è visualizzata utilizzando Visual Sonics '38 MHz trasduttore ad ultrasuoni ad alta frequenza collocato in una posizione stazionaria sul torace del mouse in un asse lungo con VisualSonics' Vevo 2100 Imaging System. Tutte le siringhe e aghi sterili, assicurando l'ambiente più sterile possibile per queste iniezioni.
- Subito dopo l'iniezione, la distruzione delle microbolle viene effettuata per ~ 5 minuti con un secondo, più piccolo di dimensioni trasduttore a bassa frequenza di 1,0 MHz detenute direttamente sopra l'organo desiderato, il targeting distruzione di questa regione. In questo esempio, l'ecografia è stato somministrato al fegato ad una frequenza di ripetizione degli impulsi di 1,0 MHz, con un indice pari a circa 1,3-1,5 meccanico, e la ripetizione periodo di impulso di 100 ms per ogni 20 cicli. In alternativa, l'impulso può essere controllato al l'ECG del mouse (non mostrato in questo esperimento) ad una raffica di 3 fotogrammi degli ultrasuoni, ogni 4-6 cicli cardiaci. Si ottiene una maggiore efficienza di trasfezione con i protocolli che permettono il letto capillare di ricarica con le bolle tra raffiche di ultrasuoni.
5. Consegna Metodo Alternativo
Abbiamo scelto per evidenziare l'iniezione interventricolare a causa della complessità della procedura, ma in molti casi, come ad esempio l'infusione prolungata di microbolle, una vena codaproiezione è il metodo preferito. Per la coda vena metodo di consegna microbolle, il mouse è anestetizzato allo stesso modo. Una siringa contenente il plasmide DNA legato microbolle è collegato ad un calibro 27 ago / catetere venoso coda. Il catetere venoso coda è inserita nel terzo distale di entrambi le vene laterale destra o sinistra che lungo la coda del mouse. La siringa contenente le microbolle si trova in una pompa di infusione che gestisce automaticamente un volume uniforme preset di soluzione in un periodo di tempo predefinito. Noi di solito infondere 200-300μl ad un tasso di 3ml/hour.
Animal uso
Tutti gli animali sono stati trattati in conformità alla prassi buon animale come definito dalle autorità nazionali e / o enti locali il benessere degli animali, e tutto il lavoro degli animali è stato approvato dalla commissione competente (Università di cura degli animali alle Hawaii e del Comitato Istituzionale Usa, numero di omologazione 07-100 -3). Anestesia appropriata (ketamina / zylazine) è stato utilizzato e analgesici (Bupivicaine e buprenorfina) erano disponibili, anche se non richiesto.
6. Rappresentante dei risultati:
L'efficacia del UTMD-mediata consegna DNA plasmidico può essere valutato attraverso una varietà di metodi a seconda dei geni codificati nel costruire, come ad esempio, ma non limitato a, luciferasi imaging in vivo, B-gal ex colorazione in vivo, e / o immunohistology. In particolare, nella diagnostica per immagini bioluminescenza in vivo permette di monitorare la presenza e la durata dell'espressione genica nei topi serie transfettate con un plasmide codifica un gene reporter bioluminescenti (luciferasi). Il Xenogen In Vivo Imaging System (IVIS) (Caliper Life Sciences, Hopkinton, MA) è utilizzato per l'imaging bioluminescenti. Le immagini sono in genere conto di tutti i topi del primo giorno dopo UTMD trasfezione mediata e viene ripetuto ogni tre o quattro giorni fino a quando l'espressione genica bioluminescenti non è più percepibile a vista attraverso il sistema (Figura 1). Per preparare i topi bioluminescenti per l'imaging, i topi prima ricevere un'iniezione IP del reporter luciferasi sonda D-luciferina (Caliper Life Sciences) e sono poi anestetizzati ~ 3 minuti più tardi. Biodistribuzione del D-luciferina substrato è autorizzato a procedere per circa 10 minuti prima che l'animale si trova nella camera di imaging IVIS e una scansione completa immagine del corpo è presa. Durante l'acquisizione, i fotoni emessi dalla luciferasi lucciola / D-luciferina reazione fotochimica sono misurati. La figura 1 illustra simili immagini bioluminescenti IVIS del fegato seguenti UTMD, e nella Figura 2 è un epifluorescenza (100X), l'immagine del fegato transfettate con un anti-luciferasi anticorpo primario (Sigma-Aldrich) e AlexFluor-568 coniugato secondario (Invitrogen) . È chiaro a vedere che il fegato UTMD transfezione mediata ha colpito non solo le cellule endoteliali, ma il hepatocyes pure.
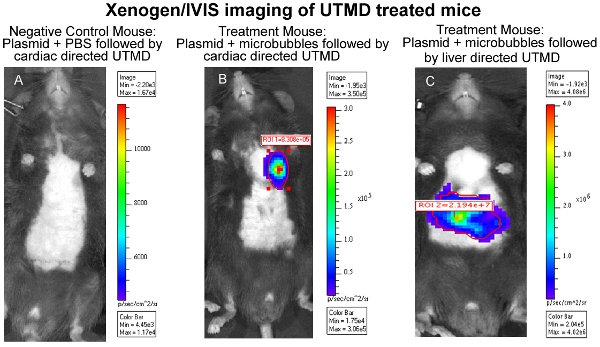
Figura 1 Xenogen / IVIS imaging cardiaco UTMD topi trattati (A) Mouse Controllo negativo:.. Plasmidi + PBS seguita da cardiaco diretto UTMD, (B) Mouse Trattamento: plasmidi + microbolle seguita da cardiaco diretto UTMD, e (C) Mouse trattamento : microbolle + plasmidi seguiti da fegato diretto UTMD.
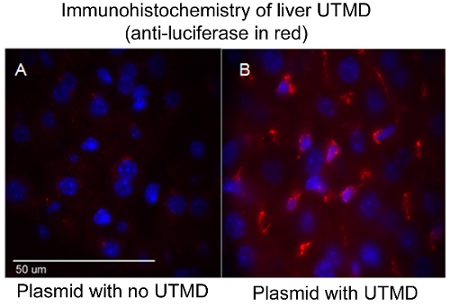
Figura 2. Immunoistochimica del fegato UTMD (anti-luciferasi in rosso). (A) plasmidi senza UTMD, e (B) plasmidi con UTMD. Immagine confocale (100X); nuclei sono blu DAPI colorati.
Discussione
UTMD rappresenta un nuovo approccio per la consegna del gene. Come una piattaforma tecnologica che può essere combinato con qualsiasi delle strategie di terapia genica molte potenzialità, per offrire una miriade di molecole bioattive, quando un alto grado di specificità del tessuto è voluta. Il principale limite biologico della tecnica è la bassa efficienza di trasfezione. Un'altra considerazione importante è l'accessibilità dei organo bersaglio a ultrasuoni, che possono essere notevolmente diminuita, int...
Divulgazioni
Riconoscimenti
Sovvenzioni ha incluso NHLBI HL080532, NHLBI HL073449, NCRR RR16453, e una nazionale AHA Grant-in dell'aiuto (a RVS). Un particolare ringraziamento è esteso al Corso di Progettazione e consulenza a distanza (DCDC) gruppo, dcdcgroup.org, per la loro assistenza con la produzione video e al US Department of Education Concessione n. P336C050047 che fondò la DCDC.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente / attrezzature | Azienda | Numero di catalogo | Commenti |
|---|---|---|---|
| 1,2-dipalmitoil-sn-glicero-3-fosfatidilcolina | Sigma-Aldrich | P-5911 | componente del guscio dei lipidi microbolle |
| 1,2-dipalmitoil-sn-glicero-3-fosfatidiletanolamina | Sigma-Aldrich | P-3275 | componente del guscio dei lipidi microbolle |
| glucosio | Sigma-Aldrich | G5400 | pensato per stabilizzare la microbolle |
| PBS | Sigma-Aldrich | P5368 | |
| glicerina | Sigma-Aldrich | G5516 | creduto per evitare microbolle di coalescenza |
| Octafluoropropane gas | Airgas | N / A | gas inerte utilizzato in applicazioni cliniche |
| Vialmix dentale amalgamatore | Bristol-Myers Squibb | N / A | |
| 1 MHz, 13mm, trasduttore unfocused | Olimpo | A303S-SU | |
| 20 Funzione MHz / Generatore di forme d'onda arbitrarie | Agilent | 33220A | |
| Amplificatore di potenza | Krohn-Hite Co. | Modello 7500 | |
| Idrofoni | Bruel e Kjaer | Tipo 1803 | |
| Amplificatore di carica | Bruel e Kjaer | Tipo 2634 | |
| 500 MHz Oscilloscopio | LeCroy | 9354L | |
| VisualSonics 'Vevo 2100 Imaging System con 34 MHz trasduttore | VisualSonics | 2100 | |
| 27G un pollice coda vena cateteri | VisualSonics | N / A | |
| Genie In più pompa di infusione | Kent scientifico | GENIE |
Riferimenti
- Bekeredjian, R., Chen, S., Frenkel, P. A., Grayburn, P. A., Shohet, R. V. Ultrasound-targeted microbubble destruction can repeatedly direct highly specific plasmid expression to the heart. Circulation. 108, 1022-1026 (2003).
- Bekeredjian, R., Katus, H. A., Kuecherer, H. F. Therapeutic use of ultrasound targeted microbubble destruction: a review of non-cardiac applications. Ultraschall Med. 27, 134-140 (2006).
- Chen, S. Regeneration of pancreatic islets in vivo by ultrasound-targeted gene therapy. Gene Ther. 17, 1411-1420 (2010).
- Miao, C. H. Ultrasound enhances gene delivery of human factor IX plasmid. Hum Gene Ther. 16, 893-905 (2005).
- Shimoda, M., Chen, S., Noguchi, H., Matsumoto, S., Grayburn, P. A. In vivo non-viral gene delivery of human vascular endothelial growth factor improves revascularisation and restoration of euglycaemia after human islet transplantation into mouse liver. Diabetologia. 53, 1669-1679 (2010).
- Shohet, R. V. Echocardiographic destruction of albumin microbubbles directs gene delivery to the myocardium. Circulation. 101, 2554-2556 (2000).
- Sirsi, S., Borden, M. Microbubble Compositions, Properties and Biomedical Applications. Bubble Sci Eng Technol. 1, 3-17 (2009).
- Li, H. L. Ultrasound-targeted microbubble destruction enhances AAV-mediated gene transfection in human RPE cells in vitro and rat retina in vivo. Gene Ther. 16, 1146-1153 (2009).
- Lindner, J. R. Microbubbles in medical imaging: current applications and future directions. Nat Rev Drug Discov. 3, 527-532 (2004).
- Newman, C. M., Bettinger, T. Gene therapy progress and prospects: ultrasound for gene transfer. Gene Ther. 14, 465-475 (2007).
- Vancraeynest, D. Myocardial injury induced by ultrasound-targeted microbubble destruction: evidence for the contribution of myocardial ischemia. Ultrasound Med Biol. 35, 672-679 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon