È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Intraspinale trapianto di cellule cervicali targeting per corno ventrale nella Sclerosi Laterale Amiotrofica e le lesioni traumatiche del midollo spinale
In questo articolo
Riepilogo
Trapianto precursore neurale è una strategia promettente per la protezione e / o la sostituzione di perduti / disfunzionale neuroni motori frenico cervicale nelle lesioni del midollo spinale (SCI) e la malattia del motoneurone, sclerosi laterali amiotrofica (SLA). Forniamo un protocollo per la consegna delle cellule cervicali per corno ventrale del midollo spinale in modelli di roditori della SLA e SCI.
Abstract
Compromissione respiratoria a causa della perdita dei motoneuroni frenico è una conseguenza debilitante di gran parte delle risorse umane lesioni traumatiche del midollo spinale (SCI) casi 1 ed è la causa ultima di morte nei pazienti con la malattia del motoneurone, sclerosi laterali amiotrofica (SLA) 2.
La SLA è una malattia neurologica devastante che è caratterizzata da degenerazione relativamente rapido di neuroni motori superiori ed inferiori. I pazienti alla fine soccombere alla malattia in media 2-5 anni dopo la diagnosi a causa della paralisi respiratoria a causa della perdita dei motoneuroni innnervation frenico del diaframma 3. La stragrande maggioranza dei casi sono sporadici, mentre il 10% sono della forma familiare. Circa il venti per cento dei casi familiari sono legati a mutazioni puntiformi diverse nel Cu / Zn superossido dismutasi 1 (SOD1) del gene sul cromosoma 21 4. Topi transgenici 4,5 e 6 ratti trasporto umano SOD1 mutante geni (G93A, G37R, G86R, G85R) sono stati generati, e, nonostante l'esistenza di altri modelli animali di perdita dei motoneuroni, sono attualmente i modelli più utilizzati altamente della malattia .
Lesioni del midollo spinale (SCI) è un insieme eterogeneo di condizioni derivanti da traumi fisici al midollo spinale, con risultato funzionale variabile a seconda del tipo di posizione, e la gravità delle lesioni 7. Tuttavia, circa la metà dei casi umani SCI influenzare regioni cervicale, con conseguente debilitante disfunzioni respiratorie a causa di frenico perdita di neuroni motori e lesioni a discendente assoni respiratorie bulbospinal 1. Un certo numero di modelli animali di SCI sono stati sviluppati, con i più usati e clinicamente rilevanti è la contusione 8.
Il trapianto di varie classi di cellule precursori neurali (NPC) è una promettente strategia terapeutica per il trattamento di lesioni traumatiche del SNC e neurodegenerazione, tra SLA e SCI, a causa della possibilità di sostituire neuroprotezione persi o SNC disfunzionale tipi di cellule, fornire e distribuire i fattori gene di interesse 9.
Modelli animali di sclerosi laterale amiotrofica e SCI sia possibile modellare molti aspetti clinicamente rilevanti di queste malattie, tra cui la perdita frenico neurone motore e la conseguente compromissione respiratoria 10,11. Al fine di valutare l'efficacia della NPC strategie basate sulla funzione respiratoria in questi modelli animali di sclerosi laterale amiotrofica e SCI, interventi cellulare deve essere specificamente indirizzato alle regioni contenenti terapeuticamente obiettivi importanti come i neuroni motori frenico. Forniamo un protocollo dettagliato per il multi-segmentale, il trapianto intraspinale di NPC nel midollo spinale cervicale materia grigia ventrale dei modelli neurodegenerative come topi G93A SOD1 e ratti, così come i ratti con lesione spinale e topi 11.
Protocollo
Metodi
1. Preparazione delle cellule
Come esempio, descriveremo la procedura per la preparazione di cellule progenitrici gliali 12 per il trapianto a causa della nostra esperienza con questo tipo di cellule. Tuttavia, le specifiche del protocollo, tra cui media e l'uso di tripsina per esempio, dipende dal tipo di cellula particolare utilizzato per il trapianto.
- Pre-caldo tutte le soluzioni al 37,0 ° C a bagnomaria.
- Risciacquare 2X pallone con HBSS. Aggiungere 5,0 mL/T-75 fiasco del 0,05% tripsina / EDTA. Incubare fiasco per 3 minuti a 37,0 ° C incubatore. Triturare 3X delicatamente a pallone con 5 o 10 ml pipetta.
Opzionale: Aggiungere 5,0 mL/T-75 fiasco di 1,0 mg / ml di tripsina inibitore della soia in DMEM/F12.
- Lavare ogni beuta 2X in 5,0 ml di terreno. Cellule piscina e risciacqui. Mantenere le cellule in ghiaccio per tutte le fasi successive.
- Spin a 200-300 g per 5 minuti in tubo conico: preferibilmente in centrifuga raffreddato a 4 ° C. Decantare (e salvare) surnatante. Risospendere le cellule in 1,0 ml di mezzo, e il trasferimento a 1,5 ml di tubo Eppendorf.
- Contare le celle con emocitometro utilizzando Tricloroetano per determinare la vitalità.
- Girare di nuovo nel tubo 1,5 ml (800 RPM per 10 minuti: preferibilmente in centrifuga raffreddata a 4 ° C). Decantare (e salvare) surnatante.
- Risospendere le cellule nel volume finale desiderato di media per raggiungere appropriata densità delle cellule.
- Distribuire sospensioni cellulari a più 1,5 ml provette Eppendorf. Mantenere le cellule in ghiaccio umido fino trapianto.
Non usare 0,75 mL, come la siringa Hamilton / ago non può andare bene in profondità questo tubo. Iniezioni multiple sarà probabilmente fatto durante le sessioni di chirurgia, e si vuole evitare di disturbare il tubo stesso di cellule molte volte. Provate a preparare il volume di almeno il 50% in più di sospensione cellulare che è necessario. Mantenere le cellule in ghiaccio per tutta la sessione l'intervento chirurgico. Trapianto di cellule entro 4-5 ore di preparazione di sospensioni cellulari al fine di assicurare maggiore vitalità delle cellule post-trapianto.
2. Preparazione prima dell'intervento
- Relativa condotta valutazione del comportamento di base prima dell'intervento.
- Soppressione immunitaria: ciclosporina A per via sottocutanea (CSA: 10,0 mg / kg di peso corporeo) o intraperitoneale (IP) FK-506/Rapamycin (1,0 mg / kg di peso corporeo) deve essere iniziato almeno 3 giorni prima del trapianto, e dovrebbe essere i giorni, fino sacrificio. Amministrazione in acqua potabile (al posto di iniezioni al giorno) non è consigliato. CSA è il nostro immunosoppressori di scelta quando trapiantare roditori cellule derivate, mentre FK-506/Rapamycin è la nostra scelta quando il trapianto di cellule umane derivate.
- Autoclave strumenti chirurgici prima dell'intervento. Preparare un luogo ordinato e pulito di fare l'intervento, così come un luogo ordinato di mettere gli strumenti. Un bicchiere di perle sterilizzatore è anche utile. Tenere tutti gli strumenti di pulizia (in particolare pinza ossivora) durante l'intervento chirurgico, in quanto questo renderà la procedura più semplice. Qualsiasi materiale utilizzato durante la procedura chirurgica deve essere sterile.
- Strumenti che non possono essere sterilizzati come il microscopio chirurgico dovrebbe essere pulito con un disinfettante appropriato e le maniglie ricoperto di materiale sterile (garza ad esempio) in modo che il chirurgo, una volta indossato con guanti sterili, non contamina il suo / suoi guanti.
- Il chirurgo deve lavarsi le / le mani con un disinfettante (clorexidina macchia) prima di iniziare l'intervento chirurgico. Il chirurgo indossare guanti sterili, una maschera, e un abito pulito.
3. Chirurgia: Preparazione degli animali e Chirurgia
Animali di preparazione:
- Pesare animale, e somministrare la dose appropriata di anestesia: l'inalazione Isofluorane o un cocktail anestetico (forniti tramite IP) di [acepromazina maleato (0,7 mg / kg), ketamina (95 mg / kg), e xilazina (10 mg / kg)].
- Toe pizzico e / o utilizzare il riflesso palpebrale (toccando la palpebra superiore con cotone punta applicatore di osservare lampeggiante) per determinare se l'animale viene adeguatamente anestetizzato. Le cornee devono essere protetti mediante l'applicazione di un unguento artificiale lacrima prima dell'intervento.
- Radersi i capelli con il rasoio elettrico (allegato n. necessario). Barba da poco rostrale per le orecchie al centro della schiena dell'animale. Shave bene, e rimuovere i peli tagliati dalla pelle per evitare che i capelli entrare in incisione. La preparazione chirurgica deve essere eseguita lontano dalla zona dove l'intervento chirurgico sarà effettuato per evitare la contaminazione del sito chirurgico con i capelli randagi.
- Bagnare con garza Povidine-iodio soluzione antisettica, e si applicano a pelle sopra zona rasata. Il sito chirurgico dovrebbe essere rimosso almeno due volte con la Povidine-iodio soluzione, facendo attenzione a macchia dal centro del sito verso la periferia. Il sito può essere sciacquato con il 70% di alcool o diluito macchia germicida. L'area dovrebbe essere coperto con teli sterili.
- Per tutta la chirurgia, l'uso di un impianto di riscaldamento i pads altamente consigliato per mantenere la normale temperatura del corpo dell'animale. Inoltre, la temperatura corporea deve essere monitorata. Animali luogo il tampone di garza arrotolata. Per un ratto adulto, la garza arrotolata dovrebbe essere ~ 1.0 pollici di spessore e ~ 6.0 pollici di lunghezza. Nastro questo pad a bordo intervento chirurgico in modo che non si muove. Animali luogo il blocco a livello del petto / spalla. Stendere entrambe le braccia sul pad, e nastro le armi a bordo di un intervento chirurgico. L'idea è quella di puntellare il midollo spinale cervicale in modo che sia più facile lavorare per tutta la chirurgia in quanto il midollo cervicale si trova in profondità sotto la superficie della pelle.
Chirurgia:
- Sul ingrandimento più microscopio (usiamo ingrandimento 8 x), utilizzare bisturi per fare un'incisione sulla linea mediana. Allungare la pelle lateralmente con l'altra mano per rendere la pelle tesa (che rende la pelle più facile da incidere), e fare incisione dalla base del cranio alla scapola. (Vedi Figura 1)
- Usa bisturi per fare un'incisione a 3 strati muscolari sopra la colonna vertebrale. Spremere leggermente il muscolo (da laterale a mediale) su entrambi i lati con l'altra mano. Assicurarsi di premere con forza sufficiente con bisturi per tagliare tutti i livelli muscolari con il minor numero di tagli il più possibile in modo da incisioni muscolare non sarà frastagliata, il che rende la sutura a fine intervento chirurgico più facile. Tuttavia, non premere troppo forte per evitare di provocare danni a tessuti più profondi (colonna spinale).
- Con due punte di cotone, utilizzare movimento di rotazione per separare muscolare sovrastante da muscoli paravertebrali. Si può essere vigorosa qui. Non tagliare o strappare, ciò causerebbe un'emorragia. Moto rotatorio con gli applicatori sarà bene prendere in giro il tessuto a parte, senza causare danni o emorragia. Se l'emorragia si verifica in ogni fase della chirurgia, è meglio essere pazienti. Non cercare di correre avanti con un sacco di emorragia perché il sangue si oscura visione del campo operatorio. Cauterizzazione o leggera pressione può essere applicata al sito di emorragia, ma troviamo che la pazienza è meglio. Con la pratica, ci dovrebbe essere emorragia poco o niente in tutto questo un intervento chirurgico.
- Ritrarre muscolare con 4 divaricatori fatti in casa (vedi Figura 2). Questi retrattori può essere fatto da graffette robusto modellato in un divaricatore (vedi Figura 2-riquadro). Autoclave questi prima dell'intervento chirurgico. Si deve prestare attenzione a smussare le estremità dei divaricatori per evitare danni ai tessuti. Cravatta stringa retrattore. L'esposizione deve essere quadrata / a forma di rettangolo. Questa forma può essere raggiunto tirando a 4 angoli utilizzando i 4 divaricatori. Nastro stringa di salire a bordo per garantire divaricatori (vedi Figura 2). Disponibile in commercio retrattori può anche essere usato, ma preferiamo non utilizzare questi. E 'fondamentale creare un buon campo chirurgico al fine di vedere chiaramente in tutto l'intervento. Non "alla cieca" continuare lungo.
- Chiaro muscoli paraspinali dalla superficie dorsale della colonna vertebrale. Per far fronte a muscoli paraspinali sulla superficie dorsale della colonna vertebrale, ci sono 2 possibili strategie. Per la prima strategia, l'uso topo dai denti a pinza e medie imprese forbici primavera per rimuovere dalla superficie dei muscoli paravertebrali dorsali delle vertebre. Provate a fare tagli molto vicino alle ossa per esporre meglio superficie ossea. Effettuare tagli paralleli alla superficie di vertebre, ma non abbattuto in corda. Per il secondo approccio, fare una incisione mediana para-spinale muscolare, e ritrarre lateralmente con piccoli divaricatori. Nel secondo approccio, il muscolo può essere suturato di nuovo insieme dopo l'intervento chirurgico.
- Pulire la superficie del tessuto osseo vertebrale bene. Utilizzare pinza ossivora (il più importante strumento chirurgico) ad allontanarsi dai livelli muscolari C4, C5 e C6 (vedi Figura 3). Questo, ovviamente, dipende dai livelli spinali che sono indirizzate. Durante l'utilizzo di pinza ossivora con una mano, sicuro intera colonna vertebrale afferrando muscolare sul processo C2 con il topo dai denti pinze in mano. C2 è il processo di grande rostrale in campo chirurgico. C3 è leggermente sotto il muscolo pure. C4, C5 e C6 sono di facile accesso perché hanno muscoli poco sovrastante loro.
- Inizia con laminectomia di C5. Ancora una volta, sicuro tenendo C2 con topo-pinza dentata. Grab lamina intera (vedi schema: prendere nei pressi della linea mediana) con pinza ossivora. Pinza ossivora posizione in modo che lo strumento è completamente perpendicolare all'asse della colonna vertebrale. Lentamente schiacciare lamina. Non spingere giù nel midollo spinale, in quanto ciò causa danni al tessuto spinale. Schiacciare e tirare delicatamente verso l'alto del pezzo rotto l'osso. Pinza ossivora deve frantumare pezzo in modo che si può facilmente tirare fuori da rimuovere. Se il pezzo di osso è ancora attaccato al resto della lamina, non tirare ciò causerebbe un'emorragia e possibili lesioni al midollo spinale. Pinza ossivora devono essere pulite e nitide. Strumenti come la pinza ossivora devono essere lavati / puliti con soluzione salina sterile, che possono essere forniti in una ciotola sterili (vedi figura 4).
Per l'apertura iniziale del laminectomia, posizionando la perpendicolare pinza ossivoraperpendicolare alla colonna vertebrale è preferibile. Questa fase può essere seguita prendendo piccolo "stuzzichini" per estendere la laminectomia inserendo la pinza ossivora delicatamente sotto l'osso con un angolo di circa 30-60 gradi rispetto alla superficie del cordone ombelicale. - Laminectomia estendere a tutti i C4-C6 lamine. Effettuare una costante apertura nell'osso su tre livelli della colonna vertebrale. L'entità della laminectomia può essere regolata in base alla posizione desiderata (s) di iniezione intraspinale.
- Non estendere laminectomia troppo lontano lateralmente perché questo farà sì che emorragia. Al fine di mirare corno ventrale, il sito di iniezione è relativamente mediale, per cui è necessario estendere laminectomia lontano lateralmente. (Vedi Figura 5)
- Aumentare l'ingrandimento a ~ 15 x.
- Pulire il tessuto connettivo (e possibili sangue secco) in cima dura con taglienti / diritto pinze # 5. La differenza tra il tessuto connettivo e la durata deve essere appreso con l'esperienza.
- Incise dura, uno strato molto duro meningea, sia con mini-primavera forbici o microknife. Fare un'incisione parallela all'asse della colonna vertebrale appena mediale alla zona ingresso del radichette dorsali. Ciò permetterà uno a bersaglio il corno ventrale. (Vedi Figura 6)
- Utilizzare taglienti / bisessuale # 5 pinze per afferrare e sollevare leggermente dura fuori del midollo spinale. Non schiacciare / danneggiare il midollo spinale. Questo richiede una certa pratica. Fai incisioni con le forbici a molla microknife o molto piccoli. Non danneggiare il midollo spinale.
- Estendere incisione leggermente in rostrale-caudale asse. La tensione della dura sarà leggermente separato durata di creare una bella esposizione del midollo spinale.
- Fai incisioni in tutti i siti appropriati per ogni iniezione previsto. Dura ha un aspetto traslucido indistinto, mentre la superficie del midollo spinale è più luminoso di un bianco di colore aspetto. Uno sarà bisogno di imparare a distinguere questi pezzi. E 'consigliabile non cercare di iniettare attraverso la dura con l'ago di iniezione. La dura è dura, in modo che sarà difficile perforare attraverso di essa. Inoltre, perforando la durata può influenzare la traiettoria di inserimento dell'ago e influenzerà pertanto la consegna anatomicamente mirata di cellule.
- Iniettare cellule bilateralmente a 3 livelli (6 siti in totale) per indirizzare grande regione di allargamento del collo dell'utero. Il numero e la posizione (s) di iniezioni, ovviamente, dipende dalla esperimento specifico.
- Dopo aver forato dura madre, il liquido cerebrospinale effonderò. Superficie asciutta del midollo e l'esposizione intero con garza o cotone con punta applicatore.
- Per l'iniezione di cellule, utilizzare 10.0μL Hamilton a tenuta di gas RN siringa.
- Allega 33-gauge / 45 gradi in metallo smussato RN ago Hamilton. L'ago deve essere forte. Utilizzare lo stesso ago per soli 20 iniezioni (l'ago sarà più nitida con meno iniezioni). Si può anche utilizzare tubi di vetro tirato capillare per aghi. Usa epossidica per collegare punta di vetro tirato a 26-gauge metallo contundente ago Hamilton. Trim diametro esterno punta a ~ 75,0-100,0 microlitri (a seconda del diametro delle cellule: non si vuole danneggiare le cellule durante il processo di iniezione) utilizzando un microscopio operatorio e far scorrere micrometro. Noi preferiamo il 33-gauge aghi metallici.
- Cellule cadrà fuori di sospensione facilmente all'interno del tubo Eppendorf sul ghiaccio. Immediatamente prima di caricare la siringa per iniezione, picchiettare leggermente tubo fino a quando le cellule tornare in sospensione. Non flick troppo intensamente come questo danneggiano le cellule e / o bolle causa. In alternativa, utilizzare 20.0μL pipetta-man di mescolare delicatamente le cellule: sospensione cellulare pipetta solo una o due volte su e giù.
- Il volume di carico abbastanza sospensione cellulare per un solo sito di iniezione. Cellule cadrà fuori di sospensione all'interno di siringa, se si progetta di fare iniezioni multiple. Lentamente prendere le cellule in siringa per evitare bolle e / o danni alle cellule. In particolare per le cellule progenitrici gliali con cui lavoriamo nel nostro laboratorio, abbiamo iniettare 2,0 ml di sospensione cellulare a una diluizione di 50,000-75,000 cellule per 1,0 microlitri oltre 2-5 minuti. Abbiamo scoperto che 2uL/site non comporta danni ai tessuti del midollo spinale cervicale. Invece, la nostra esperienza suggerisce che aumentando notevolmente il numero di cellule in questo volume (soprattutto se sono di dimensioni maggiori rispetto ai nostri progenitori gliali: 10,0 -20,0 micron di diametro), può causare danni al parenchima del midollo spinale. Abbiamo condotto un esteso esperimento di dosaggio cella per determinare il numero ottimale di cellule da iniettare in ogni sito (almeno nel intatto midollo spinale cervicale). I parametri devono essere determinati per il tipo di cellule specifiche e condizione di malattia.
- Allineare siringa / ago parallelo con l'asse della colonna vertebrale per indirizzare correttamente desiderato regione anatomica. L'ago è angolato quanto basta (circa 80 gradi rispetto al tavolo operatorio) per non urtare la testa chirurgico portata, ma più vicino a 90 gradi possibile. Abbassare punta verso la superficie dorsale del midollo spinale tramite microscopio (vedi Figura 7).
- Puntare l'ago appena mediale all'ingresso zona delle radichette dorsali (vedi Figura 8). Delicatamente toccare la superficie del midollo spinale con punta di spillo. Leggermente deprimono il midollo spinale con l'ago. Ritrarre l'ago fino al midollo spinale è tornato alla normalità. Registra questa posizione di z = 0.0 utilizzando il righello sul micromanipolatore.
Nota: Noi abitualmente non stabilizzare la colonna vertebrale cervicale durante iniezioni di midollo spinale. Utilizzando il nostro regime anestetico, il movimento su-e-giù del midollo spinale cervicale a causa di respiro pesante non è mai stato un problema. Tuttavia, se la respirazione pesante è un problema, la colonna vertebrale possono essere stabilizzati con una cornice personalizzata con delicatezza bloccaggio l'osso circostante e para-spinale muscolare a livelli C2 e C7 con pinze modificate, facendo attenzione a non schiacciare l'osso vertebrale o ferire l' sottostante tessuto del midollo spinale. Se la respirazione degli animali diventa superficiale durante la procedura, farmaco più anestetico dovrebbe essere fornita. L'intervento dovrebbe essere interrotta fino a quando un aereo di anestesia chirurgica è stato ri-raggiunto prima di riprendere. - L'ago leggermente più basso in midollo spinale. Assicurati di guardare nel microscopio mentre fanno questo. Abbassare l'ago alla profondità di 1,5 mm per indirizzare corno ventrale nei ratti adulti. Abbassare l'ago alla profondità di 0,75 mm a bersaglio corno ventrale in topi adulti. (Vedi Figura 9). Questi numeri profondità sono rappresentativi di adulti (almeno 3 mesi di età) maschili e femminili ratti Sprague-Dawley (250-450 grammi) e C57BL / 6 topi (20-35 grammi). Naturalmente, la profondità e la posizione laterale dipendono dalla regione di interesse specifico. Non disturbare sistema di iniezione / chirurgia pensione o tavolo operatorio, mentre l'ago viene inserito nel midollo spinale per evitare danni al tessuto spinale.
- Attendere due minuti (è più lungo ancora meglio) dopo l'abbassamento ago alla profondità desiderata prima dell'iniezione.
- Iniettare 2,0 microlitri oltre 2-5 minuti a velocità costante con controllo della pompa.
- Attendere due minuti (è più lunga migliore) dopo l'iniezione, prima di rimuovere l'ago lentamente dal midollo spinale.
- Siringa pulita con dH2O dopo ogni iniezione per evitare intasamenti. Lentamente elaborare ed espellere 3-5 volte. Non aspirare l'aria nella siringa.
- Tornare alla grandezza più basso (lo stesso utilizzato all'inizio di un intervento chirurgico: ~ 8 x). Sutura dura chiuso con 9-0 sutura, ma questo non è assolutamente necessario. E 'anche difficile. Noi suturata Dura chiuso in passato, ma non troviamo differenza nel comportamento degli animali, la sopravvivenza di trapianto o istologia del midollo spinale, quando la dura non è chiusa con sutura. La durata può essere coperto con un pezzo di schiuma protettiva gel sterile. La schiuma gel dovrebbe essere posizionato direttamente sulla parte superiore del sito di incisione durale. Tuttavia, è importante fare attenzione a non tirare bruscamente questo pezzo di Gelfoam fuori della superficie del midollo spinale durante la post-perfusione dissezione, come a volte può Gelfoam saldamente aderire alla superficie del midollo spinale.
- Opzionale: sutura dei muscoli paravertebrali si è chiuso con sutura 4-0.
- Sutura chiuso tre strati muscolari sovrapposti in una sola volta con sutura 4-0. Muscoli sutura in tre sedi nel rostrale-caudale asse (vedi figura 10).
- Pelle di base è chiuso con clip 9,0 millimetri ferita (vedi Figura 11). Stringere con punti metallici porta-aghi per evitare che animali di tirare fuori graffette prima di guarigione completa. Spazio graffette di circa 0,5 centimetri di distanza. Non stringere eccessivamente le clip ferita, in quanto questo può portare a una guarigione non e necrosi.
- Applicare Povidine-iodio soluzione antisettica per zona ferita con garza imbevuta.
- Permettono all'animale di recuperare il pad circolare acqua calda. Dare iniezioni sottocutanee di soluzione sterile di Ringer lattato (5,0 ml per topo, 0,5 ml per il mouse) immediatamente dopo l'intervento. Follow-up iniezioni possono essere fornite anche se l'animale appare disidratati e / o svogliati. Il trattamento profilattico con antibiotici 6.0mg/kg di Cefazolina può essere utilizzato, tuttavia, la nostra esperienza suggerisce che questa procedura di trapianto non si traduca in post-chirurgica delle infezioni se una tecnica asettica è seguito e tutti gli strumenti / materiali chirurgici vengono sterilizzati. Se queste precauzioni sono seguiti, somministrazione di antibiotici è sconsigliato.
- Continua CSA o FK-506/Rapamycin ogni giorno fino sacrificio.
- L'intero intervento dovrebbe richiedere meno di ~ 45 minuti (con 6 sedi di iniezione). In caso contrario, l'animale comincia a svegliarsi e respirare più forte, che pregiudicherebbero iniezione nel midollo spinale.
Suggerimenti per la risoluzione dei problemi associati con vari passaggi del protocollo
Mancanza di sopravvivenza cellulare / poveri: questa non è probabilmente un problema tecnico associato con l'iniezione, ma è probabilmente dovuto alle proprietà del tipo di cellula è iniettata e / o per il regime immunesuppression. Questi problemi devono essere empiricamente valutati su una cella di tipo e modello base animale specifico. La disponibilità di un certo numero di immuno-deficienti modelli ratto e nel toposono disponibili anche per aggirare problemi con immunesuppression, tuttavia, questi animali presenti anche difficoltà come il costo, la necessità di mantenere una colonia, e cautela aggiuntive necessarie durante l'intervento e l'alloggio.
Deficit funzionali osservata dopo l'intervento: Nella nostra esperienza, non abbiamo osservato il verificarsi di eventuali deficit funzionali seguendo questa procedura quando valutati da misure come la zampa anteriore e la forza di presa degli arti posteriori e del nervo frenico / diaframma composti potenziali d'azione muscolare, anche con 6 siti di iniezioni ( di 2μL ciascuno) nel midollo spinale cervicale. Distruzione dei tessuti non è stato osservato anche. I motivi possibili per il verificarsi di questi problemi sono: non si utilizza l'ago calibro suggerito, iniettare maggiori volumi e / o numero di cellule, danni involontari causati da laminectomia improprio, mancanza di delicatezza, mentre il taglio della dura (come pizzicare la corda con la # 5 forcipe) o durante il processo di inserimento dell'ago Hamilton nel midollo spinale (sostituire un ago opaco).
Le cellule non si trovano in ventrale materia grigia: Questo potrebbe essere dovuto a una serie di questioni. Se l'iniezione non trova la porta medialmente o lateralmente, assicuratevi di linea correttamente il sistema di iniezione in parallelo con l'asse del midollo spinale, e inserire l'ago appena mediale per l'ingresso del radichette dorsali. Se l'iniezione non trova la porta dorsalmente o ventralmente, assicurati a zero il vostro z la lettura quando la punta dell'ago è appena tocca la superficie dorsale del midollo spinale, utilizzare l'ago suggerito Hamilton con lo smusso appropriato (uno smusso più possono influenzare targeting), assicurare che il midollo spinale non comprime quando si inserisce l'ago, fare attenzione a misurare esattamente la profondità con il micromanipolatore, e utilizzare gli animali all'interno della gamma di peso suggerito. Regolare la vostra tecnica di conseguenza se si è costantemente iniettando le cellule in un luogo (il che richiede una valutazione istologica e successive modificazioni tecnica). Se le iniezioni sono sparsi in modo casuale a tutti i siti di iniezione, avrete bisogno di pratica per migliorare la coerenza. Se le cellule tendono ad essere collocati per lo più alla parte dorsale del midollo spinale lungo il percorso dell'ago, attendere più a lungo, prima e dopo l'iniezione di cellule, ed estendere l'iniezione effettivi su un periodo di tempo più lungo.
4. Rappresentante dei risultati:
Mouse-derivato cellule progenitrici gliali sono stati trapiantati (50.000 cellule / sito) nel corno ventrale del C4 livello del midollo spinale in un adulto ratto SOD1 G93A. Mouse-derivate le cellule trapiantate possono essere distinte da tessuto ospite ratto attraverso il rilevamento con il mouse-anticorpo specifico, M2. Questa immagine mostra la sopravvivenza della M2 + trapianto di cellule derivate a 1 mese dopo il trapianto (vedi Figura 12). Le cellule localizzate alla materia grigia ventrale, ma il sito di iniezione medialmente perso il corno ventrale laterale (la posizione della maggior parte dei neuroni motori frenico: indicato con linea tratteggiata). Nessuna formazione di cisti è stata osservata quando 50.000 cellule sono state iniettate per ogni sito, e nessuna alterazione del comportamento risulta dalla procedura di iniezione. Tuttavia, l'iniezione di un numero molto più elevato di cellule (il numero effettivo varia a seconda del tipo di cellula, e dovrebbe essere sistematicamente valutati) comporta danni al sito di iniezione e lungo il percorso dell'ago (vedi Figura 13: immunoistochimica con il marcatore astrociti, GFAP) .
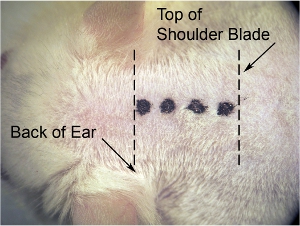
Figura 1. Incisione iniziale di pelle. Sul ingrandimento più microscopio (usiamo ingrandimento 8 x), utilizzare bisturi per fare un'incisione sulla linea mediana. Allungare la pelle lateralmente con l'altra mano per rendere la pelle tesa (che rende la pelle più facile da tagliare), e fare incisione (indicato da una fitta linea tratteggiata) dalla base del cranio (a livello della parte posteriore delle orecchie) della scapola (denotato dalla sottile linea tratteggiata).
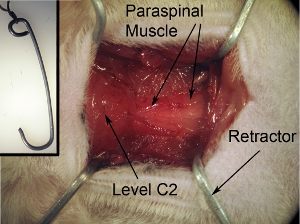
Figura 2. L'esposizione del campo chirurgico. L'esposizione chirurgica devono essere quadrati / a forma di rettangolo. Questa forma può essere raggiunto tirando il muscolo che circonda verso 4 angoli utilizzando i 4 divaricatori. Stringa del nastro che è collegato a divaricatori a bordo chirurgico al fine di garantire divaricatori e mantenere correttamente in campo aperto.
Figura 2-inserto. Divaricatori per l'esposizione del campo operatorio. I divaricatori vengono utilizzati per tirare indietro muscolare al fine di creare un campo chirurgico sia con una chiara visibilità del midollo spinale e lo spazio sufficiente per eseguire un intervento chirurgico. Retrattori può essere effettuato con robuste graffette plasmare nella forma desiderata e le dimensioni. Autoclave divaricatori la prima per un intervento chirurgico. Cravatta stringa retrattore.
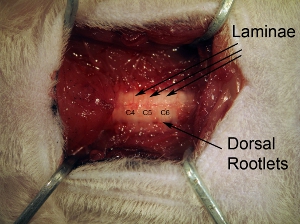
Figura3. Vertebre. Rimozione seguito di muscoli paravertebrali, pulire accuratamente la superficie dorsale delle vertebre con pinza ossivora. Lamina individuali può essere visto, così come radichette dorsali entrando da parte laterale della colonna vertebrale.
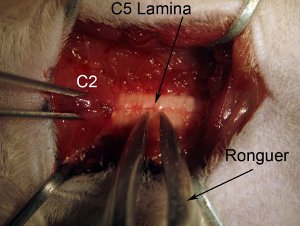
Figura 4. Laminectomia. Iniziate laminectomia a livello C5 del midollo spinale. Sicuro colonna vertebrale tenendo muscolare sovrastante livello C2 con topo pinza dentata. Grab lamina intera (vedi schema: prendere nei pressi della linea mediana) con pinza ossivora. Pinza ossivora posizione in modo che lo strumento è completamente perpendicolare all'asse della colonna vertebrale. Lentamente schiacciare lamina. Non spingere giù nel midollo spinale, in quanto ciò causa danni al tessuto spinale. Schiacciare e tirare delicatamente verso l'alto del pezzo rotto l'osso. Pinza ossivora deve frantumare pezzo in modo che si può facilmente tirare fuori da rimuovere. Se il pezzo di osso è ancora attaccato al resto della lamine, non tirare ciò causerebbe un'emorragia e possibili lesioni al midollo spinale. Pinza ossivora devono essere pulite e nitide.
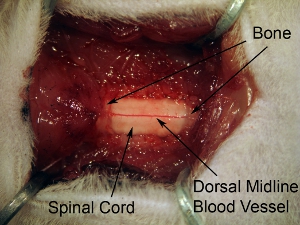
Figura 5. Esposizione di laminectomia spinale seguenti tessuto del midollo. Estendere laminectomia per smascherare tutti i C4-C6 midollo spinale. Fare 1 costante apertura nell'osso su 3 livelli spinale. Non estendere laminectomia troppo lontano lateralmente perché questo farà sì che emorragia. Al fine di mirare corno ventrale, il sito di iniezione è relativamente mediale, per cui è necessario estendere laminectomia nella misura completa laterale dell'osso vertebrale.
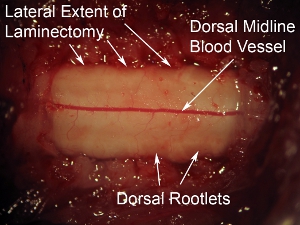
Figura 6. Alto ingrandimento della superficie dorsale del midollo spinale. Il vaso sanguigno dorsale prominente può essere visto correre lungo la linea mediana del midollo spinale. Questo modello di vaso sanguigno si osserva nella maggior parte dei casi, tuttavia, alcuni animali visualizzare un non-linea mediana traiettoria del vaso sanguigno. Le radici dorsali possono essere visti presso gli aspetti laterali della superficie dorsale del midollo spinale. Relativo alla durata sovrastante il midollo spinale, i nervi hanno un aspetto nebuloso.
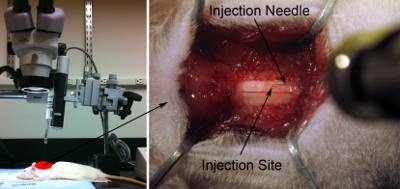
Figura 7. Iniezione di setup. Allineare siringa / ago parallelo con l'asse della colonna vertebrale per indirizzare correttamente desiderato regione anatomica. L'ago è angolato appena sufficiente (circa 80 gradi rispetto al tavolo operatorio) per non urtare la testa chirurgico portata, ma più vicino a 90 gradi possibile (pannello di sinistra). Injection punta inferiore verso la superficie del midollo spinale dorsale utilizzando il microscopio (pannello di destra). Delicatamente toccare la superficie del midollo spinale con punta di spillo. Premere leggermente il cavo con l'ago. Ritrarre l'ago fino al midollo spinale è tornato alla normalità stato piatto. Registra questa posizione come z = 0.0 utilizzando il righello sul micromanipolatore.
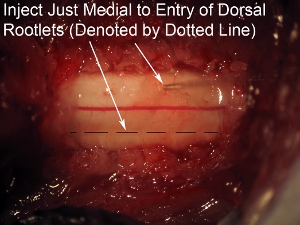
Figura 8. Alto ingrandimento spinale ago Obiettivo iniezione cavo solo mediale alla zona ingresso del radichette dorsale (indicata con linea tratteggiata).
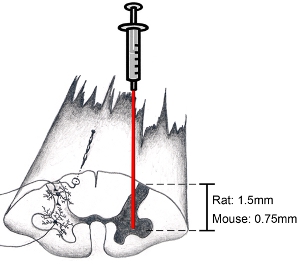
Figura 9. Schema del midollo spinale: come bersaglio regione anatomica di interesse Quando si tenta di indirizzare il corno ventrale, incidere parallela all'asse durata della colonna vertebrale appena mediale alla zona ingresso del radichette dorsali.. Ciò permetterà uno a bersaglio il corno ventrale. Abbassare l'ago alla profondità di 1,5 mm per indirizzare corno ventrale nei ratti adulti (l'età e il sesso che l'animale non fa molta differenza in profondità). Abbassare l'ago alla profondità di 0,75 mm a bersaglio corno ventrale in topi adulti. Naturalmente, la profondità e la posizione laterale dipendono dalla regione di interesse specifico.
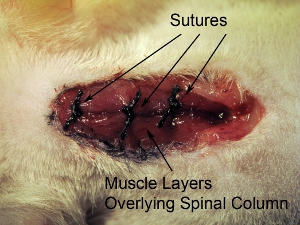
Figura 10. Chiusura del sito chirurgico. Sutura chiuso tre strati muscolari sovrapposti in una sola volta con sutura 4-0. Sutura dei muscoli a 3 sedi in rostrale-caudale asse.
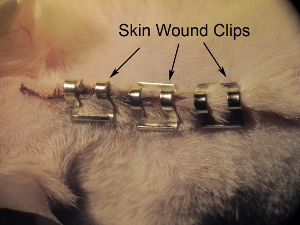
Figura 11. Pinzatura di pelle. Pinzatura pelle chiusa con clip 9,0 millimetri ferita. Stringere con punti metallici porta-aghi per evitare che l'animale da tirare fuori graffette prima di guarigione completa. Spazio di circa 0,5 punti mm.
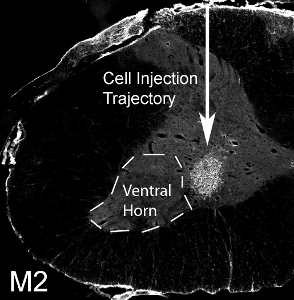
Figura 12. Trapianto di cellule progenitrici gliali in corno ventrale del collo dell'utero. 50.000 mouse derivate le cellule progenitrici gliali sono state trapiantate nel corno ventrale del C4 livello del midollo spinale in un topo G93A SOD1. M2 + mouse derivate le cellule trapiantate sono sopravvissuti a 1 mese dopo il trapianto. Le cellule localizzate alla materia grigia ventrale, ma il sito di iniezione medialmente perso il corno ventrale laterale (indicatadalla linea tratteggiata).
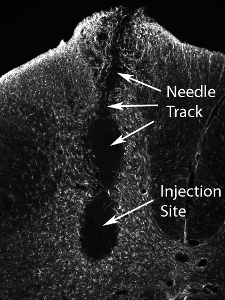
Figura 13. Trapianto di tessuto lesioni a seguito di un numero elevato di cellule precursore neuronali. Iniezione di un numero molto più elevato di cellule (il numero effettivo varia a seconda del tipo di cellula, e dovrebbe essere sistematicamente valutati) comporta danni al sito di iniezione e lungo il percorso dell'ago.
Discussione
Per gli studi che coinvolgono topi G93A SOD1 e ratti, età e sesso-match degli animali all'interno di un gruppo, e distribuire animali all'interno della stessa cucciolata a gruppi diversi. E 'preferibile utilizzare tutti gli animali del sesso stesso per entrambi i modelli di SLA e SIC, perché i processi di malattia possono differire tra maschi e femmine, tuttavia, può anche essere utile avere abbastanza animali da entrambi i sessi per individuare possibili sesso-specifici effetti, come questo fe...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Vorrei ringraziare: tutti i membri del Lepore, Maragakis Rothstein e laboratori di discussione utile; Il Veterans Paralizzato d'America e la Craig H. Neilsen Fondazione per il finanziamento.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
| HBSS | Gibco | 14170 | |
| 0,05% tripsina | Gibco | 25300 | |
| Inibitore della tripsina di soia (opzionale) | Sigma | T-6522 | |
| Acepromazina maleato (0,7 mg / kg) | Fermentazione Animal Health | ||
| Ketamina (95 mg / kg) | Fort Dodge Animal Health | ||
| Xylazina (10 mg / kg) | Bayer | ||
| # 11 Feather lama chirurgica | Electron Microscopy Sciences | 72044-11 | |
| Punte di cotone (6 pollici) | Pescatore | 23-400-101 | |
| Rat-pinza dentata | Strumenti Scienza multa | Ratto: 11023-15; Mouse: 11042-08 | |
| Medie imprese primavera forbici | Strumenti Scienza multa | 15012-12 | |
| Mini primavera forbici | Strumenti Scienza multa | 15000-10 | |
| Pinza ossivora | Strumenti Scienza multa | Ratto: 16121-14; Mouse: 16221-14 | |
| Microknife | Strumenti Scienza multa | 10056-12 | |
| Ago titolari | Strumenti Scienza multa | 12502-14 | |
| Sutura: 4-0 | Vicryl | S-183 | |
| Staples: 9 mm | Autoclip | 427631 | |
| Cucitrice: 9 mm (Reflex # 203-1000) | Mondo Strumenti di precisione | 5000344 | |
| Pompa acqua calda (T / pompa) | Gaymar | P / N 07999-000 | |
| Ciclosporina A: 250,0 mg/5.0 ml fiale | Novartis / Sandimmune | NDC 0078-0109-01 | |
| FK-506 | LC Laboratori | F-4900 | |
| Rapamicina | LC Laboratori | R-5000 | |
| Iniettore | Mondo Strumenti di precisione | UMP2 | |
| Micro 4 controller pompa Microsiringa | Mondo Strumenti di precisione | UMC4 | |
| Micromanipolatore | Mondo Strumenti di precisione | Kite-R | |
| 10,0 siringa Hamilton microlitri | Hamilton | 80030 | |
| Aghi Hamilton: 33-gauge, smusso a 45 °, 1 pollice | Hamilton | 7803-05 | |
| Pipette di vetro 20,0 microlitri microcapillare (opzionale) | Kimble | 71900-20 |
Riferimenti
- Lane, M. A., Fuller, D. D., White, T. E. Respiratory recovery following high cervical hemisection. Trends in neurosciences. 31, 538-538 (2008).
- Kaplan, L. M., Hollander, D. Respiratory dysfunction in amyotrophic lateral sclerosis. Clin. Chest. Med. 15, 675-675 (1994).
- Miller, R. G., Rosenberg, J. A., Gelinas, D. F. Practice parameter: the care of the patient with amyotrophic lateral sclerosis (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology: ALS Practice Parameters Task Force. Neurology. 52, 1311-1323 (1999).
- Mitsumoto, H., Chad, D. A., Pioro, E. P., Davis, F. A. . Amyotrophic lateral sclerosis. , (1998).
- Tandan, R., Bradley, W. G. Amyotrophic leteral sclerosis: Part 2. Etiopathogenesis. Annals of neurology. 18, 419-419 (1985).
- Bruijn, L. I., Miller, T. M., Cleveland, D. W. Unraveling the mechanisms involved in motor neuron degeneration in ALS. Annu Rev Neurosci. 27, 723-723 (2004).
- Rosen, D. R., Siddique, T., Patterson, D. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis. Nature. 362, 59-59 (1993).
- Bruijn, L. I., Becher, M. W., Lee, M. K. ALS-linked SOD1 mutant G85R mediates damage to astrocytes and promotes rapidly progressive disease with SOD1-containing inclusions. Neuron. 18, 327-327 (1997).
- Gurney, M. E., Pu, H., Chiu, A. Y. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science. 264, 1772-1775 (1994).
- Howland, D. S., Liu, J., She, Y. Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS). Proc Natl Acad Sci. 99, 1604-1604 (2002).
- Nagai, M., Aoki, M., Miyoshi, I. Rats expressing human cytosolic copper-zinc superoxide dismutase transgenes with amyotrophic lateral sclerosis: associated mutations develop motor neuron disease. J. Neurosci. 21, 9246-9246 (2001).
- McDonald, W., Becker, D. Spinal cord injury: promising interventions and realistic goals. Am. J. Phys. Med. Rehabi. I82, S38-S38 (2003).
- Sandrow-Feinberg, H. R., Zhukareva, V., Santi, L. PEGylated interferon-beta modulates the acute inflammatory response and recovery when combined with forced exercise following cervical spinal contusion injury. Experimental neurology. 223, 439-451 (2010).
- Gage, F. H. Mammalian neural stem cells. Science. 287, 1433-1433 (2000).
- Lane, M. A., Lee, K. Z., Fuller, D. D. Spinal circuitry and respiratory recovery following spinal cord injury. Respiratory physiology & neurobiology. 169, 123-123 (2009).
- Lepore, A. C., Rauck, B., Dejea, C. Focal transplantation-based astrocyte replacement is neuroprotective in a model of motor neuron disease. Nature. 11, 1294-1294 (2008).
- Rao, M. S. Multipotent and Restricted Precursors in the Central Nervous System. Anat Rec. 257, 137-137 (1999).
- Rao, M. S., Mayer-Proschel, M. Glial- restricted precursors are derived from multipotent neuroepithelial stem cells. Dev Biol. 188, 48-48 (1997).
- Suzuki, M., Tork, C., Shelley, B. Sexual dimorphism in disease onset and progression of a rat model of ALS. Sexual dimorphism in disease onset and progression of a rat model of ALS. Amyotroph Lateral Scler. 8, 20-20 (2007).
- Lepore, A. C., Haenggeli, C., Gasmi, M. Intraparenchymal spinal cord delivery of adeno-associated virus IGF-1 is protective in the SOD1G93A model of ALS. Brain research. 1185, 256-256 (2007).
- Veldink, J. H., Bar, P. R., Joosten, E. A. Sexual differences in onset of disease and response to exercise in a transgenic model of ALS. Neuromuscul Disord. 13, 737-737 (2003).
- Shumsky, J. S., Lepore, A. C. Transplantation of Neuronal and Glial Restricted Precursors into Contused Spinal Cord Improves Bladder and Motor Functions, Decreases Thermal Hypersensitivity, and Modifies Intraspinal Circuitry. J. Neurosci. 25, 9624-9624 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon