È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo per l'etichettatura vasi embrionali nei topi
In questo articolo
Riepilogo
Questo articolo descrive un metodo per l'etichettatura di pelle embrionale e vasi sanguigni timo.
Abstract
La creazione di una rete funzionale vaso sanguigno è una parte essenziale di organogenesi, ed è necessario per il funzionamento ottimale degli organi. Per esempio, nella formazione timo corretta vascolarizzazione ed il modello è indispensabile per l'ingresso timocita nell'organo e maturo delle cellule T uscita alla periferia. La disposizione spaziale dei vasi sanguigni nel timo dipende segnali provenienti dal microambiente locale, cioè le cellule epiteliali timiche (TEC). Diversi rapporti recenti suggeriscono che la perturbazione di questi risultati segnali in timo vaso sanguigno 1,2 difetti. Studi precedenti hanno descritto le tecniche utilizzate per etichettare il neonatale e adulto vascolarizzazione del timo 1,2. Si dimostra qui una tecnica per l'etichettatura dei vasi sanguigni nel timo embrionale. Questo metodo combina l'uso di FITC-destrano o Griffonia (Bandeiraea) Simplicifolia lectina I (GSL 1 - isolectin B 4) iniezioni vena facciale e CD31 colorazione anticorpi per identificare timo strutture vascolari e PDGFR-β per etichettare timo mesenchima perivascolare 3-5. La possibilità di utilizzare criosezioni o sezioni vibratome inoltre è fornita. Questo protocollo può essere utilizzato per identificare timo difetti vascolari, che è fondamentale per definire i ruoli di TEC-molecole derivate timo nella formazione dei vasi sanguigni. Come metodo di etichette intero sistema vascolare, può anche essere usato per analizzare le reti vascolari in molti organi e tessuti in tutto l'embrione tra pelle e cuore 6-10.
Protocollo
1. Fluorescina etichettata destrano e GSL I-isolectin B 4 iniezioni vena facciale per etichettare vasi embrionali
- Preparare FITC-destrano (50ug/mL) in soluzione tampone fosfato (PBS) o GSL 1 - isolectin B 4 (20ug/200uL) in PBS in un tubo Eppendorf 1,5 ml e caldo a 37 ° C. Aggiungi 100uL di magazzino 1,25 mm Fast Green / PBS al FITC-destrano soluzione (volume totale 1 ml) e 180uL di azioni da 1,25 mm Fast Green / PBS per la GSL 1 - isolectin B 4 (200uL volume totale), in modo che la soluzione è visibilmente blu.
- Sezionare E14.5 E18.5-embrioni e sacco vitellino insieme, lasciando il gambo allantoide (arteria e vena ombelicale) intatti.
- Trasferimento degli embrioni per un nuovo piatto Petrie (60 X 15 mm) e immergerli in PBS a temperatura ambiente.
- Posizionare l'embrione per fornire una visione sagittale della testa / viso. Usa micro dissettore ad afferrare delicatamente l'embrione alla testa.
- Utilizzando un ago 30G, iniettare 50uL FITC-destrano (50ug/mL) o GSL 1 - isolectin B 4 (in 20ug 200uL PBS) nella vena del viso che punta l'ago verso la parte posteriore della testa.
- Quando il colorante è visibile nella vena ombelicale, rimuovere l'ago e separare l'embrione dal gambo allantoide (arteria e vena ombelicale).
- A seguito di iniezioni, permette all'embrione di rimanere in PBS a temperatura ambiente per 2-3 minuti in modo che il colorante circola in tutto l'embrione.
2. Tutto-mount analisi di vascolarizzazione della pelle
- Dopo aver lasciato la tintura di circolare in tutta l'embrione, rimuovere campioni di pelle da regioni degli arti, alla schiena e allo stomaco, ecc 8,9.
- Lavare campione di pelle in PBS freddo, e fissare nel 4% PFA / PBS per 2 ore 8,9. Lavare 3 volte per 10 minuti ogni 4 ml in flaconcino trasparente con 2 ml PBS freddo.
- Pelle del campione posto su un vetrino da microscopio e aggiungere 100 ml di montaggio di mezzi di ogni diapositiva e un vetro di copertura.
- Lasciare i vetrini si asciughino in una zona di conservazione al buio.
- Procedere al passaggio sezione 'acquisizione di immagini' 2.
3. Multi-color etichettatura di timo e vascolarizzazione del cuore e le cellule perivascolari per criosezioni (Continua dalla sezione 1, punto 7)
- 'Flash congelare' embrione intero in azoto liquido. Gli embrioni possono essere e conservati a -80 ° C fino al momento dell'analisi.
- In alternativa, sezionare fuori timo, sciacquare in 4 ° C PBS, e fissare in 2 ml paraformaldeide 4% (PFA) / PBS per 2 ore. Lavare 3 volte per 10 minuti in PBS freddo, posto Thymi in ottobre, e congelare e conservare fino al momento dell'uso a -80 ° C.
- Per criosezionamento, diffusione ottobre su 'block' una sezione e montare l'embrione o di organi sezionati / tessuti per sezionamento.
- Tagliare tessuti congelati in 10 sezioni micron di spessore e raccogliere su vetrini.
- Fix sezioni in acetone per 5-10 minuti. Lavare 3 volte in TBS freddo.
- Blocco in asino siero del 10% / TBS in una camera umida a temperatura ambiente.
- Incubare sezioni per 1 ora, durante la notte con 100 ml di anticorpi primari in una camera umida a 4 ° C: in questo esempio, utilizziamo ratto anti-CD31 topo (1:100) all'endotelio etichetta, e di capra anti-topo PDGFR-β (1:100) per etichettare le cellule perivascolari. E 'utile per coprire le diapositive con le strisce Parafilm tagliati singolarmente per garantire che l'anticorpo è uniformemente diffuso in tutta la sezione.
- In seguito a incubazione con anticorpo primario, lavare le sezioni 3 volte in TBS freddo. Incubare con 100 ml di appropriati anticorpi secondari per 30 minuti minimo.
- Lavare 3 volte in TBS freddo. Aggiungere 100 ml di montaggio di mezzi di ogni diapositiva e un vetro di copertura.
- Lasciare i vetrini si asciughino in una zona di conservazione al buio.
- Passare alla sezione 'acquisizione di immagini'.
4. Multi-color etichettatura di timo vasi e cellule perivascolari per le sezioni vibratome (Continua dalla sezione 1, punto 7)
- Sezionare i lobi del timo dall'embrione e lavare in PBS freddo.
- Fissare timo nel 4% PFA / PBS a temperatura ambiente per 2 ore.
- Lavare in PBS-Triton X (0,15%) 3 volte, 10 minuti e Thymi posto in una cartuccia di plastica e immergere nel 4% bassa temperatura di fusione agarosio / PBS (~ 4 ° C). Il timo deve essere in contatto con il fondo della cartuccia.
- Lasciare solidificare agarosio su ghiaccio (3-5 minuti). Utilizzare una lama di rasoio per tagliare l'eccesso di agarosio. Aggiungere la colla al blocco vibratome e aderire al blocco del campione.
- Aggiungi PBS freddo vibratome a bagnomaria fino a quando il campione e la lama sono immersi.
- Impostare la velocità e l'ampiezza (ampiezza alta e bassa-moderata velocità è ideale per le sezioni morbide timo). L'ampiezza dovrebbe essere ridotto se le sezioni rompere a causa di agitazione in eccesso.
- Taglio del 50 sezioni um.
- Utilizzando un pennello, raccogliere le sezioni di un 24-bene micropiastre in PBS freddo.
- Sezioni di blocco in 500 ml di siero di asino al 10% in PBS-Triton X (0,15%) per 30 minuti.
- Sezioni incubare per 8 ore a notte con l'anticorpo primario, come anti-CD31 e anti-PDGFR-β, In una coperta di 24 e micropiastre.
- Lavare 3 volte in PBS-Triton X (0,15%) su un totale di 8 ore a 4 ° C.
- Sezioni di blocco nel siero asino 10% in PBS-Triton X (0,15%) per 30 minuti.
- Incubare sezioni per 8 ore per notte a 4 ° C con anticorpi secondaria appropriata.
- Lavare 3 volte in PBS-Triton X (0,15%) su un totale di 8 ore a 4 ° C.
- Ri-fix campioni nel 4% PFA / PBS per 30 minuti in ghiaccio.
- Lavare 3 volte in PBS-Triton X (0,15%) più di 30 minuti sul ghiaccio.
- Disidratare campioni attraverso un graduale MeOH / PBS-Triton X serie: 25% MeOH, 50% MeOH, 75% MeOH, e 100% MeOH a 10 minuti per ogni passaggio. Sostituire il 100% MeOH con MeOH fresca dopo 10 minuti e incubare per 1 ora a temperatura ambiente.
- In un contenitore di vetro, mescola BABB (Benzyl Alcohol: Benzyl Benzoate) in un rapporto 1:2. Combina BABB con MeOH per una concentrazione finale del 50% e 50% BABB MeOH. Incubare il campione in BABB: MeOH per 10-15 minuti.
- Trasferimento del campione a un contenitore di vetro con% BABB 100 e incubare per 10-15 minuti o finché non viene chiusa, a temperatura ambiente.
- Compila scivolo depressione (0,7 millimetri di profondità) con fresca BABB 100% e di trasferimento del campione a lato. Aggiungi coperchio in vetro (n. 1.5) e sigillare con 2-3 mani di smalto. Lasciare smalto per indurire al buio a temperatura ambiente, quindi memorizzare campione a 4 ° C.
Nota: Le diapositive devono essere completamente sigillati prima di acquisizione di immagini confocale. Le immagini devono essere acquisite entro 12-24 ore, come i coloranti fluorescenti possono sbiadire a Babb. - Passare alla sezione 'acquisizione di immagini'.
5. Acquisizione di immagini
- Immagine 10 micron sezioni congelate con un microscopio confocale utilizzando il Plan-Apochromat 20X/0.8 obiettivo (512 x 512 pixel) con 488 - (FITC-dextran/GSL 1 - isolectin B 4), 543 - e 633-nm linee laser.
- Acquisire confocale z-sezioni di pelle monte intero e 50 micron agarosio-embedded sezioni utilizzando il Plan-Apochromat 10X/0.4 obiettivo (512 x 512 pixel) con 488 - (FITC-dextran/GSL 1 - isolectin B 4), 543 -, e 633-nm linee laser. Serie Z-sezioni devono essere raccolti in sequenza al numero 1-micron per ogni rispettivo canale.
- Ricostruire serie Z-sezioni utilizzando Zeiss AxioVision 4.6 o altri software di analisi dell'immagine.
6. Rappresentante dei risultati:
Efficace di etichettatura dei vasi embrionali è fondamentale per valutare i difetti dei vasi sanguigni nei topi embrionale. La figura 1 mostra l'etichettatura specifica E16.5 vasi sanguigni del timo (1A-B) e co-marcatura con CD31 (1B), oltre alla colorazione dei ventricoli destro e sinistro (1E-F), rispettivamente. Il GSL I-isolectin B 4 protocollo per criosezioni come descritto nelle sezioni 1, 3 e 5 è stato usato in questi esperimenti. Tutto-mount etichettatura della rete dei vasi sanguigni della pelle su E16.5 topi, utilizzando i protocolli descritti nelle sezioni 1, 2 e 5 è mostrato nella figura 1C-D.
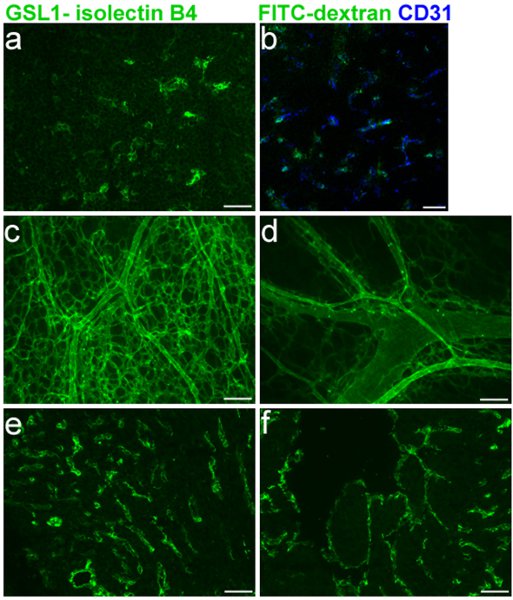
Figura 1 Legend. FITC GSL I - isolectin B 4 iniezioni in vena facciale E16.5 embrioni di topo. Cryosection a. timo embrionale dopo l'iniezione. b. Fusione di CD31 co-etichettatura con isolectin B 4. c. e d. Whole-mount dell'iniezione embrionale vascolarizzazione della pelle successivo. e. ed f. Cryosection embrionale di cuore e. (a destra ventricolo) f. (ventricolo sinistro) dopo l'iniezione.
Discussione
Whole-mount e PECAM-1 (CD31) colorazione sulle sezioni sono i metodi convenzionali per l'etichettatura del sistema vascolare nei topi embrionale. Questi metodi richiedono l'uso di immunofluorescenza diretta e / o indiretta, e detergenti per permeabilize tessuto del mouse. Questo risulta essere un processo piuttosto tempestivo. Qui, abbiamo impiegato FITC-destrano o isolectin B 4 iniezioni vena facciale per etichettare direttamente la vascolarizzazione embrionali, eliminando così la necessità di fasi...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato supportato dai numeri concedere R01AI055001 e R01AI082127 dal NIAID di NRM e Premio tesi SREB Fellowship di JLB.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
|---|---|---|---|
| FITC-destrano | Sigma | FD150S-1G | |
| Fluorescina etichettata GSL 1 - isolectin B 4 | Laboratori Vector | FL-1201 | |
| Fast Green | MP Biomedicals | 195178 | |
| PFA | Fluka | 76240 | |
| Siero bovino fetale | Atlanta Biologicals | S11550 | |
| Temperatura ottimale composto da taglio (OCT | VWR | 25608-930 | |
| Acetone | JT Baker | 9006-33 | |
| Donkey Siero | Jackson | 017-000-121 | |
| topo anti-topo CD31, | BD Pharmingen | 558736 | |
| capra anti-topo PDGFR-β | R & D Systems | AF1042 | |
| asino anti-ratto CD31 Alexa 647 (Invitrogen) | Biolegend | 102516 | |
| asino anti-capra Alexa 594 (Invitrogen) | Invitrogen | A11058 | |
| Triton X -100 | Sigma-Aldrich | X-100 | |
| Bassa temperatura di fusione agarosio / PBS | Sigma-Aldrich | A9414-25G | |
| Metanolo | Fisher Scientific | A413-4 | |
| L'alcol benzilico | Acros scientifico | 148390010 | |
| Benzyl Benzoate | Acros scientifico | 105860010 | |
| Depressione diapositive | Fisher Scientific | S175201 | |
| Fluorogel | Electron Microscopy Sciences | 17985-10 | |
| Copertura di vetro (22x22) -1,5 | Thermo Scientific | 152222 | |
| Zeiss LSM 510 Meta microscopio confocale | Zeiss | ||
| Micro dissettore | Roboz | RS-5135 | |
| Parafilm No. OM992 | Fisher Scientific | 13-374-16 | |
| 12 e 24 micropiastre bene | Evergreen scientifico | 222-8044-01F | |
| SuperFrost / Plus Microscopio Slides | Fisher Scientific | 12-550-15 | |
| 4 ml fiale chiaro | Scientifico Nazionale | B7800-2 |
Riferimenti
- Cuddihy, A. R. VEGF-mediated cross-talk within the neonatal murine thymus. Blood. 113, 2723-2731 (2009).
- Muller, S. M. Gene targeting of VEGF-A in thymus epithelium disrupts thymus blood vessel architecture. Proc. Natl. Acad. Sci. U. S. A. 102, 10587-10592 (2005).
- Muller, S. M. Neural crest origin of perivascular mesenchyme in the adult thymus. J. Immunol. 180, 5344-5351 (2008).
- Foster, K. Contribution of neural crest-derived cells in the embryonic and adult thymus. J. Immunol. 180, 3183-3189 (2008).
- Liu, C. Coordination between CCR7- and CCR9-mediated chemokine signals in prevascular fetal thymus colonization. Blood. 108, 2531-2539 (2006).
- Lavine, K. J. Fibroblast growth factor signals regulate a wave of Hedgehog activation that is essential for coronary vascular development. Genes Dev. 20, 1651-1666 (2006).
- Lavine, K. J., Kovacs, A., Ornitz, D. M. Hedgehog signaling is critical for maintenance of the adult coronary vasculature in mice. J. Clin Invest. 118, 2404-2414 (2008).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Murphy, P. A. Endothelial Notch4 signaling induces hallmarks of brain arteriovenous malformations in mice. Proc. Natl. Acad. Sci. U. S. A. 105, 10901-10906 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon