È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Analisi della migrazione cresta neurale cellulare Trunk con un Modified Zigmond Assay Camera
In questo articolo
Riepilogo
Un approccio per analizzare la migrazione delle cellule espiantate (cellule della cresta neurale tronco) è descritto. Questo metodo è poco costoso, delicato, e in grado di distinguere la chemiotassi sia da chemochinesi e altre influenze sulla polarità dei migratori come quelli derivati da interazioni cellula-cellula all'interno della principale coltura cresta neurale delle cellule del tronco.
Abstract
Cellule della cresta neurale (CNC) sono una popolazione transitoria di cellule presenti nello sviluppo dei vertebrati che emigrano dal tubo neurale dorsale (NT), dopo aver subito un epitelio-mesenchimale 1,2 transizione. A seguito di EMT, CNC migrare grandi distanze lungo percorsi stereotipati fino a raggiungere i loro obiettivi. CNC differenziarsi in una vasta gamma di tipi di cellule tra cui i neuroni, glia, melanociti e cellule cromaffini 1-3. La capacità di CNC di raggiungere e riconoscere i loro percorsi di destinazione corretta è fondamentale per la formazione adeguata di tutte le strutture contenenti tronco NCC-derivato componenti 3. Chiarire i meccanismi di orientamento per la linea esterna NCC la migrazione è stata quindi una questione di grande importanza. Numerose molecole hanno dimostrato di guidare la migrazione NCC 4. Per esempio, CNC tronco sono noti per essere respinti da stimoli negativi come orientamento semaforina, efrina, e leganti a fessura 5-8. Tuttavia, nonfino a poco tempo eventuali fattori chemiotattici di CNC tronco stati identificati 9.
Convenzionale negli approcci in vitro per lo studio del comportamento chemiotattico di cellule aderenti funzionare al meglio con le cellule immortalizzate, omogeneamente distribuiti, ma sono più difficili da applicare alle colture primarie di cellule staminali determinate che inizialmente non hanno una distribuzione omogenea e differenziano rapidamente (ad esempio CNC). Un approccio per omogeneizzare la distribuzione di CNC tronco per gli studi di chemiotassi è quello di isolare CNC tronco da colture primarie di espianti NT, quindi sollevare e replate loro di essere quasi al 100% confluenti. Tuttavia, questo approccio placcatura richiede notevoli quantità di tempo e fatica per espiantare numero sufficiente di cellule, è dura, e distribuisce CNC tronco in modo dissimile da quella che si trova nelle condizioni in vivo.
Qui, segnaliamo un approccio in vitro che è in grado di valutare le risposte migratori chemiotassi e altre NCCs tronco senza requiringa distribuzione omogenea delle cellule. Questa tecnica utilizza time-lapse imaging di primario, imperturbabile CNC tronco all'interno di una Zigmond modificato camera (una camera standard di Zigmond sono descritti in un 10). Esponendo NCCs tronco alla periferia della coltura di un gradiente chemotactant che è perpendicolare alla loro direzionalità predetto naturale, alterazioni polarità migratori indotti dal gradiente chemotactant applicata può essere rilevato. Questa tecnica è poco costoso, richiede la coltura di due soli espianti NT per trattamento replica, evita sollevamento dura cellule (come tripsinizzazione), lascia NCCs tronco in una distribuzione più simile a condizioni in vivo, riduce la quantità di tempo tra espianto e sperimentazione (probabile che riduce il rischio di differenziazione), e permette time-lapse valutazione di numerose caratteristiche migratori.
Protocollo
1. Giorno 1: Isolamento di tubi tronco neurali per la cultura durante la notte su vetrini
- Incubare le uova pulcino per 56 ore a 38 ° C. Togliere le uova da incubazione, leggermente spruzzateli con etanolo al 70%, e poi lasciarle asciugare. Rompete le uova si schiudono in un vassoio di vetro UV-sterilizzati.
- Estrarre ogni embrione dal suo uovo e metterlo nella pulcino Ringer. A tale scopo, primo taglio circa le sue isole di sangue con le forbici curve, poi, con una pinza smussato, prendere l'embrione dal suo membrana extraembrionale e metterla in un piatto di plastica sterile Petri contenente la soluzione di Ringer pulcino.
- Isolare il tronco di ogni embrione, tagliando fuori in eccesso membrane extraembrionali così come i livelli assiali cranici, vagale, e sacrale utilizzando un ago di tungsteno (Fig. 1). In primo luogo, selezionare circa 9 embrioni che sono tra le fasi HH15-17 11. Per le fasi HH15 e fino, gli assi del prosencefalo e rombencefalo formano un angolo acuto e quindi la testa sembra inclinare caudalmente. Afase HH17, il germoglio della coda è presente e si inclina sul ventre, ma non contiene ancora somiti. Con un ago di tungsteno, tagliare le membrane extraembrionali a circa 2 mm dal embrione e tagliare le tessuti embrionali anteriori al somite 10. Rimuovere anche tutti i tessuti embrionali caudale a partire da tutto il quinto somite di recente formazione.
- Posizionare i tronchi isolati embrionali dispasi (0,24 U / ml DMEM) e incubare per 1 h 15 min a 37 ° C e 5% di CO 2. Una volta che i tronchi iniziano incubazione, cominciare a preparare 6 coprioggetti (CS) per la coltura di espianti NT (passi 1,5-1,8).
- Sciacquare 6 CS in etanolo al 70% (diluito in acqua sterile, ultrapura), e poi lasciarle asciugare. Con un pennarello laboratorio, disegnare un cerchio al centro di ogni CS che è di circa 1 cm di diametro (questo cerchio in seguito aiuterà a identificare dove una mano fibronectina è stato applicato). Sulla stessa faccia di ogni CS, scrivere la parola "essere" (o qualche altra parola o la forma asimmetrica) al di fuori del cerchio disegnato (questo aiuterà you identificare se il lato marcato del CS è rivolto verso l'alto o verso il basso).
- Posizionare ogni CS in una separata 40 x 10 mm piatto sterile con la superficie rivolta verso il basso e marcata permettono il piatto di sedersi aperta sotto una lampada UV germicida per 10 min.
- Applicare 60 microlitri fibronectina (FN, 10 pg / ml DMEM) alla superficie libera del CS assicurandosi l'intera area all'interno del cerchio 1 cm è rivestita. Porre le capsule ad incubare a 37 ° C per 30 min e poi aspirare accuratamente la fibronectina da ciascun CS.
- Aggiungere 250 microlitri medium "cultura" [DMEM con L-glutammina (2 mM), penicillina (100U/ml), streptomicina (100 mcg / ml), e l'8% di siero fetale bovino (FBS)] per la FN rivestita area il CS. Porre le capsule contenenti ciascuna CS a 37 ° C e 5% di CO 2 di nuovo fino a quando i NT sono stati isolati.
- Trasferire tutti i tronchi embrioni incubate per un 5 cm vetro piatto di Petri contenente L15 medio e iniziare a sezionare fuori ogni NT utilizzando una pinza sottile e un ago di tungsteno (Fig. 1). Carefully tagliare lungo il bordo del NT e somiti con un ago di tungsteno forte pur essendo attento a non danneggiare il NT. Spesso è più facile cominciare isolando ogni NT dal caudale più a fine del tronco.
- Selezionare 6 delle NT diritte e più lunga alla cultura durante la notte (NT tra circa 8 e 15 somiti lungo sono raccomandati). Utilizzando una punta micropipetta innescato con mezzo di coltura, trasferire ciascuno dei 6 NTs al proprio CS precedentemente preparato (passi da 1.5 a 1.8). Assicurarsi che il NT non rimane galleggiante in superficie. Se il NT è mobile, sgocciolare media su di esso fino a quando non affonda con una micropipetta.
- Posizionare ogni piatto a 37 ° C e 5% di CO 2 durante la notte. Fare attenzione a garantire che ogni NT è all'interno del FN rivestita zona di sua rispettiva CS immediatamente prima di mettere il piatto in incubatrice (utilizzando il cerchio disegnato al punto 1.5 come un punto di riferimento). Una micropipetta può essere utilizzata per regolare meglio la posizione di ciascun NT se necessario.
- Posto aalmeno 2 ml di terreno di coltura (senza siero) in una provetta sterile 15 ml centrifuga e incubare una notte a 37 ° C e 5% di CO 2. Lasciare il coperchio leggermente svitato per consentire il pH del mezzo per regolare la notte. Pre-incubazione il mezzo è importante per aiutare a prevenire la formazione di bolle nella vostra camera, che potrebbe perturbare la creazione di un gradiente molecolare. Tale medium "preincubato" dovrebbe essere usato in tutte le fasi future. Quando non viene utilizzato, questo mezzo deve essere incubando a 37 ° C.
2. Giorno 2: Caricare la camera di modifica Zigmond e time-lapse analisi della migrazione cellulare
- Dei 6 NTs coltivate, selezionare i tre culture più adatti per l'analisi. Generalmente, culture NCC che hanno almeno un lungo, regolo dovrebbe essere selezionata (Fig. 2A). I 3 migliori colture saranno utilizzati per caricare e film 3 modificata camere Zigmond tutto il giorno, ciascuno con un diverso trattamento. Dei tre culture, scegliere uno per loading la prima camera e consegna gli altri per l'incubatrice per un uso successivo.
- Con un batuffolo di cotone, applicare un sottile e uniforme strato di vaselina che circonda i serbatoi e il ponte di una modifica Zigmond camera.
- Con un ago di tungsteno, rimuovere delicatamente il NT dal CS, lasciando dei CNC circostanti attaccati alla superficie del CS. Contrassegnare il piatto con una penna per ricordare l'orientamento del bordo rettilineo della cultura NCC.
- Mettere qualche goccia di media preincubato sul ponte. Prendete il CS con una pinza sottile, tamponare il bordo del CS contro un Kimwipe per rimuovere la maggior parte del terreno di coltura antica, poi subito posizionare l'apparecchio CS sul Zigmond modificato camera in modo che il lato liscio della cultura da riprendere è centrato sul la lunghezza del ponte e all'incirca perpendicolare al ponte di confine serbatoio (Fig. 2A, B).
- Utilizzando un microscopio invertito, spostare il bordo rettilineo NCC essere sul lato del ponte più vicino a thserbatoio e che conterrà la chemotactant sospetto (Fig. 2B, per i controlli di questo corrisponderà a qualsiasi serbatoio è caricato secondo). Inoltre, più finemente allineare il bordo rettilineo della cultura per essere perpendicolare al ponte-serbatoio confine.
- Con cautela, ma premere saldamente il CS nella vaselina presente sulla camera Zigmond, assicurandosi che sia completamente sigillato al camera, quindi posizionare ulteriori vaselina lungo il bordo del CS per garantire ulteriormente sarà tenuta d'aria. Regolare con precisione l'angolo del bordo NCC nuovamente per correggere qualsiasi movimento durante il processo di saldatura.
- Caricare il serbatoio che non conterrà il sospetto chemotactant prima (Fig. 2B). Fatelo caricando una siringa da 1 ml (25 G x 1,5 poll ago allegata) con circa 300 microlitri media preincubato e iniettare il mezzo nel serbatoio fino al completo (facendo attenzione a non generare eventuali bolle nel serbatoio). Inserire il serbatoio su entrambi i lati con un sufficient quantità di vaselina prima di caricare il serbatoio successivo.
- Ripetere il punto 2.7, ma questa volta con mezzo preincubato contenente il chemotactant candidato. È critico quando si genera un gradiente molecolare attraverso la cultura per caricare sempre il serbatoio contenente la molecola da testare dopo il caricamento del serbatoio privo della molecola testata.
- Posizionare la cartuccia in canna Zigmond a 37 ° C per incubare per 1 h prima delle riprese. Immagine del bordo rettilineo della cultura NCC per 3 ore a 90 s durante intervalli di incubazione a circa 37 ° C (Fig. 2A, B). Prima di creare qualsiasi film, assicurarsi di allineare la telecamera in modo che il bordo delle immagini da ottenere sono allineati e toccando il bordo del ponte che delimita l'ultimo serbatoio caricato (Fig. 2B, pannello superiore; casella tratteggiata rappresenta ideale posizione per l'imaging). Ciò faciliterà la successiva analisi software uniformando la direzionalità del gradiente molecolare applicata e thdistanza e dal serbatoio girato in ogni film prodotto.
- Per i controlli, ripetere i passaggi 2,2-2,9 per ciascuna delle due culture altre NCC selezionati (al punto 2.1), ma riempire ogni serbatoio con un mezzo adeguato. Per un tipo di controllo riempimento entrambi i serbatoi con terreno preincubato non contenente la molecola da testare. Per un trattamento secondo controllo, il ponte principale con alcune gocce di mezzo preincubato contenente il chemotactant sospetto prima di montare il CS. Quindi, caricare entrambi i serbatoi con lo stesso medium contenente il chemotactant sospetto.
- Utilizzare ImageJ (NIH) Allineamento manuale (rsb.info.nih.gov / IJ / plugins / traccia / track.html) e chemiotassi Strumento di migrazione e v1.01 (www.ibidi.de / applications / ap_chemo.html) plugin per tenere traccia la migrazione delle NCC periferici lungo il bordo rettilineo della cultura just immaginati e per analizzare i vari parametri delle traiettorie migratorie ottenuti (Fig. 2B-C).
3. Rappresentante dei risultati:
Un campione di traiettorie cellulari da un film in cui CNC tronco molti erano in risposta ad un fattore chemiotattico candidato con la tecnica di cui sopra è mostrato (Fig. 2D). La maggior parte delle cellule in questo esempio di risposta positiva visualizzato un movimento netto il gradiente chemiotattico (come mostrato in rosso). Dati di traiettoria può essere utilizzato per analizzare altre proprietà di migrazione cellulare pure.
Per valutare visivamente un gradiente applicato in una camera di Zigmond modificato, una Alexa Fluor 488 IgM coniugato (MW ~ 900 kDa) è stata caricata in un secondo serbatoio di Zigmond modificato camera (a circa 40 pg / ml di H 2 O). Un gradiente è stato istituito con 1 ora e ancora in qualche modo presente dopo 26 ore, ma molto diminuita da 50 h (Fig. 3). Se la molecola da testare è più piccolo, allora il gradiente applicato will degradano più velocemente di ciò che viene mostrato.

Figura 1. Espianto del tronco a livello di NT per la coltura durante la notte su fibronectina rivestite coprioggetto. Perché tronco delaminate NCC dalla dorsale NT adiacente al somiti 8-28, questo segmento del NT è isolato mediante microdissezione e colta durante la notte su un fibronectina rivestito CS per consentire l'emigrazione di NCC dal espianto NT. NT isolati che sono tra 8-15 somiti lunga e relativamente semplice sono più adatti per la coltura durante la notte in quanto tendono a produrre colture NCC con più frontiere diritte. Regioni del tubo neurale che danno luogo a livelli cresta neurale altri assiali sono mostrati in un carattere più piccolo. s, somite.

Figura 2. Metodo per valutare la migrazione di NCCs tronco espiantatiutilizzando una camera modificato Zigmond. (A) di forma allungata tronco culture NCC sono preparati da coltura durante la notte di NT e conseguenti culture NCC con almeno un lungo, bordo dritto vengono selezionati per la sperimentazione. Il più lungo bordo rettilineo di una cultura selezionata viene quindi posizionato perpendicolare al ponte-serbatoio di confine, e quindi parallelo al vettore del gradiente applicato futuro. (B) dopo aver regolato la posizione della cultura NCC sulla camera Zigmond e sigillatura il coprioggetto alla camera, la camera viene caricato. Durante il test di chemiotassi, il serbatoio che non conterrà il chemotactant sospetto (-) viene caricato prima e sigillata. Poi, l'altro serbatoio viene caricato con il chemotactant sospetta (+) e sigillato. CNC periferiche lungo la frontiera precedentemente selezionata può essere ripreso e tracciati utilizzando il plugin per ImageJ Allineamento manuale (pannello inferiore). (C) le caratteristiche di numerosi migratori, in rispostala sfumatura applicata può essere valutata sulla base dei dati di monitoraggio. Per esempio, un indice di chemiotassi può essere ottenuta dividendo lo spostamento di una cella lungo l'asse x della distanza totale è migrato. (D) Un esempio di una risposta attraente è indicato da una trama traiettoria cella inizialmente generato dalla chemiotassi e migrazione plugin di Strumento per ImageJ. Il punto di partenza di ogni traiettoria è impostata l'origine (0,0). Si noti come molte altre cellule migrano verso il centro source.The chemiotattico di massa di tutte le cellule alla loro posizione finale (blu croce, tutte le cellule equiponderati) è anche più vicino alla fonte chemiotattico. CNC, le cellule della cresta neurale, piste rosse, le cellule che la migrazione verso il serbatoio caricato con una sospetta chemoattractant; piste nere, le cellule che la migrazione di distanza: (+), concentrazione chemotactant superiore; (-), concentrazione chemotactant inferiore.

Figura 3. profili di intensità attraverso il ponte di una camera modificato Zigmond in tempi diversi dopo l'aggiunta di un Alexa Fluor 488 coniugato IgM. La camera è stata caricata in un modo simile a quello descritto nel protocollo con le eccezioni principali che l'acqua preincubato (invece di medie preincubato) è stato usato per diluire l'anticorpo a 40 mcg / ml, e sacche d'aria piccole erano presenti alle estremità del ponte (dalla slice dove i profili di intensità sopra dove prese). Inizialmente, nessun gradiente era presente nella maggior parte del ponte. Da 1 gradiente ettari è stato fondato ed è rimasto presente fino al 26 h. 50 h dalla presenza del gradiente era incoerente in diverse aree del ponte, e quando presente, la pendenza del gradiente era notevolmente diminuita. Tutti i profili sono stati generati da una fetta identico attraverso il ponte (da un ponte-serbatoio confine all'altro) con AxioVision 4,6 software. Si noti che anche mentre l'ariatasche erano presenti, il gradiente non è stato interrotto. Alta, alta intensità, bassa, bassa intensità, asse x, distanza attraverso intera larghezza del ponte (2 mm), (+), caricata con il serbatoio Alexa Fluor 488 IgM coniugato, (-), serbatoio non caricato con il coniugato.
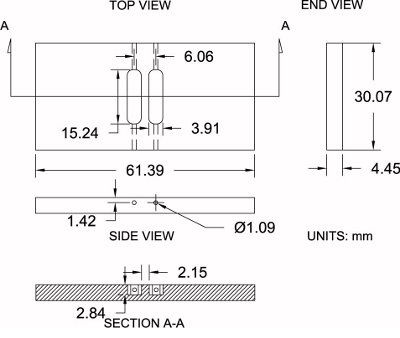
Figura 4. Modificati specifiche della camera. Zigmond mostrato è un diagramma della Zigmond modificato camera usata qui insieme con le sue specifiche dimensionali (± 0,2 mm). Le misure possono essere moderatamente regolato in modo da soddisfare le preferenze individuali.
Protocollo supplementare: Realizzazione di un Zigmond Modified Camera
Fare riferimento alla Figura 4 come riferimento per il protocollo di seguito:
- Acquistare un foglio di 3/16 "di spessore acrilico lucido (4,45 mm di spessore effettivo).
- Utilizzando una sega, tagliare gli spazi della camera di grandi dimensioni per ladimensioni approssimative di 33,25 millimetri x 64,57 millimetri. Questo permette 3,175 mm materiale supplementare per la lavorazione.
- Impostare il bianco camera su una morsa. Con una fresatrice e un 6,35 mm (1/4 ") mulino bit fine, lavorazioni di finitura delle pareti della camera di loro esatte dimensioni: 30.07 mm x 61,39 millimetri.
- Posizionare la camera di vuoto della macchina di fresatura e individuare il centro del bianco lungo gli assi xey con un tastatore di spigoli, poi azzerare la posizione centrale.
- Acquisire l'altezza della camera (asse z) toccando il bit fresa alla superficie superiore e azzerare l'altezza.
- Utilizzando un 3,91 millimetri (0,154 ") mulino bit fine, il bit di offset 3,03 millimetri lungo l'asse x (direzione positiva) per il primo serbatoio. Iniziare la lavorazione nella camera ad una profondità di 2,84 mm mentre si muove lungo l'asse y (direzione positiva) a 7,62 mm (0,300 ") e poi attraversare a 7,62 mm (0,300") in senso opposto (negativo) in direzione di un serbatoio completo lunghezza di 15,24 mm (0,600 "). Offsetil bit di 3,03 millimetri (0,119 ") lungo l'asse x (direzione negativa) e ripetere la stessa procedura per il secondo serbatoio.
- Posizionare la camera sul suo bordo e praticare un foro con un 1,09 millimetri (0,043 pollici) punta sull'estremità di ciascun serbatoio (4 totale) che collega l'estremità del serbatoio al lato della camera per il carico medio durante la sperimentazione.
- Mettere a bagno la camera bene in acqua tiepida e sapone per rimuovere eventuali contaminanti chimici.
- Immergere e sciacquare la camera ben in acqua bidistillata per rimuovere qualsiasi sapone. Le camere sono ora pronti per l'uso come descritto sopra.
Discussione
Condurre ricerche sulla chemiotassi CNC tronco si è dimostrato difficile per una serie di ragioni. CNC Trunk costituiscono una eterogenea popolazione di cellule staminali che si differenziano, se coltivate a lungo termine, pertanto, CNC tronco devono essere ottenuti da espianto primario del tronco a livello di NT. I metodi convenzionali per studiare la risposta chemiotattica di popolazioni cellulari distribuiti omogeneamente in vitro sono difficili da testare su NCCs tronco dal loro primo richiedono che le cel...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Rendiamo grazie speciale a Lino Kim, Steve Guzman e Ujit Satyarthi per l'assistenza tecnica durante lo sviluppo di questo metodo. Myron Hawthorne, Richard Spengel, e Roberto Rojas lavorati le camere utilizzate qui e ha fornito la necessaria assistenza tecnica. In particolare, Roberto Rojas prodotto Figura 4. Siamo anche grati per preziosi consigli prima dello sviluppo del test chemiotassi sopra Scott Fraser. Questo lavoro è stato in parte sostenuto da un NIH-MBSR SCORE-5S06GM048680-13 a Medb e da un premio dalla, Programma CSU Northridge Supporto Tesi di Laurea su CW.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
| DMEM | Omega scientifico | DM-22 | |
| Penicillina Streptomicina Soluzione | Omega scientifico | PS-20 | Archivio concentrazione 100X |
| L-Glutammina | Omega scientifico | GS-60 | Archivio concentrazione 100X |
| Siero fetale bovino | Omega scientifico | FB-11 | Lot # 105247 (o un altro che è comparabile) |
| Modificata Zigmond camera | Fatto in casa | N / A | Capacità serbatoio: ~ 160 microlitri bis, per le altre specifiche, vedi fig. 4 e il protocollo di fabbricazione supplementare |
| Colture cellulari piatto | Denville | T6040 | 40 x 10 mm |
| Fibronectina | BD | 354008 | Stock 10x prepped diluendo 1 mg FN in 1 ml H 2 O e 9 ml DMEM |
| Coprioggetto | Pescatore | 12-548-B | Prefiltrata, 22 x 22 mm |
| L15 media | Thermo Scientific | SH30525.02 | |
| Vaselina | Comforts | 011110794642 | 100% |
| Centrifuga tubo | Biologix | 10-9152 | 15 ml |
| Dispasi | Sistemi cellulari | 4Z0-850 | Archivio concentrazione 10X |
| Siringa | BD | 309602 | 1 ml |
| Ago | BD | 305127 | 25 G x 1,5 pollici |
| Alexa Fluor 488-IgM | Ionvitrogen | A21042 | Foto è di 2 mg / ml; 7 moli colorante / mole IgM |
| Pinze per dissezione | FST | Varie. | Dumont # 5 o 55; dritto a punta, in acciaio inox o in titanio |
| Tungsten Needle | N / A | N / A | Fatta in casa, posto in un supporto del perno |
| Blunt Pinze | Tiemann | 160-18 | Usato per il trasferimento di embrioni di Ringer da tuorlo d'uovo |
Protocollo supplementare: Realizzazione di un Zigmond Modified Camera
Fare riferimento alla Figura 4 come riferimento per il protocollo di seguito:
- Acquistare un foglio di 3/16 "di spessore acrilico lucido (4,45 mm di spessore effettivo).
- Utilizzando una sega, tagliare gli spazi della camera di grandi dimensioni per le dimensioni approssimative di 33,25 millimetri x 64,57 millimetri. Questo permette 3,175 mm materiale supplementare per la lavorazione.
- Impostare la camera vuota su un VISE. Con una fresatrice e un 6,35 mm (1/4 ") mulino bit fine, lavorazioni di finitura delle pareti della camera di loro esatte dimensioni: 30.07 mm x 61,39 millimetri.
- Posizionare la camera di vuoto della macchina di fresatura e individuare il centro del bianco lungo gli assi xey con un tastatore di spigoli, poi azzerare la posizione centrale.
- Acquisire l'altezza della camera (asse z) toccando il bit fresa alla superficie superiore e azzerare l'altezza.
- Utilizzando un 3,91 millimetri (0,154 ") mulino bit fine, il bit di offset 3,03 millimetri lungo l'asse x (direzione positiva) per il primo serbatoio. Iniziare lavorazione nella camera ad una profondità di 2,84 mm mentre si muove lungo l'asse y ( direzione positiva) a 7,62 mm (0,300 ") e poi attraversare a 7,62 mm (0,300") in senso opposto (negativo) fino ad un serbatoio di lunghezza completa di 15,24 mm (0,600 "). Il bit di offset di 3,03 millimetri (0,119 ") lungo l'asse x (direzione negativa) e ripetere la stessa procedura per il secondo serbatoio.
- Posizionare la camera sul suo bordoe praticare un foro con un 1,09 millimetri (0,043 pollici) punta sull'estremità di ciascun serbatoio (4 totale) che collega l'estremità del serbatoio al lato della camera per il carico medio durante la sperimentazione.
- Mettere a bagno la camera bene in acqua tiepida e sapone per rimuovere eventuali contaminanti chimici.
- Immergere e sciacquare la camera ben in acqua bidistillata per rimuovere qualsiasi sapone. Le camere sono ora pronti per l'uso come descritto sopra.
Riferimenti
- Le Douarin, N. M. The avian embryo as a model to study the development of the neural crest: a long and still ongoing story. Mechanisms of Development. 121, 1089-1102 (2004).
- Baker, C. V. . Neural Crest and Cranial Ectodermal Placodes. , (2005).
- Gammill, L. S., Roffers-Agarwal, J. Division of labor during trunk neural crest development. Dev. Biol. 344, 555-565 (2010).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Dev. Biol. 344, 566-568 (2010).
- Wang, H. U., Anderson, D. J. Eph family transmembrane ligands can mediate repulsive guidance of trunk neural crest migration and motor axon outgrowth. Neuron. 18, 383-396 (1997).
- Krull, C. E. Interactions of Eph-related receptors and ligands confer rostrocaudal pattern to trunk neural crest migration. Curr. Biol. 7, 571-580 (1997).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development, Cambridge, England. , 133-199 (2006).
- De Bellard, M. E., Rao, Y., Bronner-Fraser, M. Dual function of Slit2 in repulsion and enhanced migration of trunk, but not vagal, neural crest cells. The Journal of cell biology. 162, 269-279 (2003).
- Kasemeier-Kulesa, J. C., McLennan, R., Romine, M. H., Kulesa, P. M., Lefcort, F. CXCR4 controls ventral migration of sympathetic precursor cells. J. Neurosci. 30, 13078-13088 (2010).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chicken embryo. J. Morph. 88, 49-52 (1951).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Davis, E. M., Trinkaus, J. P. Significance of cell-to cell contacts for the directional movement of neural crest cells within a hydrated collagen lattice. Journal of Embryology and Experimental Morphology. 63, 29-51 (1981).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, 769-775 (1991).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon