È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Produzione e di rilevamento di specie reattive dell'ossigeno (ROS) in Cancro
In questo articolo
Riepilogo
Qui vi proponiamo semplici metodi per testare e valutare la presenza di specie reattive dell'ossigeno nelle cellule.
Abstract
Specie reattive dell'ossigeno comprendono un certo numero di molecole che danno al DNA e RNA e ossidare le proteine e lipidi (perossidazione lipidica). Queste molecole contengono reattive di ossigeno e comprendono H 2 O 2 (perossido di idrogeno), NO (ossido nitrico), O 2 - (anione ossido), il perossinitrito (ONOO -), acido hydrochlorous (HOCl), e radicale ossidrile (OH -) .
Specie ossidativo sono prodotte non solo in situazioni patologiche (cancro, riperfusione ischemica /, patologie neurologiche e cardiovascolari, malattie infettive, malattie infiammatorie 1, malattie autoimmuni 2, ecc ...) ma anche in situazioni fisiologiche (non patologico), come il metabolismo cellulare 3 , 4. Infatti, ROS svolgono un ruolo importante in molti pathway di segnale cellulare (proliferazione, l'attivazione delle cellule 5, 6, 7 migrazione ecc.). ROS può essere dannoso (è poi indicato come"Stress ossidativo e nitrosativo") se prodotti in grandi quantità nel compartimento intracellulare e delle cellule generalmente rispondono a ROS da upregulating antiossidanti come la superossido dismutasi (SOD) e catalasi (CAT), glutatione perossidasi (GPx) e glutatione (GSH) che protegge li convertendo pericolosi radicali liberi in molecole innocue (cioè acqua). Vitamine C ed E sono anche stati descritti come spazzini ROS (antiossidanti).
I radicali liberi sono utili in quantità bassa 3. Macrofagi e neutrofili-mediata risposte immunitarie coinvolgere la produzione e il rilascio di NO, che inibisce i virus, agenti patogeni e la proliferazione del tumore 8. NO reagisce anche con altri ROS e, quindi, ha anche un ruolo come disintossicante (ROS scavenger). Infine NO agisce sui vasi di regolare il flusso di sangue che è importante per l'adattamento del muscolo per l'esercizio fisico prolungato 9, 10. Diverse pubblicazioni hanno anche dimostrato che i ROS sono coinvolti in sens insulinaitivity 11, 12.
Numerosi metodi per valutare la produzione di ROS sono disponibili. In questo articolo proponiamo alcuni test semplice, veloce e conveniente, questi test sono state convalidate da molte pubblicazioni e sono abitualmente utilizzati per rilevare ROS o dei suoi effetti in cellule di mammifero. Mentre alcuni di questi saggi di rilevare molteplici ROS, altri rilevano un solo ROS.
Protocollo
1. Rilevamento di ROS mediante carbossi-H 2 DCFDA
Carbossi-H 2 DCFDA non è fluorescente ma in presenza di ROS, quando questo reattivo viene ossidato, diventa verde fluorescente.
- Immediatamente prima dell'uso, preparare una soluzione fresca stock di carbossi-H 2 DCFDA in sterili dimetilsolfossido (DMSO) o 100% di etanolo. Evitare di più disgelo / cicli di congelamento del colorante.
- Lavare le cellule con soluzione salina tamponata HEPES (HBSS) o tampone fosfato salino (PBS) per rimuovere le tracce del mezzo originale.
- Caricare le cellule con il colorante (e la tintura di controllo, sezione nota cf). In questo test abbiamo utilizzato Jurkat, una linea di cellule di leucemia umana. Usa carbossi-H 2 DCFDA ad una concentrazione finale di 1μM nel terreno di coltura regolari con ridotta siero (2%).
- Incubare le culture per 30 minuti al buio, in un incubatore tradizionale (37 ° C, 5% CO2). Eliminare tutte le soluzioni coloranti utilizzati.
- Rimuovere carbossi-H 2 DCFDA contenente medie e lavare due volte con HBSS o PBS. Da questo passo in avanti, proteggere le cellule dalla luce.
- Aggiungere mezzo fresco contenente il farmaco di scelta per regione carbossi-H 2 DCFDA-caricato cellule e incubare come desiderato. Per questo esempio usiamo H 2 O 2 (0,03%) per 1 ora.
- Valutare ROS da subito analizzando le cellule mediante citometria di flusso utilizzando il canale FL1 (fluorescenza verde), o da lettore di piastre fluorescenza, o al microscopio a fluorescenza. La fluorescenza può essere rilevato usando lunghezze d'onda di eccitazione e di emissione che sono appropriate per fluorescenza verde.
Nota: I controlli devono comprendere carbossi-H 2 cellule non trattate DCFDA-caricati e senza macchia cellule non trattate. Carbossi-H 2 DCFDA è noto per rilevare perossidi, ma potrebbe anche essere ossidato da altri ROS. Questo reagente può anche essere modificata con altri mezzi, colorante controllo insensibile ossidazione come 5 - (e-6)-carbossi-2 ', 7'-dichlordiacetato ofluorescein (carbossi-DCFDA) dovrebbero pertanto essere inclusi nel test.
2. Misurazione di ossido nitrico (NO)
Avrete bisogno Sulfanilamide e N-1-napthylethylenediamine dicloridrato (NED), soluzioni e standard di nitrito. Questo test è chiamato il saggio di Griess.
NED soluzione: creare una soluzione di 0,1% di N-1-napthylethylenediamine dicloridrato diluito in soluzione sterile water.Sulfanilamide: Fai una soluzione all'1% di sulfanilamide diluito in acido fosforico 5%. Nitriti standard: diluire lo stock 0.1M standard di nitrito di sodio per 100μM nel medio sterile, fare una diluizione seriale del medium stesso.
Condizioni di stoccaggio: Conservare i prodotti chimici come indicato dal costruttore a temperatura ambiente. Una volta ricostituito, NED e soluzioni Sulfanilamide vengono memorizzati subito dopo l'uso a 4 ° C, al buio, e per un massimo di 3 mesi.
- Celle di coltura in una piastra da 96 pozzetti,uso triplica per ogni condizione, e includono i controlli proprio in base alle proprie sperimentazioni.
- Curare le cellule per indurre la produzione di NO. Nel nostro esperimento usiamo lipopolisaccaride (LPS) (100 ng / ml) e IL-4 ricombinante per curare le nostre cellule. In questo protocollo, abbiamo utilizzato RAW 264.7, una linea di topi cellule macrofagi (Mouse leucemiche monociti linea cellulare di macrofagi).
- Il giorno del test, portare entrambi i reagenti a temperatura ambiente.
- Gira il tuo piatto, raccogliere sovranatante cellulare e trasferire 50μl a un nuovo 96 pozzetti. Preparare la limitazione pozzi diluizione della soluzione madre a fare una curva standard.
- Aggiungere 50μl di soluzione Sulfanilamide per ogni campione e di controllo dei pozzi e mescolare bene.
- Incubare a temperatura ambiente per 10 minuti al buio.
- Aggiungere 50μl di N-1-napthylethylenediamine soluzione dicloridrato per ogni campione e di controllo dei pozzi e mescolare bene.
- Incubare a temperatura ambiente per 10 minuti al buio.
- Misura Absorbance immediatamente utilizzando un lettore di piastre con filtro di lunghezze d'onda tra 520 nm e 550 nm.
Se si utilizzano diversi piatto / piatto dimensioni, utilizzare 1/1/1 volume per ogni soluzione e surnatante campione.
Un colore viola apparirà nel pozzetti positivi. I risultati ottenuti con lo standard vi aiuterà a verificare la stabilità delle soluzioni.
3. Rilevamento di ROS azione: le proteine ossidate
Un altro metodo per identificare la produzione di ROS è guardare i risultati finali rilevando l'ossidazione delle proteine. Infatti, ROS modificare glutatione, un antiossidante che si esprime nella maggior parte delle cellule e svolge un ruolo protettivo contro i ROS. A seguito di ossidazione da ROS, la modifica del glutatione ridotto (GSH) risultati nella sulfidrilici (tioli), gruppo di suoi cisteina essere collegata a un glutatione un secondo da un ponte disolfuro. Questo porta alla formazione di una proteina dimeri (GSSG proteine ossidate). GSH può essere ripristinata tramite la modifica del GSSG dal reduttasi enzima glutatione. L'aumento del GSSG / GSH rapporto riflette lo stress ossidativo. Il saggio che segue si basa sul rilevamento e la quantificazione di queste proteine ossidate. Questo metodo non è selettivo per specifiche ROS, ma rileva piuttosto gli effetti di NO, H 2 O 2, O 2 - e di altri ROS. Qui si misura la quantità totale di ossidato (GSSG) e ridotto (GSH) glutatione utilizzando segnali bioluminescenti.
- Semi di cellule in una piastra da 96 pozzetti (bianco / trasparente, fondo piatto) come al solito. Per il nostro esperimento abbiamo usato 1x10 4 cellule per pozzetto di aderenti Raw 264,7 e A549 cellule e le cellule Jurkat sospensione. A seconda delle dimensioni delle cellule questi numeri potrebbero essere regolati. Si consiglia di cellule aderenti piatto il giorno prima del test per permettere loro di allegare alla piastra. Abbastanza pozzi dovrebbero essere pronti per la rilevazione delle proteine ossidate e ridotte così come per "solo medium" ecellule non trattate come controlli. Usa triplica per tutte le condizioni.
- Trattare le cellule con il farmaco per il tempo necessario. Qui abbiamo trattato le cellule Jurkat e A549 cellule per 1 ora con H 2 O 2 (a 5 mm e 2,5 mm rispettivamente). 264,7 prime cellule sono state trattate con 200ng/ml di LPS per 16 h. Durante questo periodo di incubazione, portare tutti i reagenti a temperatura ambiente (RT). Rendere tutti i reagenti non più di 30 minuti prima di eseguire il test. La tabella seguente mostra i volumi di reagenti per pozzetto. Quando possibile, è importante rimuovere i supporti contenenti il riducente prima di procedere con il test.
| Cellule aderenti | Sospensione cellule | |||
| Totale Glu Lysis | Ossidato Glu Lysis | Totale Glu Lysis | Ossidato Glu Lysis | |
| NEM, 25mM | nessuno | 0.5μl | nessuno | 0.5μl |
| Luciferina-NT | 1 ml | 1 ml | 1 ml | 1 ml |
| Lysis Buffer passiva, 5X | 10μl | 10μl | 10μl | 10μl |
| Acqua distillata | 39.0μl | 38.5μl | 14μl | 13.5μl |
| Volume finale per pozzo | 50μl | 50μl | 25μl | 25μl |
- Rimuovere media da pozzi con cellule aderenti. Non rimuovere medie pozzetti con cellule in sospensione.
- Aggiungi ridotto reagente di lisi o glutatione ossidato reagente di lisi glutatione nei pozzetti corrispondenti e agitare per 5 minuti a temperatura ambiente.
- Aggiungere il reagente generazione Luciferin e incubate per 30 minuti a temperatura ambiente.
- Aggiungere il reagente di rilevamento Luciferin e incubare per 15 minuti a temperatura ambiente.
- Leggi il segnale bioluminescente in tempo di integrazione di 0,25-1 secondo per bene con un luminometro lettore di piastre.
| Cellule aderenti | Sospensione cellule | |
| Numero di cellule per pozzetto | 1x10 4 | 1x10 4 |
| Sospensione cellulare per ben + di droga | 100 l, da rimuovere prima di 3,4 | 25μl, non deve essere rimosso |
| Il glutatione ridotto Lysis Reagent | 50 microlitri | 25μl |
| Reagente di lisi glutatione ossidato | 50 microlitri | 25μl |
| Luciferina Generazione reagente | 50 microlitri | 50 microlitri |
| Luciferina di rilevamento dei reagenti | 100 ul | 100 ul |
4. Rappresentante dei risultati:
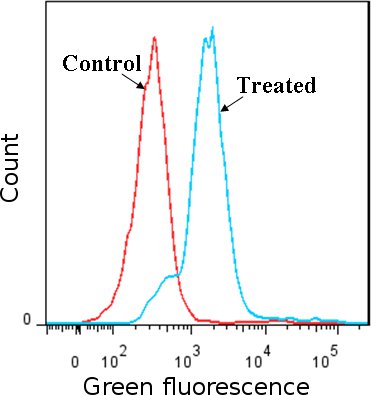
Figura 1 Rilevazione dei ROS con carbossi-H2DCFDA colorante. Cellule Jurkat (linea di cellule umane di leucemia) trattati con H 2 O 2 sono stati confrontati con le cellule non trattate. ROS induce la modifica di carbossi-H 2 DCFDA che diventa fluorescente verde come rilevato mediante citometria di flusso, il picco fluorescente in H 2 O 2 turni rispetto cellule trattate ai picchi nei controlli (H 2 O 2 cellule trattate colorati con coloranti ossidazione insensibile e non trattate con cellule colorate con carbossi-H 2 DCFDA). Risultati confermano la presenza di ROS nelle cellule trattate.

Figura 2 Rilevamento of NO utilizzando reagenti di Griess. RAW 264,7 cellule (mouse macrofagi) sono stati trattati con LPS e IL-4. Un aumento significativo della produzione di NO è stata rilevata in cellule trattate rispetto al controllo cellule non trattate.
| Linee cellulari | Non trattati | Trattati |
| Raw 264,7 | 13,0 | 8,3 |
| A549 | 21,6 | 10,5 |
| Jurkat | 5,2 | 2,8 |
Tabella 1 Rilevazione dei ROS mediata ossidazione delle proteine. RAW 264,7 cellule sono state trattate con LPS, Jurkat e A549 (cancro ai polmoni umani), le cellule sono state trattate con H 2 O 2. I risultati sono espressi come rapporto ridotto (GSH) / ossidato (GSSG) glutatione. Rapporti più bassi di glutatione (GSH) / (GSSG) sono stati rilevati nelle cellule trattate rispetto alcontrollo cellule non trattate, rivelando che le proteine erano più ossidato in cellule trattate.
Discussione
Diverse situazioni patologiche come le malattie infiammatorie, tumori, l'ischemia / riperfusione, ed anche trattamenti come la radioterapia o la chemioterapia (cisplatino cioè) inducono sovrapproduzione ROS. Così, il rilevamento e la misurazione dei livelli di ROS è importante in molte di base, gli studi pre-clinici e clinici. Tuttavia, ROS hanno tempi di dimezzamento molto breve e potrebbe essere complicata da rilevare. Qui, proponiamo semplici test che vengono utilizzati di routine e ampiamente accettato per la...
Divulgazioni
Abbiamo ricevuto l'appoggio di Promega per questa pubblicazione.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institutes of Health (CA142664).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| 5 - (e-6)-carbossi-2 ', 7'-diclorofluoresceina diacetato (carbossi-DCFDA) | Molecular Probes | C369 | controllo |
| carbossi-H 2 DCFDA | Molecular Probes | C400 | |
| Sulfanilamide | Sigma | S9251-100G | |
| N-1-napthylethylenediamine dicloridrato | Sigma | N9125-10G | |
| Nitriti di serie | Sigma | 237213-100G | |
| GSH / GSSG-Glo Assay | Promega | V6612 | Per quantificare ossidato, ridotto o ossidato / glutatione ridotto |
Riferimenti
- Guzik, T. J., Korbut, R., Adamek-Guzik, T. Nitric oxide and superoxide in inflammation and immune regulation. J Physiol Pharmacol. 54, 469-487 (2003).
- Perl, A., Gergely, P., Banki, K. Mitochondrial dysfunction in T cells of patients with systemic lupus erythematosus. Int Rev Immunol. 23, 293-313 (2004).
- Valko, M., Leibfritz, D., Moncol, J., Cronin, M. T., Mazur, M., Telser, J. Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol. 39, 44-84 (2007).
- Droge, W. Free radicals in the physiological control of cell function. Physiol Rev. 82, 47-95 (2002).
- Nakamura, K., Yube, K., Miyatake, A., Cambier, J. C., Hirashima, M. Involvement of CD4 D3-D4 membrane proximal extracellular domain for the inhibitory effect of oxidative stress on activation-induced CD4 down-regulation and its possible role for T cell activation. Mol Immunol. 39, 909-921 (2003).
- Los, M., Droge, W., Stricker, K., Baeuerle, P. A., Schulze-Osthoff, K. Hydrogen peroxide as a potent activator of T lymphocyte functions. Eur J Immunol. 25, 159-165 (1995).
- Deem, T. L., Cook-Mills, J. M. Vascular cell adhesion molecule 1 (VCAM-1) activation of endothelial cell matrix metalloproteinases: role of reactive oxygen species. Blood. 104, 2385-2393 (2004).
- Pacher, P., Beckman, J. S., Liaudet, L. Nitric oxide and peroxynitrite in health and disease. Physiol Rev. 87, 315-424 (2007).
- Griendling, K. K., Sorescu, D., Lassegue, B., Ushio-Fukai, M. Modulation of protein kinase activity and gene expression by reactive oxygen species and their role in vascular physiology and pathophysiology. Arterioscler Thromb Vasc Biol. 20, 2175-2183 (2000).
- Loh, K., Deng, H., Fukushima, A., Cai, X., Boivin, B., Galic, S., Bruce, C., Shields, B. J., Skiba, B., Ooms, L. M., Stepto, N., Wu, B., Mitchell, C. A., Tonks, N. K., Watt, M. J., Febbraio, M. A., Crack, P. J., Andrikopoulos, S., Tiganis, T. Reactive oxygen species enhance insulin sensitivity. Cell Metab. 10, 260-272 (2009).
- Goldstein, B. J., Mahadev, K., Wu, X. Redox paradox: insulin action is facilitated by insulin-stimulated reactive oxygen species with multiple potential signaling targets. Diabetes. 54, 311-321 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon