È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Utilizzando conveniente array LED per la foto-stimolazione dei neuroni
In questo articolo
Riepilogo
Adulti-nato neuroni che esprimono ChR2 può essere manipolata in preparati fetta elettrofisiologici al fine di esaminare il loro contributo verso la funzione olfattiva di circuiti neurali.
Abstract
Elettrofisiologia fetta standard ha permesso ai ricercatori di sondare i singoli componenti dei circuiti neurali registrando le risposte elettriche di singole cellule in risposta a elettrica o farmacologica 1,2 manipolazioni. Con l'invenzione di metodi per controllare visivamente i neuroni geneticamente mirata (optogenetics), i ricercatori hanno ora un livello senza precedenti di controllo su gruppi specifici di neuroni nella preparazione fetta standard. In particolare, fotosensibile channelrhodopsin-2 (ChR2) permette ai ricercatori di attivare i neuroni con la luce 3,4. Grazie alla combinazione di calibrazione accurata basata su LED di fotostimolazione ChR2 con elettrofisiologia fetta standard, siamo in grado di riconoscere con maggior dettaglio il ruolo di adulto-nato interneuroni nel bulbo olfattivo, il primo relè centrale del sistema olfattivo. Utilizzando l'espressione virale di ChR2-YFP specificamente in neuroni adulti nati, siamo in grado di controllare selettivamente i giovani adulti nati i neuroni in un ambiente di un vecchiod neuroni maturi. Il nostro controllo ottico utilizza un sistema semplice e poco costoso a LED, e si mostra come questo sistema può essere calibrato per capire quanta luce è necessaria per evocare spiking attività in singoli neuroni. Quindi, brevi lampi di luce blu può controllare a distanza il modello lancio di ChR2-trasdotte neonato.
Protocollo
1. Ottiche di calibrazione: misura LED di alimentazione
- Allegare una serie di LED di un dissipatore attivo raffreddato da una ventola e di apporre questa macchinetta LED / dissipatore di calore per una lente di collimazione.
- Sostituire la lampada utilizzata in campo chiaro con illuminazione a LED / dissipatore / ventola / la lente. Questo apparecchio deve essere accuratamente posizionato in modo che il fascio collimato viaggia lungo un percorso lineare ottico verso la lente condensatore. Assicurarsi che il dissipatore di calore / ventola messa a terra di un terreno comune del sistema.
- Guidare l'array LED con un alimentatore in grado di dare impulsi ad alta risoluzione e la piazza di corrente. Questo alimentatore può essere controllato da un impulso TTL 5V proveniente da un generatore di impulsi.
- Centrare il fascio collimato lungo il percorso della luce definita tra il diaframma di campo e la lente condensatore. Idealmente, il raggio LED leggermente riempire troppo il diaframma di campo completamente aperto. Di solito, un fascio collimato più strettamente LED riempire questa apertura di meno, e produrrà morpotenza e alle spese di uniformità. Nella nostra configurazione abbiamo aumentato l'uniformità della luce, scegliendo una lente di collimazione che ha proiettato un'immagine leggermente ampliato dell'array LED suo piano coniugato al diaframma consenser.
- Ottenere illuminazione Kohler, concentrandosi il condensatore in modo che l'immagine del diaframma di campo (la membrana più vicino alla sorgente luminosa) è focalizzata sulla camera di slice (fig. 1). Un tessuto di carta sottile lente può fungere da schermo di proiezione per visualizzare l'immagine focalizzata del diaframma di campo a profondità di altri.
- Praticare una serie di fori di diametro noto in un materiale opaco. Posto uno di questi piccoli fori sopra il sensore ottico di un power-metro. Posizionare il misuratore di potenza sul palcoscenico del campione e al centro il misuratore di potenza sopra l'immagine mirata del diaframma di campo semplicemente spostando il misuratore di potenza fino a quando non dà una lettura massima. Apporre il misuratore di potenza in questa posizione.
- Aprire completamente tutte le aperture (diaframma e aperaturediaframma di campo). Sistematicamente spostare l'allegato fetta camera / misuratore di potenza rispetto al percorso della luce ottica e calcolare l'uniformità della potenza ottica all'interno dell'area illuminata. Costruire la trama uniformità per il sistema. Se il microscopio è correttamente configurato con illuminazione Kohler centrata a fuoco l'obiettivo, la potenza massima dovrebbe essere direttamente sotto l'obiettivo, e le regioni al di fuori di questo è opportuno concentrarsi ora ricevere una quantità nota di potenza secondo la trama uniformità.
- Per ogni dimensione del foro stenopeico, costruire una curva standard di potenza ottica vs superficie foro stenopeico. Regolando la corrente di ingresso alla matrice di LED, producono questa curva a diversi livelli di potenza e di ogni curva di calcolare la potenza per mm2. Se l'array LED deve essere utilizzato per l'ottica patch, assicurarsi di introdurre elementi ottici necessari per l'applicazione di patch (condensatori, punte di spillo e filtri) per sapere quanta luce viene trasmessa sotto illuminazione patch.
- Sfogliando il misuratore di potenzafaccia l'obiettivo, calcolare l'intensità di illuminazione a 470nm quando la lampada al mercurio è accesa.
- Aggiungere una fetta vivere alla camera, e ricostruire le curve standard per determinare la potenza della luce trasmessa attraverso il tessuto cerebrale di scattering.
2. Procedura di affettare e Elettrofisiologia
Parte A: Preparazione Slice
- Anestetizzare (60 mg / kg di ketamina e 2mg/kg xilazina) e decapitare il mouse. Sezionare il cervello artificiale liquido cerebro-spinale (ACSF, in mm: 124 NaCl, 3 KCl, 1,3 MgSO 4, 26 NaHCO 3, 1,25 NaHPO 4, 20 di glucosio, 2 CaCl 2; ~ 310mOsm, pH 7,4, quando bolle con un misto di 95% O2 e 5% di CO2 5,1), facendo attenzione a non danneggiare i bulbi olfattivi. Separare i due emisferi e il luogo su agar con la superficie ventrale anche con un bordo (per le sezioni orizzontali).
- Agar e la colla superficie dorsale di ogni emisfero corticale alla vibrAtome mandrino, e lentamente riempire la vasca con ghiaccio freddo ACSF. Fetta dalla superficie ventrale in 300 sezioni micron, il trasferimento di ogni sezione per riscaldato (34-36 ° C) e ossigenato ACSF, permettendo loro di recuperare per 30-45 minuti.
Parte B: Misura Patch sciolti della soglia di Spike
- Dopo aver portato le fette a temperatura ambiente per 30 minuti, delicatamente una fetta nella camera di registrazione della Camera microscopio sotto perfusione costante di ACSF ossigenato.
A rischio di stimolare eccessivamente ChR2 neuroni infetti, la presenza di EYFP-ChR2 può essere confermata in epifluorescenza (fig. 2a) - Tirare elettrodi di vetro su un estrattore pipetta (Sutter P-97). Riempi questo elettrodo con ACSF. Quando nel bagno ACSF la resistenza punta dovrebbe essere tra 7-10 MOhm.
- Sotto illuminazione fluorescente, individuare nella fetta un sano ChR2-EYFP con morfologia dei neuroni maturi. Anche individuare soma questo neurone in ottica di patch.
- Con la luce a pressione positiva passa attraverso l'elettrodo, abbassare l'elettrodo di patch verso il neurone identificato fluorescente. Quando il contatto membrana è realizzata, in modo rapido rilascio pressione positiva e applicare una piccola quantità e breve di aspirazione attraverso la punta. Un giga ohm sigillo dovrebbe essere fatta tra la membrana plasmatica e le pareti dell'elettrodo patch.
- Anche se un giga-sigillo non si forma, se l'elettrodo è sufficientemente vicino ad una attività neuronale fluorescente spiking dovrebbe produrre un potenziale misurabile campo locale. Attivare ChR2 in questo neurone facendo lampeggiare diverse dosi di luce. Perché la luce-dose è una funzione sia di LED di potenza e durata, calcolare quanta luce è necessaria per evocare un potenziale d'azione a poteri diversi e durate (Fig. 2b). Anche osservare quanto si verifica in spiking illuminazione lampada al mercurio.
3. Rappresentante dei risultati:
Sul nostro microscopio (Olympus BX51WI), i nostri LED èn linea con 2 aperture e una lente condensatore, mantenendo così il percorso della luce originale del preinstallato lampada ad arco. Con la chiusura sia il diaframma di campo e il diaframma aperature, possiamo ottenere contrasto brightfield sufficiente per la registrazione patch clamp (fig. 1b). Con tutti i diaframmi completamente aperti esponiamo la fetta di potenza luminosa massima per channelrhodopsin attivazione (fig. 1a). Sul nostro microscopio, questa configurazione patch produce luce densità che è circa tre ordini di grandezza inferiore alla densità massima a pieno campo (4,1 μW / mm 2 rispetto a 6,88 mW / mm 2).
Vediamo etichettatura robusto di adulti nati granuli bulbo olfattivo e neuroni periglomerular settimane dopo l'infezione lentivirali di migrazione neuroblasti nel flusso migratorio rostrale (fig. 2a) A-patch allentato la registrazione da un unico adulto-nato ChR2-EYFP esprimere cellule dei granuli indica che a 5 ms stimolazione massimaum di potenza (6,88 mW / mm 2) è sufficiente a evocare spiking (Fig. 2b). Dal livello di espressione varia tra le cellule, la quantità di luce che passa la soglia di picco potrà variare e dovrebbe essere descritti statisticamente per ciascun tipo di cellula di interesse.
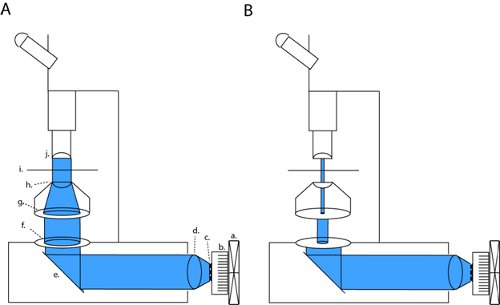
Figura 1. LED di configurazione degli array di pieno campo fotostimolazione e patch-clamp elettrofisiologia fetta. Per attivare channelrhodopsin (ChR2) si proiettano un fascio collimato attraverso aperture di nuovo aperto e ottica condensatore (a). Questa configurazione può essere modificata in alto contrasto ottica patch attraverso la piena chiudendo il diaframma di campo e modulando la larghezza del diaframma di campo (b). Abbreviazioni: a. ventola, dissipatore b., c. serie di LED, d. collimazione obiettivo, e. specchio, diaframma di campo f., g. diaframma, lente condensatrice h., i. sample stadio, j. obiettivo.
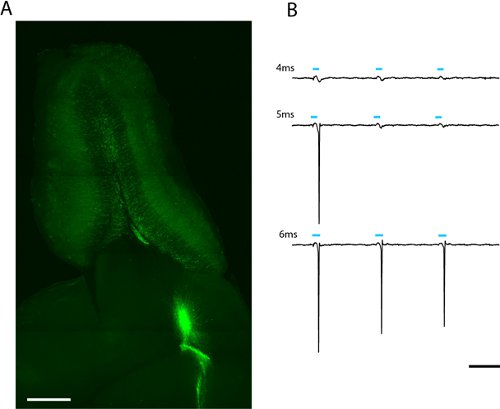
Figura 2. Immagine di una fetta 300μm orizzontale di bulbo olfattivo di patch clamp e con tutto il campo fotostimolazione (a). Lentivirally infetti adulti nati cellule granulari esprimono ChR2-EYFP si può vedere si irradiano dal centro del bulbo olfattivo. La luce-dose necessaria per evocare spiking si possono trovare aumentando la durata del flash LED (b). La soglia per questa cella dei granuli è stato 5ms alla massima intensità LED (2.43mW/mm 2). Scala in (a) = 500μm, scala in (b) = 50 ms.
Discussione
Ultimi anni hanno visto un'esplosione della popolarità di strumenti per la ricerca neuroscientifica optogenetic 6. Di conseguenza, è sempre più importante per abbassare la barriera di ingresso per i laboratori che vogliono iniziare a utilizzare questi nuovi strumenti. Qui descriviamo come condurre un riadattamento semplice ed economica e la calibrazione di un convenzionale impianto di patch-clamp in modo che possa farlo a pieno campo stimolazione ottica di channelrhodopsin che esprimono i neuroni. In p...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto dalla compagnia di assicurazione sulla vita "AG2R-La Mondiale", Ecole des Neurosciences de Paris (PEV), l'Agence Nationale de la Recherche "ANR-09-Neur-004", nella cornice di "ERA-NET NEURON "del 7 ° PQ dalla Commissione Europea e la Fondazione Pasteur. Sebastien Wagner è stato sostenuto dalla Fondazione Letten.
Materiali
| Name | Company | Catalog Number | Comments |
| Ketamine | Imalgène 1000 | 100 mg/ml | |
| Xylazine | Rompun | 2% | |
| NaCl | Sigma-Aldrich | S5886 | &nbps; |
| KCl | Sigma-Aldrich | P5405 | |
| MgSO4 | Sigma-Aldrich | M1880 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| NaHPO4 | Sigma-Aldrich | S5011 | |
| Glucose | Sigma-Aldrich | G7021 | |
| CaCl2 | Sigma-Aldrich | C7902 | |
| Agarose | Sigma-Aldrich | A9539 | |
| Pipette Puller | Sutter Instrument Co. | P-97 | |
| Glass Capillaries | Harvard Apparatus | GC150T-10 | 1.5 mm O.D./1.17 mm I.D. |
| LED array | Bridgelux | BXRA-C2000 | |
| Collimating lens | Thorlabs Inc. | LEDC1 | 40 mm beam diameter |
| Power supply | A1W Electronik | HKO2800 | 2.8 amp |
| Optical power meter | Thorlabs Inc. | PM 100 | |
| Heatsink | Thermaltake | A1838 | Silent Boost K8 |
| Fan | Thermaltake | A1838 | Silent Boost K8 |
| Vibratome | Leica Microsystems | VT1200S |
Riferimenti
- Nissant, A. Adult neurogenesis promotes synaptic plasticity in the olfactory bulb. Nature Neuroscience. 12, 728-730 (2009).
- Apicella, A. Pyramidal Cells in Piriform Cortex Receive Convergent Input from Distinct Olfactory Bulb Glomeruli. Journal of Neuroscience. 30, 14255-14260 (2010).
- Boyden, E. S. genetically targeted optical control of neural activity. Nature. 8, 1263-1263 (2005).
- Bardy, C. where new inhibitory neurons release neurotransmitters in the adult olfactory bulb. The Journal of Neuroscience. 30, 17023-17034 (2010).
- Grubb, M. S. Functional maturation of the first synapse in olfaction: development and adult neurogenesis. The Journal of neuroscience. 28, 2919-2932 (2008).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nature reviews. Neuroscience. 8, 577-581 (2007).
- Grossman, N. Multi-site optical excitation using ChR2 and micro-LED array. Journal of neural engineering. 7, 16004-16004 (2010).
- Dhawale, A. K. Non-redundant odor coding by sister mitral cells revealed by light addressable glomeruli in the mouse. Nature neuroscience. 13, 1404-1412 (2010).
- Weick, J. P. Functional control of transplantable human ESC-derived neurons via optogenetic targeting. Stem cells. 28, 2008-2016 (2010).
- Toni, N. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nature Neuroscience. 11, 901-907 (2008).
- Grubb, M. S., Burrone, J. Channelrhodopsin-2 Localised to the Axon Initial Segment. PLoS ONE. 5, e13761-e13761 .
- Tye, K. M. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature. 471, 358-362 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon