Method Article
Elettroporazione di Mesenchima craniofacciale
In questo articolo
Erratum Notice
Riepilogo
Cartilagini craniofacciali sviluppare a stretto contatto con altri tessuti e sono difficili da manipolare di animali vivi. Stiamo usando elettroporazione per fornire strumenti molecolari durante la crescita dello scheletro cranio-facciale, mentre bypassando primi effetti embrionale. Questo approccio ci permetterà di testare in modo efficiente molecole candidate In vivo.
Abstract
L'elettroporazione è un metodo efficace di fornire DNA e altre macromolecole carica nei tessuti in punti temporali precisi e in luoghi precisi. Per esempio, elettroporazione è stato utilizzato con successo per studiare lo sviluppo neurale e della retina in Xenopus, pollo e topo 1-10. Tuttavia, è importante notare che in tutti questi studi, gli investigatori non sono stati targeting tessuti molli. Perché siamo interessati allo sviluppo craniofacciale, abbiamo adattato un metodo per indirizzare mesenchima del viso.
Quando abbiamo cercato la letteratura, abbiamo trovato, con nostra sorpresa, rapporti molto pochi di trasferimento genico di successo nel tessuto cartilagineo. La maggior parte di questi studi sono stati studi sulla terapia genica, come la consegna di siRNA o proteine in linee cellulari condrogenico, o, modelli animali di artrite 11-13. In altri sistemi, come il pollo o il mouse, elettroporazione di mesenchima viso è stato impegnativo (COMUNICAZI personaleioni, Dipartimento dello Sviluppo cranio-facciali, KCL). Abbiamo ipotizzato che nei tessuti elettroporazione procartilaginous e cartilagineo in Xenopus potrebbe funzionare meglio. Nei nostri studi, abbiamo dimostrato che il trasferimento genico nelle cartilagini del viso si verifica in modo efficiente nelle fasi iniziali (28), quando il primordio facciale è ancora costituito da tessuti molli prima della differenziazione della cartilagine.
Xenopus è un sistema molto accessibile vertebrati per l'analisi dello sviluppo cranio-facciale. Strutture cranio-facciali sono più facilmente visibili in Xenopus che in qualsiasi altro modello vertebrato, in primo luogo perché gli embrioni sono fecondati esternamente Xenopus, consentendo analisi delle prime fasi, e di facilitare l'imaging dal vivo a risoluzione singola cellula, nonché il riutilizzo delle madri 14. Tra i modelli vertebrati sviluppo esternamente, Xenopus è più utile per l'analisi del cranio di pesce zebra, come larve di Xenopus sono più grandi e più facile dissect, e la regione lo sviluppo del viso è più accessibile per l'imaging rispetto alla regione equivalente nel pesce. Inoltre, Xenopus è evolutivamente più vicina agli esseri umani di zebrafish (~ 100 milioni anni più vicini) 15. Infine, in queste fasi, girini Xenopus sono trasparenti, e l'espressione contemporanea di proteine fluorescenti o molecole permette una facile visualizzazione delle cartilagini di sviluppo. Possiamo anticipare che questo approccio ci permetterà di testare rapidamente ed efficacemente le molecole candidato in un sistema modello in vivo.
Protocollo
Parte 1A. Attrezzatura
Microscopio: verticale portata stereo-dissezione con obiettivo a basso
- Tensione / generatore di impulsi: BTX ECM 830 Piazza del sistema Elettroporazione Onda
- Pipette puller: P-87 Micropipetta Puller (Instrument Company Sutter, CA)
- Manipolatore: grossolani, o combinata grossa e fine a seconda preparazione.
- Micropipetta titolare: Strumenti Scienza fine
- Elettrodo: fatto in casa
- Elettroporazione camera: fatto in casa
L a forma di elettrodi:
- Tagliare 8 cm di elevata purezza filo di tungsteno 0,4 mm (Goodfellow) e apporre a metà di una siringa da 1 ml con stucco (usiamo Blu-Tack). Lasciare 4 fili di tungsteno centimetri esposti dalla punta della siringa e la punta piegare in forma di L, 1 cm dalla fine (Fig. 1A).
- Trim punta in modo che alla fine le misure 0,5 millimetri di lunghezza. Tla sua punta è il capolinea degli elettrodi.
- Esegui eccesso parallelo filo di tungsteno di siringa e utilizzarlo per collegare il generatore di impulsi elettrodi.
- Ripetere il processo di fare una coppia di elettrodi.
- Collegare gli elettrodi al generatore di impulsi quadrati onda via cavo DC.
Camera di elettroporazione
- Bottom line di 90 mm con piatto ~ 5 mm non tossica plastilina.
- Riempire piatto con i media elettroporazione.
- Utilizzando n. 5 orologeria forcipe ritagliarsi una forma di T e (Fig. 2). Il pozzo lungo deve misurare ~ 2 mm x 2 mm x 10 mm e la breve ~ 2 mm x 2 mm x 5 mm. Il piatto elettroporazione può essere lavato e riutilizzato.
Parte 1B. Reagenti
DNA o macromolecole paga
- Micropipette: 1 mm di larghezza 4 "lungo capillari di vetro borosilicato (WPI, TW100-F)
- Cultura dei media: Normale Amphibian Media (NAM)
- > 10 X magazzino: 1100 mM NaCl, 20mM KCL, 10 mM Ca (NO 3) 2 • 4H 2 O, 1 mM EDTA.
- Autoclave e conservare a 4 ° C.
- 1 X NAM: diluire da 10x magazzino, buffer con 0,1 mM NaHCO 3 e 0,2 mM Na 3 PO 4.
- Xenopus laevis girini, tappa 28
DNA preparazione:
- Preparare plasmidi di espressione utilizzando protocolli standard.
- Risospendere il DNA ad una concentrazione finale di 1 mg / mL nel priva di nucleasi H 2 0.
* Abbiamo avuto successo con i vettori che contiene un promotore forte CMV, come pCS2 + [16]. Per l'analisi lignaggio, di solito includono DNA che codifica una proteina fluorescente verde (GFP + pCS2) ad una concentrazione finale di 0,1 mg / mL. Concentrazioni di DNA [tra 0,1-3 mg / mL sono stati testati. Abbiamo trovato che le concentrazioni di sotto di 0.8 mg / mL cellule inefficiente etichettati, mentre le concentrazioni di DNA superiore a 2 mg / m &u, l non ha migliorato l'efficienza elettroporazione].
Morfolino preparazione oligonucleotidi:
(Nota:. MOS devono essere fluoresceinated (3'-carboxyfluorescein modificati) o altrimenti a pagamento)
- Risospendere oligonucleotidi morfolino (MOS) (Genetools, www.genetools.com ) ad una concentrazione di 2 mm priva di nucleasi H 2 0.
- Aliquota di calore di soluzione a 65 ° C per 5 minuti.
- Diluire a concentrazione finale di 0,5 mM in acqua priva di nucleasi.
* 0.1-1mm MO soluzioni sono state testate. 0.5 mM soluzioni MO erano sufficienti per l'elettroporazione di molte cellule mesenchimali.
Micropipette
- Preparare micropipette da capillari di vetro borosilicato (1 mm di larghezza, 4 "a lungo, WPI no. TW100-F). Estrattore Utilizzare l'ago per preparare micropipette con un cono 8-12 mm di lunghezza e punta fine.
- Crush punta ~ 2 mmdalla punta con pinze, creando una rottura frastagliato.
Media
- Mezzi di incubazione: Preparare fresco 3 / 4 Normale Anfibio Media (NAM) da 1x magazzino. Aggiungi 0,025 mg / ml di gentamicina.
- Mezzi di elettroporazione: come sopra, con il 0,1% Benzocaina (Sigma, 06950).
2. Elettroporazione
Micropipetta di setup
- Riempire con micropipetta ~ 1 soluzione iniettabile microlitri.
- Sicuro micropipetta in micromanipolatore e allegare alla microinjector (Picospritzer II).
- Micropipetta angolo a 50 ° dal piano del tavolo.
- Impostare la pressione di iniezione a 20 PSI.
- Calibrare micropipetta per iniettare 30 nl per impulso.
Girino preparazione
- Anestetizzare tappa 28 larve di Xenopus incubando elettroporazione in media per 5 minuti.
- Trasferimento girino anestetizzato nella camera di elettroporazione riempito con i media elettroporazione. Posizione embrioneall'interno del lungo e in modo che la testa resti in incrocio a T con lato dorsale verso il basso e lato ventrale esposti. La testa deve essere leggermente elevata rispetto alla coda.
- Utilizzando pinze, dolcemente sicuro girino bene con circostante plastilina. (Nota:.. Se il girino non è protetto, essa può contrarsi e di contatto degli elettrodi durante elettroporazione In questo caso scartare il girino come tessuti facciali sarà gravemente danneggiato)
Elettroporazione
- Inserire il puntale micropipetta immediatamente posteriore alla ghiandola cemento e in mesenchima del viso.
- Iniettare 30 soluzione nl in mesenchima.
- Ritrarre micropipetta.
- Allineare rapidamente punte degli elettrodi in parallelo alla testa di un embrione (Fig. 3).
- Applicare 8 50 ms, impulsi 20mV quadrati.
- Ritrarre elettrodi.
- Utilizzando pinze attentamente rilascio da girino bene e il trasferimento a 3 / 4 NAM, 0,025 mg / ml di gentamicina.
- Girini possono essere incubate in 3 / 4 NAM, 0,025 mg / ml overnight, o più.
- Embrioni schermo per l'elettroporazione efficiente mediante microscopia a fluorescenza, dopo 24 ore.
3. Rappresentante dei risultati:
L'uso di molecole fluorescenti permette lo screening degli embrioni elettroporate facile. La Figura 4 mostra una partita tipica di MO elettroporate girini ~ 12, 48 e 96 ore dopo l'elettroporazione, incubate a 14,5 ° C. Usando la microscopia a fluorescenza, MOS possono essere visualizzati immediatamente dopo l'elettroporazione e persistono per diversi giorni dopo l'elettroporazione. Nella nostra esperienza, la fluorescenza è debolmente evidente allo stadio 46 (~ 5 giorni dopo). Nel cartilagini, fluorescenza diminuisce drasticamente dopo l'inizio della differenziazione (~ ° 42), tuttavia, MO fluorescenza persiste più forte in altri tipi di cellule come l'endoderma faringeo. Microscopia a fluorescenza mostra che oligonucleotidi sono incorporati in vari tessuti tra cui la cartilagine cranio-facciale. Oligonucleotide fluorescenza cuno spesso essere visualizzati in tessuto su entrambi i lati della testa. Ciò è probabilmente dovuto alla rapida diffusione della soluzione iniettabile di tutto il mesenchima craniofacciale sciolto prima di elettroporazione.
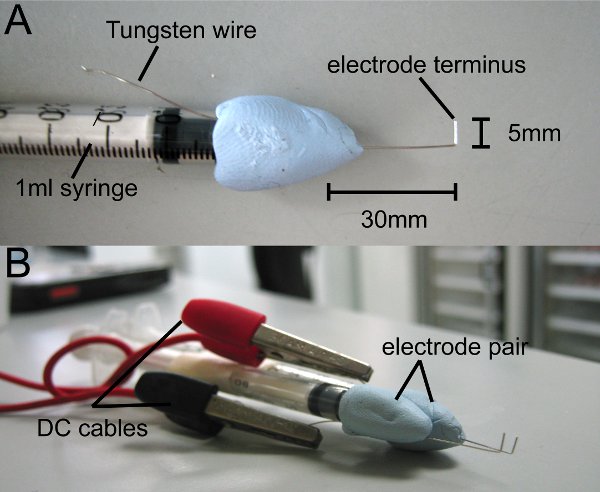
Figura 1 elettrodi fatti in casa. L a forma di filo di tungsteno è attaccato ad una siringa da 1 ml con atossici argilla o mastice. (A) Il capolinea elettrodo misure di 5 mm. (B) Allegare una coppia di elettrodi, in modo che i termini corrono parallele. Gli elettrodi sono collegati al generatore di impulsi da cavi DC.

Figura 2 camera di elettroporazione. (A) 90 millimetri piatto rivestito con la plastilina è pieno di media e una T-camera a forma scolpita con una pinza n. 5 orologeria. (B) Il lato lungo misura 2 mm x 2 mm X10 millimetromentre le misure a breve 2 mm x 2 mm x 5 mm. La testa dell'embrione riposa nella incrocio a T, lato ventrale in su.
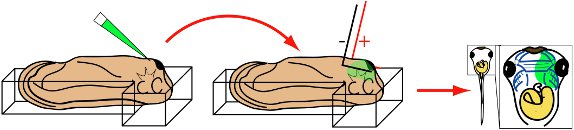
Figura 3 procedura di elettroporazione schematica illustrazione. St. 28 girino viene posto in camera di elettroporazione, lato ventrale in su. Micropipetta viene inserito in viso ghiandola cemento mesenchima sottostante. Iniettare. Micropipetta viene rimossa e a forma di L elettrodi sono allineati parallelamente ai lati della testa. Applicare otto 50 ms, 20 mV impulsi quadrati. Ritrarre elettrodi. Girini crescono a fasi desiderato. Visualizzate MOS o espressione GFP usando la microscopia a fluorescenza.
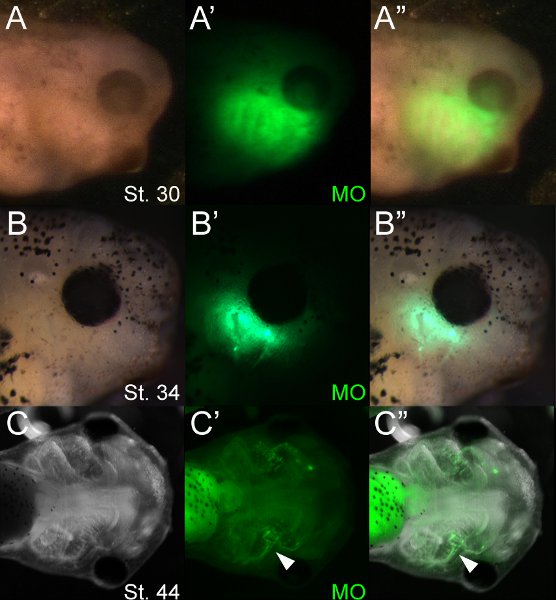
Figura 4 girini Rappresentante 12 (A), 48 (B) e 96 (C) ore dopo l'elettroporazione (tappe 30, 34 e 44 rispettivamente). (A "B") fluorescente MO possono essere visualizzati all'interno di mesenchima craniofacciale al cervoES 30 e 34. Fluorescenza possono essere rilevati in fase di cartilagini a 44 (punta di freccia, C 'C "). L'intestino è altamente autofluorescenti.
Discussione
In questo video, abbiamo dimostrato la fattibilità di elettroporazione-mediata consegna del gene nel mesenchima facciale di girini Xenopus. Usando questo approccio, siamo in grado di bypassare primi effetti sullo sviluppo di manipolare la funzione del gene che ci permette di indirizzare specifici tessuti nei punti più tardi. I nostri studi mostrano che la popolazione eterogenea di cellule mesenchimali cranio-facciale può essere influenzata, che ci permette di esaminare stirpe di cellule elettroporate così come cellula autonoma requisiti per le proteine di interesse. In combinazione con immagini dal vivo, possiamo usare questo approccio per studiare la funzione dei geni, nel tempo, durante lo sviluppo cranio-facciale. Questo nuovo metodo evidenzia la trattabilità di Xenopus per lo studio della organogenesi. Possiamo anticipare che questo metodo può essere ampiamente adattato per lo studio della morfogenesi e la differenziazione dei tessuti anche altri.
Divulgazioni
Gli autori non hanno conflitti di interesse.
Riconoscimenti
Siamo grati a Nancy Papalopulu e Boyan Bonev per l'assistenza con elettroporazione Xenopus. Ringraziamo anche Marc Dionne per la lettura critica, Jeremy Green e John Wallingford per utili discussioni ed i membri del laboratorio Liu per il loro sostegno. Questo lavoro è stato finanziato da sovvenzioni da parte del BBSRC (BB/E013872/1) e il Wellcome Trust (081880/Z/06/Z) per KJL.
Riferimenti
- Bonev, B., Pisco, A., Papalopulu, N. MicroRNA-9 reveals regional diversity of neural progenitors along the anterior-posterior axis. Dev. Cell. 20, 19-32 (2011).
- Haas, K. Single-cell electroporation for gene transfer in vivo. Neuron. 29, 583-591 (2001).
- Calegari, F. Tissue-specific RNA interference in post-implantation mouse embryos using directional electroporation and whole embryo culture. Differentiation. 72, 92-102 (2004).
- Drinjakovic, J. E3 ligase Nedd4 promotes axon branching by downregulating PTEN. Neuron. 65, 341-357 (2010).
- Falk, J. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC. Dev. Biol. 7, 107-107 (2007).
- Hewapathirane, D. S., Haas, K. Single Cell Electroporation in vivo within the Intact Developing Brain. J. Vis. Exp. (17), e705-e705 (2008).
- Kuriyama, S. Tsukushi controls ectodermal patterning and neural crest specification in Xenopus by direct regulation. of BMP4 and X-delta-1 activity. Development. 133, 75-88 (2006).
- Mende, M., Christophorou, N. A., Streit, A. Specific and effective gene knock-down in early chick embryos using morpholinos but not pRFPRNAi vectors. Mech. Dev. 125, 947-962 (2008).
- Neumann, E. Gene transfer into mouse lyoma cells by electroporation in high electric fields. Embo. J. 1, 841-845 (1982).
- Price, S. R. Regulation of motor neuron pool sorting by differential expression of type II cadherins. Cell. 109, 205-216 (2002).
- Grossin, L. Direct gene transfer into rat articular cartilage by in vivo electroporation. Faseb. J. 17, 829-835 (2003).
- Khoury, M. A comparative study on intra-articular versus systemic gene electrotransfer in experimental arthritis. J. Gene. Med. 8, 1027-1036 (2006).
- Takahashi, D. Down-regulation of cathepsin K in synovium leads to progression of osteoarthritis in rabbits. Arthritis. Rheum. 60, 2372-2380 (2009).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early Development of Xenopus laevis: A Laboratory Manual. , (2000).
- Wheeler, G. N., Brandli, A. W. Simple vertebrate models for chemical genetics and drug discovery screens: lessons from zebrafish and Xenopus. Dev. Dyn. 238, 1287-1308 (2009).
- Turner, D. L., Weintraub, H. Expression of achaete-scute homolog 3 in Xenopus embryos converts ectodermal cells to a neural fate. Genes. Dev. 8, 1434-1447 (1994).
Erratum
Formal Correction: Erratum: Electroporation of Craniofacial Mesenchyme
Posted by JoVE Editors on 6/28/2013. Citeable Link.
A correction was made to Electroporation of Craniofacial Mesenchyme. There was an incorrect unit used for the voltage.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon