È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modello murino di endometriosi chirurgicamente indotto da Auto-trapianto di tessuto uterino
In questo articolo
Riepilogo
Una descrizione della induzione chirurgica di endometriosi in topi e ratti con auto-trapianto di tessuto uterino alla cascata delle arterie del mesentere intestinale.
Abstract
L'endometriosi è una malattia cronica, dolorosa malattia la cui eziologia rimane sconosciuta. Inoltre, il trattamento di endometriosi può richiedere la rimozione laparoscopica delle lesioni, e / o croniche gestione farmaceutica del dolore e dei sintomi infertilità. Il costo associato con endometriosi è stato stimato a 22 miliardi di dollari all'anno negli Stati Uniti 1. Per ulteriormente la nostra comprensione dei meccanismi alla base di questa malattia enigmatica, i modelli animali sono stati impiegati. Primati sviluppano spontaneamente endometriosi e quindi modelli di primati più simili alla malattia nelle donne. Modelli di roditori, tuttavia, sono più convenienti e facilmente reperibili 2. Il modello che abbiamo descritto qui comporta un trasferimento autologo di tessuto uterino al mesentere intestinale (Figura 1) ed è stato sviluppato nel ratto 3 e poi trasferito al mouse 4. L'obiettivo del modello roditore autologo di endometriosi chirurgicamente indotta è quella di imitarela malattia nelle donne. Noi e altri hanno già dimostrato che l'alterato pattern di espressione genica osservata nelle lesioni endometriosiche da topi o ratti rispecchia quella osservata nelle donne con la malattia 5,6. Uno dei vantaggi del realizzare l'intervento nel topo è che l'abbondanza di ceppi di topi transgenici disponibile può aiutare i ricercatori a determinare il ruolo di specifici componenti importanti nella creazione e la crescita di endometriosi. Un modello alternativo in cui vengono introdotti asportati frammenti umani endometriale al peritoneo di topi immunocompromessi è anche ampiamente utilizzato, ma è limitata dalla mancanza di un normale sistema immunitario che si ritiene essere importante per l'endometriosi 2,7. È importante sottolineare che il modello murino di endometriosi indotta chirurgicamente è un modello versatile che è stato utilizzato per studiare come il sistema immunitario 8, 9,10 ormoni e fattori ambientali influenzano 11,12 endometriosi così come gli effetti dell'endometriosi sulla Fertility 13 e il dolore 14.
Protocollo
1. Pianificazione per animali vivi chirurgia
- Assicurano che l'approvazione appropriato è stato ricevuto per lavorare con animali da laboratorio.
- Topi d'ordine e di almeno una settimana di ambientamento al nuovo ambiente.
- Topi di sesso femminile ospitato in assenza di esposizione ai feromoni maschili può fermare il ciclismo, un fenomeno denominato effetto Whitten 15,16. Per mantenere ciclismo topi trasferimento di urina intrisa di biancheria maschile alla gabbia donna ogni cinque giorni. In alternativa, se aperto-top si usano gabbie, posizionare la gabbia femminile tra due gabbie di maschi per tenere le femmine ciclismo regolarmente.
- Assicurarsi che i topi sono in bicicletta attraverso l'analisi citologia vaginale al giorno per almeno una settimana prima dell'intervento chirurgico (Tabella 1) 17.
- Usare una matita di cera per creare otto partizioni su un vetrino in modo che strisci vaginali da topi multiple possono essere raccolti.
- Lavare la vagina con 0,2-0,25 ml di soluzione salina normale o acqua distillata con un contagocce. Essere sure per posizionare il contagocce proprio nel orifizio vaginale, come la stimolazione del collo dell'utero con il contagocce potrebbe causare pseudogravidanza. Posizionare la lavanda vaginale sul vetrino per l'analisi dei tipi di cellule. Le diapositive possono essere letti fresco (umido) o in alternativa fissato da un certo numero di metodi ed esaminate con un microscopio a luce standard di 17.
- Raccogliere, pulire e sterilizzare tutte le attrezzature necessarie per un intervento chirurgico di successo asettica (vedere la sezione Materiali) 18.
- Preparare la soluzione buprenorfina per l'analgesia in PBS usando una tecnica sterile per fornire 0,2 mg / kg la dose finale. La concentrazione della soluzione di buprenorfina dovrebbe essere 0,0333 mg / ml, assumendo che il C57BL adulto medio / 6 del mouse pesa circa 0,025 kg e un volume di iniezione sottocutanea di 0,15 ml per il mouse. La buprenorfina può essere preparato in anticipo e memorizzati come aliquote. Si noti che la buprenorfina è una sostanza Tabella III controllato che richiedono una licenza DEA e accedere inventario dettagliato.
- Preparare PBS sterile con penicillina (100 U / ml) e streptomicina (100 mg / ml).
- Sincronizzare i cicli di estro trasferendo urina intrisa di biancheria da letto maschio alla femmina gabbie 72 ore prima dell'induzione 15.
2. Preparare l'area chirurgica per la chirurgia di animali vivi
- Preparare l'area chirurgica come descritto in precedenza 18.
- Preparare la zona di preparazione, stabilendo tagliaunghie elettrici, pomata oftalmica, e scrub chirurgico.
- Preparare l'area chirurgica mettendo una piastra elettrica calda a ricircolo di acqua nell'area chirurgica per mantenere la temperatura corporea durante l'intervento chirurgico. Posizionare un tampone sterile impermeabile sopra il pad ricircolo riscaldamento ad acqua calda. Disporre di strumenti chirurgici, suture, sterile di vetro piastra di Petri, biopsia, garza sterile, clip ferita e clip applicatore ferita sul campo sterile chirurgico.
- Preparare zona di recupero mettendo a ricircolo di pastiglie di riscaldamento ad acqua calda a metà under una gabbia vuota per consentire topi di allontanarsi dal caldo se lo si desidera.
3. Anestetizzare e preparare il mouse per un intervento chirurgico
- Registrare il peso del mouse e determinare fase estro valutando la citologia vaginale.
- Per l'induzione dell'anestesia, posizionare il mouse in una camera vuota anestesia (gabbia vuota con coperchio solidi contenenti portale per isoflurano). Accendere isoflurano non-rirespirazione anestetico e impostare il vaporizzatore per isoflurano 4% (con un tasso di flusso di ossigeno da 0,5 a 1 L / min).
- Quando il mouse è in anestesia commutare il flusso isoflurano di un cono (30-60 guaina siringa ml) e il naso del mouse luogo e la bocca nel cono sul tavolo di preparazione. Un'adeguata anestesia può essere mantenuta con una minore concentrazione di isoflurano per tutto il resto della chirurgia (~ 2,5-3,5% isoflurano). Adeguata profondità di anestesia dovrebbe essere determinata da una risposta negativa agli stimoli piedi pizzico.
- Applicare t pomata oftalmicao evitare l'essiccazione degli occhi durante l'intervento chirurgico.
- Utilizzando piccolo tagliaunghie elettrici, radere al sito chirurgico.
- Disinfettare e preparare il sito chirurgico con tre colpi alternati di macchia clorexidina e il 70% di etanolo.
- Drappo animale con un campo sterile.
4. Legatura uterina
- Fai un piccolo (~ 1 cm) incisione mediana utilizzando piccole forbici o un bisturi fine 0,5-1,0 cm rostrale per l'apertura vaginale.
- Inserire le forbici chiuse nell'apertura tale che le lame sono tra la parete del corpo e la parete addominale. Delicatamente smussato sezionare l'area intorno alla incisione lentamente aprendo e chiudendo le forbici in modo che la parete addominale è sufficientemente distaccato dalla pelle. Restanti adesioni visibile tra la parete addominale e la pelle attorno al sito incisione può essere accuratamente tagliato. Il mancato smussato adeguatamente sezionare il sito di incisione farà chiusura della parete addominale più difficile.
- F utilizzando piccoliorceps, delicatamente individuare il corno sinistro dell'utero. L'utero è dorsale per l'intestino, che è quello che si vedrà alla prima entrare nel sito di incisione. In alcuni casi è più facile individuare prima l'ovaio e il relativo cuscinetto adiposo delle ovaie. Estrarre delicatamente sul corno uterino e far scorrere una pinza aperta sotto per servire come un divaricatore. Se lo si desidera, si noti l'aspetto delle ovaie e dell'utero in questo momento per ulteriori informazioni riguardanti la fase di estro a induzione (Tabella 1).
- Far scorrere con due pezzi di 6-8 cm di 5-0 nero sutura di seta intrecciata (senza ago) sotto il corno allungato uterina.
- Legare saldamente il corno alla giunzione utero-tubual (appena caudalmente per le tube di Falloppio) e alla giunzione utero-cervicale (appena anteriore del collo dell'utero) con un nodo quadrato in ogni postazione. Lasciate le estremità del filo per il momento.
- Tagliare la parte del corno uterino tra le due legature e posizionare il tessuto in una piastra di Petri sterile di vetro Contaesaminando la ~ 100 l di PBS contenente penicillina (100 U / ml) e streptomicina (100 mg / ml). Tagliate le estremità del filo di seta scorso. Se la sutura viene sciolto o vi è il sanguinamento, trovare il ceppo e cravatta un altro nodo.
5. Preparare gli impianti endometriosici da utero asportato
- Mentre l'utero asportato viene manipolato, coprire l'addome con garza sterile e mantenere l'idratazione con PBS sterile contenente penicillina e la streptomicina, se necessario.
- Striscia asportato il corno uterino di grasso.
- Se lo si desidera, pesare asportato il corno uterino.
- Aprire il corno uterino con l'inserimento di una lama di forbici piccole (14 lunghezza della lama mm) nel lume e scorrere delicatamente le forbici lungo il corno uterino tenendo premuto il clacson con una pinza.
- Nel piatto di vetro Petri, l'uso da 2 mm biopsia per tagliare tre impianti uguali dimensioni.
6. Sutura impianti endometriosici in cavità peritoneale
- Luogo Sterilgarza posta immediatamente al di sopra del sito di incisione e completamente bagnato con PBS sterile contenente penicillina e la streptomicina.
- Con le piccole, pinze liscia dolcemente trovare il cieco e spostare rostralmente lungo l'intestino tenue. Estrarre un piccolo (cm 4-5) sezione di intestino che è almeno due arterie di distanza dal cieco e organizzare come una ventola sul pre-garza bagnata in modo che la cascata delle arterie del mesentere intestinale è chiaramente visibile. Assicurarsi di mantenere umida la intestino in ogni momento con soluzione fisiologica sterile. Nota: non utilizzare topo dai denti a forcipe durante la manipolazione del colon.
- Usa 6-0 sutura nero ethilon con un P-1, 11 mm, 3 / 8 cerchio, invertire l'ago taglio da suturare con delicatezza un impianto di un'arteria di circa 0,5 cm dal intestinale.
- Nota: Il mesentere intestinale è ricoperto da un sottile strato di peritoneo. Stare attenti a fare un passaggio pulito attraverso questo strato, mentre la sutura intorno all'arteria. Tirare sutura attraverso lentamente e con attenzione per non lacerare il peritoneo o rottural'arteria.
- Completano due nodi di un lancio ciascuno, facendo attenzione a non stringere la sutura molto difficile, in quanto ciò potrebbe causare la perdita di flusso sanguigno e conseguente necrosi dell'intestino e della morte. Tagliare la sutura entro 2 mm dell'impianto. Dell'intestino bagnato di nuovo per continuare a mantenere l'idratazione prima di passare per l'impianto successivo.
- Muovendosi in una direzione rostrale, estrarre il prossimi 3-4 centimetri di intestino e delicatamente sostituire la sezione che contiene già un impianto. Saltare una o due arterie dal sito di impianto precedente e suturare l'impianto successivo. Ripetere l'operazione per l'impianto di terzi.
- Sostituire tutte dell'intestino nella cavità addominale.
7. Sham ambulatori
- Interventi chirurgici Sham vengono eseguite utilizzando la stessa procedura della chirurgia dell'endometriosi, tranne che nessun tessuto è suturato il mesentere intestinale.
- Excise il corno sinistro dell'utero come al punto 4.
- Impianti endometriosici (punto 5) non sono preparati nella chirurgia simulata. Ilescisse corno uterino possono essere scartati o utilizzati per altri scopi se lo si desidera.
- Suture, ma non i tessuti, sono posti a circa tre arterie nella cascata delle arterie del mesentere intestinale del passaggio 6.
8. La chiusura della ferita chirurgica
- Garantire che tutti gli organi sono circa tornare alla loro posizione anatomica.
- Usa 5-0 sutura rivestito Vicryl in modo non continuo incastro punto per chiudere la parete addominale.
- Utilizzare 9 clip ferita mm a chiudere la pelle.
9. Recuperare animali
- Somministrare 0,33 mg / ml di buprenorfina a 0,15 ml/25 topo g per via sottocutanea per una dose di 0,2 mg / kg. La buprenorfina viene somministrata dopo l'intervento per evitare ulteriori depressione cardiovascolari / respiratorie che possono allungare il processo di recupero.
- Asciugare delicatamente il mouse con Kimwipes o tovaglioli di carta, se è bagnato durante l'intervento.
- Luogo lato animale ventrale verso il basso in gabbia partially in cima a un trampolino di ricircolo acqua riscaldata fino a quando l'animale è recuperato e ha riacquistato decubito sternale (entro cinque minuti come anestetico per inalazione consuma rapidamente spento).
10. Assistenza post-operatoria
- I topi devono essere osservati ogni 15 minuti fino a quando non sono in grado di mantenere il decubito sternale, poi ogni ora fino a che ritrovare il loro comportamento normale dopo l'intervento.
- Topi dovrebbe apparire normale entro le 24 ore di intervento chirurgico. I topi devono essere monitorati giorno per 7-10 giorni per segnali di ripresa e buona salute.
- Indicazioni che un animale è in cattive condizioni di salute, il dolore, l'angoscia comprendono attività ridotta, l'auto-mutilazione, l'aspetto non battuti, o la postura ricurva.
- Se un animale non sembra essere in buona salute entro le 24 ore di intervento chirurgico, o somministrare buprenorfina (0,2 mg / kg) o eutanasia degli animali. Se l'animale non migliora entro 8 ore supplementari di buprenorfina amministrazione shoul animaled eutanasia poiché necrosi intestinale è probabile.
- Rimuovere i clip ferita 7-10 giorni post-induzione.
- Continuare a monitorare ciclicità estro con l'esame di citologia vaginale per tutta la durata dell'esperimento. Sincronizzare i cicli di estro 72 ore prima collezione con il trasferimento di urina intrisa di biancheria maschile al femminile gabbie come descritto al punto 1.3.
11. Autopsia e l'escissione del tessuto
- I tempi di necroscopia dipende dalla domanda di ricerca e particolare è discusso nei risultati di rappresentanza e di discussione.
- Euthanize il mouse per asfissia di anidride carbonica.
- Raccogliere il sangue mediante puntura cardiaca utilizzando un ago di 23 gauge su una siringa 1cc (se desiderato).
- Raccogliere uno striscio vaginale citologia come descritto in precedenza per determinare fase estro, al momento della raccolta 17.
- Taglio restante corno uterino a giunzione utero-tubarica e, al collo dell'utero, togliere il grasso, pesare, e processodesiderato (vedi 11,14 e 11,15).
- Individuare i punti di sutura nero intorno le lesioni endometriosiche. Fotografare le lesioni endometriosiche intatto se lo si desidera.
- Attentamente sezionare le adesioni che circonda le lesioni endometriosiche con una forbicine e pinzette, facendo attenzione a non lancia le lesioni. Lavorare velocemente e con attenzione per evitare la degradazione dell'RNA.
- Misurare e registrare la lunghezza e la larghezza delle lesioni endometriosiche con pinze.
- Accise le lesioni endometriosiche e posto su un tovagliolo di carta inumidito con PBS. Rimuovere eventuali non endometriosica tessuto dalle lesioni. Un microscopio a dissezione di vetro o di ingrandimento supporto può essere utilizzato per aiutare nella dissezione.
- Pesare il liquido tre lesioni endometriosiche piene prima di rimuovere la sutura.
- Rimuovere delicatamente la sutura delle lesioni endometriosiche.
- Per istologia, fissate in formalina un fluido riempito lesione endometriosica per due ore, seguita da tre e mezza lavaggi minuti PBS e stoccaggio finale in etanolo al 70%. Disidratano e paraffina embed.
- Lance due delle lesioni endometriosiche. Pesare nuovamente l'operazione. Dal momento ciclico cambiamenti ormonali possono alterare la quantità di fluido cisti, questo dà una misura del tessuto umido-peso, oltre al peso della cisti più il fluido misurata in 11.10.
- Per l'isolamento dell'RNA e studi di espressione genica, immediatamente omogeneizzare una delle lesioni endometriosiche incisi (o ~ 20 mg di tessuto uterino) in soluzione di lisi vincolante e conservare a -80 ° C per le future isolamento dell'RNA con il kit RNAqueous (Ambion) o altro metodo come desiderata.
- Per l'isolamento futuro di RNA, DNA, o proteine, immediatamente snap-congelare la seconda lesione endometriosica incisi (o circa 20 mg di tessuto uterino) in azoto liquido e conservare a -80 ° C.
Rappresentante Risultati
Lesioni endometriosiche nel modello murino di endometriosi indotta chirurgicamente morfologicamente ed istologicamente simili a quelli osservati indonne. L'analisi istologica di endometriosi in donne e il modello di topo indica che le lesioni endometriosiche contengono ghiandole endometriali e stroma (Figura 2A). Lesioni endometriosiche nei topi contengono anche macrofagi carichi di emosiderina, che sono una caratteristica comune di endometriosi nelle donne (Figura 2B) 19.
Lesioni endometriosiche rimosso dai topi tre giorni post-induzione appaiono infiammate e emorragiche (Figura 3A). Dopo 2-4 settimane di lesioni endometriosiche crescita nel modello del mouse sono simil-cistica, pieno di liquido e circondato da aderenze peritoneali (Figure 3B e 3C). Rispetto al peso lesione a induzione, fluido riempito le lesioni sono state 306% e 862% più grande a uno e due mesi di post-induzione e lesioni sono stati incisi 51% e 172% più grande, rispettivamente (Figure 4A e 4B). Abbiamo ottenuto fluido coerente riempito e incisi pesi lesione endometriosica a un mese di post-induzione in cinque diversi esperimenti (Figura 5). A un mese di post-influido produzione riempito (7,44 ± 3,75 mg) e incisi (2,92 ± 1,23 mg) peso lesione endometriosica erano significativamente correlati (coefficiente di correlazione di Pearson = 0,669, p <0,001).
Età del mouse non ha influito dimensione della lesione per topi da tre a dieci mesi di età. Né il pieno di liquido o incisi peso lesioni endometriosiche a un mese di post-induzione è risultata significativamente correlata con l'età dell'animale (r = -0,136, p = 0,380 er = -0,063, p = 0,698, rispettivamente).
L'utero topo subisce cambiamenti nelle dimensioni, ritenzione di liquidi, la proliferazione cellulare e l'aspetto a causa della influenza degli ormoni steroidei durante il ciclo di estro. Abbiamo confrontato il peso lesioni endometriosiche al peso dei rimanenti corno uterino intatte dagli animali nelle diverse fasi di estro. Non abbiamo trovato una correlazione significativa tra il peso dell'utero e pieno di liquido o incisi l endometriosicapeso esion a un mese induzione post (r = -0,046, p = 0,765 er = 0,232, p = 0.155, rispettivamente).
Il pattern di espressione genica osservata nelle lesioni endometriosiche di topi rispecchia da vicino quella riportata nelle donne con la malattia 5. Da tre giorni post-induzione geni che regolano il rimodellamento della matrice extracellulare, l'adesione cellulare e l'angiogenesi sono altamente sovraregolati e molti di questi geni rimangono sovraregolati attraverso un mese di crescita.
Figure e tabelle

Figura 1. Induzione chirurgica di endometriosi da autologo trasferimento tessuto uterino nel topo. Il corno sinistro dell'utero è legatura, asportato, e aperto longitudinalmente per esporre l'endometrio. Tre 2 mm 2 biopsie vengono preparate e ciascuno è suturato alla un'arteria nella cascata arteriosa del mesente intestinalery. Di un mese di post-induzione le lesioni endometriosiche sono pieno di liquido e circondato da aderenze.
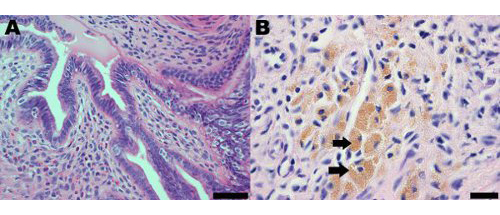
Figura 2 sezione ematossilina e eosina macchiato di una lesione dell'endometrio dal modello murino di endometriosi ad un mese di post-induzione dimostrando (A) la presenza di ghiandole endometriali e stroma;. Barra di scala = 50 micron e (B), macrofagi carichi di emosiderina, alcuni dei quali sono indicati da frecce; barra di scala = 20 micron.

Figura 3. Lesioni endometriosiche nel modello murino seguenti eutanasia, o tre giorni dopo l'induzione (A) o un mese di post-induzione (B e C).
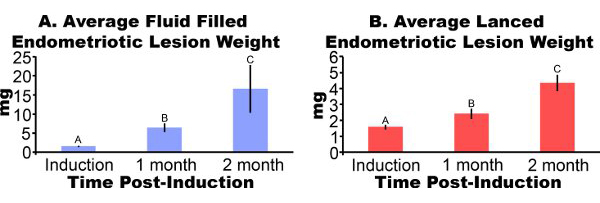
Figura 4. Lesioni endometriosiche dai topi indotta chirurgicamente di avere itdometriosis sono stati asportati e pesati uno o due mesi dopo l'induzione. I dati sono media ± SEM. I dati sono stati log trasforma e lettere diverse indicano un significato all'interno di ogni pannello da ANOVA seguito da Confronti meno unilaterale di Fisher significativi mulitple Differenza. (A) come cisti, il liquido delle lesioni endometriosiche piene (N = 10, 7 o 5 per induzione, un mese o due mesi di post-induzione, rispettivamente). (B) incisi lesioni endometriosiche (N = 10, 8 o 7 per induzione, un mese o due mesi di post-induzione rispettivamente).
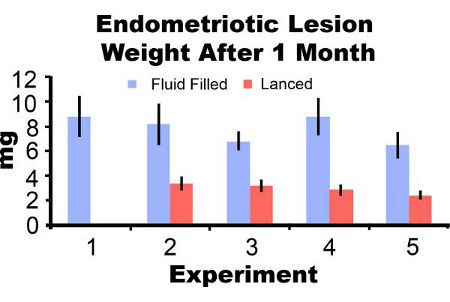
Figura 5. Lesione endometriosica peso bagnato con il liquido e incisi a un mese di post-induzione da cinque esperimenti separati. I dati sono media ± SEM. I topi N = 10, 6, 8, 7 e 7 per fluidi lesioni piene e 0, 7, 10, 8, e 8 per le lesioni incisi nell'esperimento 1, 2, 3, 4 e 5, rispettivamente.

Tabella 1. Osservazione della Fase Estrus da citologia vaginale e l'aspetto visivo delle ovaie e dell'utero e induzione.
Aspetto di ovaie e utero sarà tempo dipendente. I seguenti sono basate sul sacrificio circa 8:00 del mattino di ogni giorno del ciclo. Inoltre, le osservazioni sono soggettive e confrontando le ovaie e le corna uterine sarà una stima migliore di corna uterine solo. Queste osservazioni hanno lo scopo di integrare le informazioni ottenute dal quotidiano letture citologia vaginale.

Tabella 2. Confronto della chirurgia nel topo e nel ratto.
Access restricted. Please log in or start a trial to view this content.
Discussione
Ci sono diversi parametri critici che dovrebbero essere notato durante l'esecuzione l'induzione chirurgica di endometriosi nei topi. In primo luogo, l'endometriosi è una malattia estrogeno-dipendenti e come tale questo tipo di chirurgia deve essere eseguita nell'animale intatto o in alternativa negli animali ovariectomizzati integrato con estrogeni 20. In secondo luogo, la sutura biopsie endometriali alla cascata arteriosa deve essere eseguita con estrema cura. Abbiamo scoperto che usando sol...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Un ringraziamento speciale a Chris Kassotis e Audrey Bailey per la revisione critica di questo manoscritto e il Dr. Scott Korte, Giuseppe Beeman, Alison Curfman, Paul Kimball, Bridget Neibreggue, Jacob Redel, Amy Schroder, Maija Steinberg, e Stacey Winkeler per la loro assistenza per l'ottimizzazione di questo modello nel nostro laboratorio. Il finanziamento è stato fornito dalla formazione di Grant Clinica Biodetectives (NIH T90) (Kep), Università del Missouri Scienze della Vita Undergraduate Research Program Opportunità, MU Research Council, MU Assegni di ricerca Board e NIH R21HD056441 (SCN).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente / apparecchiatura | Azienda | Numero di catalogo | |
| Matita di cera | Pescatore | NC9954135 | |
| Vetrini | Pescatore | 12-550-433 | |
| Contagocce | Pescatore | S79383 | |
| Microscopio ottico standard per la valutazione strisci citologia vaginale | |||
| Buprenorfina HCL c3 (CARJET) 10X1ml | Butler animali Alimentazione Salute | 022891 | |
| Fosfato sterile salina tamponata (PBS) | Gibco | 14040-117 | |
| 10.000 U / ml penicillina, 10.000 mg / ml di streptomicina in 0,85% NaCl | Hyclone | SV30010 | |
| Isoflurano | AbbottAnimal Health | 05260-05 | |
| Isoflurano non rirespirazione anestetico sistema | |||
| Ricircolo di acqua calda di riscaldamento pad | |||
| 30 ml siringa guaina | Pescatore | 14-823-16G | |
| Polvere di guanti sterili libero | Fisherbrand | 19020558 | |
| Unguento oftalmico | Farmaceutica principali | 10033691 | |
| Piccolo tagliaunghie elettrici | Wahl | 9861-600 | |
| Clorexidina macchia | Pescatore | NC9863042 | |
| 70% di etanolo | |||
| Polylined campo sterile | Busse Ospedale Disposables | 696 | |
| Taglia 3 bisturi | Pescatore | 22-079-657 | |
| Numero 10 lame bisturi | Pescatore | 22-079-681 | |
| Piccole forbici chirurgiche | Roboz | RS-5850 | |
| Piccoli semi-curve seghettate forcipe | Roboz | RS-5135 | |
| 5-0 di seta nera intrecciata sutura | Ethicon | K870H | |
| Sterilizzato vetro pirex Petri | Corning | 70160-101 | |
| 2 millimetri biopsia | Miltex | 33-31 | |
| Garza sterile | Kendall | 1806 | |
| 6-0 nero ethilon sutura monofilo di nylon | Ethicon | 697G | |
| Driver ago (opzionale) | Mondo Strumenti di precisione | 500023 | |
| 5-0 undyed intrecciato rivestito vicryl sutura | Ethicon | J490G | |
| 9 millimetri Autoclip ferita clip | Becton Dickinson | 427631 | |
| Autoclip applicatore e di rimozione | Becton Dickinson | 427630 | |
| 23G ago | Becton Dickinson | 305193 | |
| 1cc siringa | Becton Dickson | 301025 | |
| 5X vetro stare ingrandimento (opzionale) | Pescatore | 14-648-23 | |
| 10% di formalina tamponata | Pescatore | SF100-4 | |
| Pinze | Roboz | RS-6466 | |
| Elaborazione / embedding cassette | Pescatore | 15-197-700A | |
| Biopsia cuscinetti in schiuma | Pescatore | 22-038-222 | |
| RNAqueous RNA Kit di isolamento | Ambion | AM1912 | |
| Azoto liquido | |||
| Snap microcentrifuga coppola tubo orizzontale | Pescatore | 02-681-240 | |
| Ketamina (opzionale) | Simga | K4138 | |
| Domitor (medetomidina cloridrato) (opzionale) | Tocris | 2023 | |
| Antisedan (atipamezolo) (opzionale) | Sigma | A9611 |
Riferimenti
- Simoens, S., Hummelshoj, L., D'Hooghe, T. Endometriosis: cost estimates and methodological perspective. Hum. Reprod. Update. 13, 395-404 (2007).
- Grummer, R. Animal models in endometriosis research. Hum. Reprod. Update. 12, 641-649 (2006).
- Vernon, M. W., Wilson, E. A. Studies on the surgical induction of endometriosis in the rat. Fertil. Steril. 44, 684-694 (1985).
- Cummings, A. M., Metcalf, J. L. Induction of endometriosis in mice: a new model sensitive to estrogen. Reprod. Toxicol. 9, 233-238 (1995).
- Pelch, K. E. Aberrant gene expression profile in a mouse model of endometriosis mirrors that observed in women. Fertil. Steril. 93, 1615-1627 (2010).
- Flores, I. Molecular profiling of experimental endometriosis identified gene expression patterns in common with human disease. Fertil. Steril. 87, 1180-1199 (2007).
- Giudice, L. C., Kao, L. C. Endometriosis. Lancet. 364, 1789-1799 (2004).
- Lin, Y. J., Lai, L. ei, Y, H., Wing, L. Y. Neutrophils and macrophages promote angiogenesis in the early stage of endometriosis in a mouse model. Endocrinology. 147, 1278-1286 (2006).
- Fang, Z. Intact progesterone receptors are essential to counteract the proliferative effect of estradiol in a genetically engineered mouse model of endometriosis. Fertil. Steril. 82, 673-678 (2004).
- Fang, Z. Genetic or enzymatic disruption of aromatase inhibits the growth of ectopic uterine tissue. J. Clin. Endocrinol. Metab. 87, 3460-3466 (2002).
- Cummings, A. M., Metcalf, J. L., Birnbaum, L. Promotion of endometriosis by 2,3,7,8-tetrachlorodibenzo-p-dioxin in rats and mice: time-dose dependence and species comparison. Toxicol. Appl. Pharmacol. 138, 131-139 (1996).
- Foster, W. G. Morphologic characteristics of endometriosis in the mouse model: application to toxicology. Can. J. Physiol. Pharmacol. 75, 1188-1196 (1997).
- Cummings, A. M., Metcalf, J. L. Effect of surgically induced endometriosis on pregnancy and effect of pregnancy and lactation on endometriosis in mice. Proc. Soc. Exp. Biol. Med. 212, 332-337 (1996).
- Lu, Y., Nie, J., Liu, X., Zheng, Y., Guo, S. W. Trichostatin A, a histone deacetylase inhibitor, reduces lesion growth and hyperalgesia in experimentally induced endometriosis in mice. Hum. Reprod. 25, 1014-1025 (2010).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J. Endocrinol. 13, 399-404 (1956).
- Whitten, W. K., Bronson, F. H., Greenstein, J. A. Estrus-inducing pheromone of male mice: transport by movement of air. Science. 161, 584-585 (1968).
- Goldman, J. M., Murr, A. S., Cooper, R. L. The rodent estrous cycle: characterization of vaginal cytology and its utility in toxicological studies. Birth. Defects. Res. B. Dev. Reprod. Toxicol. 80, 84-97 (2007).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of Rodent Surgery for the New Surgeon. J. Vis. Exp. (47), e2586-e2586 (2011).
- Moen, M. H., Halvorsen, T. B. Histologic confirmation of endometriosis in different peritoneal lesions. Acta. Obstet. Gynecol. Scand. 71, 337-342 (1992).
- Cummings, A. M. Methoxychlor as a model for environmental estrogens. Crit. Rev. Toxicol. 27, 367-379 (1997).
- Fowler, R. E., Edwards, R. G. Induction of superovulation and pregnancy in mature mice by gonadotrophins. J. Endocrinol. 15, 374-384 (1957).
- Wilson, E. D., Zarrow, M. X. Comparison of superovulation in the immature mouse and rat. J. Reprod. Fertil. 3, 148-158 (1962).
- Lee, B., Du, H., Taylor, H. S. Experimental murine endometriosis induces DNA methylation and altered gene expression in eutopic endometrium. Biol. Reprod. 80, 79-85 (2009).
- Somigliana, E. Endometrial ability to implant in ectopic sites can be prevented by interleukin-12 in a murine model of endometriosis. Hum. Reprod. 14, 2944-2950 (1999).
- Hirata, T. Development of an experimental model of endometriosis using mice that ubiquitously express green fluorescent protein. Hum. Reprod. 20, 2092-2096 (2005).
- Story, L., Kennedy, S. Animal studies in endometriosis: a review. Ilar. J. 45, 132-138 (2004).
- Cummings, A. M., Hedge, J. M., Birnbaum, L. S. Effect of prenatal exposure to TCDD on the promotion of endometriotic lesion growth by TCDD in adult female rats and mice. Toxicol. Sci. 52, 45-49 (1999).
- Cummings, A. M., Metcalf, J. L. Effects of estrogen, progesterone, and methoxychlor on surgically induced endometriosis in rats. Fundam. Appl. Toxicol. 27, 287-290 (1995).
- Sharpe-Timms, K. L. Endometriotic lesions synthesize and secrete a haptoglobin-like protein. Biol. Reprod. 58, 988-994 (1998).
- Yavuz, E., Oktem, M., Esinler, I., Toru, S. A., Zeyneloglu, H. B. Genistein causes regression of endometriotic implants in the rat model. Fertil. Steril. 88, 1129-1134 (2007).
- Dmitrieva, N. Endocannabinoid involvement in endometriosis. Pain. 151, 703-710 (2010).
- Efstathiou, J. A. Nonsteroidal antiinflammatory drugs differentially suppress endometriosis in a murine model. Fertil. Steril. 83, 171-181 (2005).
- Becker, C. M. Endostatin inhibits the growth of endometriotic lesions but does not affect fertility. Fertil. Steril. 84, Suppl 2. 1144-1155 (2005).
- Becker, C. M. Short synthetic endostatin peptides inhibit endothelial migration in vitro and endometriosis in a mouse model. Fertil. Steril. 85, 71-77 (2006).
- Sharpe-Timms, K. L. Using rats as a research model for the study of endometriosis. Ann. N.Y. Acad. Sci. 955, 318-327 (2002).
- Stilley, J. A., Woods-Marshall, R., Sutovsky, M., Sutovsky, P., Sharpe-Timms, K. L. Reduced Fecundity in Female Rats with Surgically Induced Endometriosis and in Their Daughters: A Potential Role for Tissue Inhibitors of Metalloproteinase 1. Biol. Reprod. 80, (2009).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon