Method Article
Impianto intracranica con 3D successivi In Vivo Bioluminescent Imaging dei gliomi Murine
In questo articolo
Riepilogo
Impianto intracranico di GL261 cellule in C57BL / 6 topi produce gliomi maligni che ricapitolano molte delle caratteristiche del glioblastoma multiforme umano. Abbiamo usato GL261 cellule che esprimono stabilmente luciferasi per permetterci di utilizzare In vivo Imaging per seguire la progressione del tumore. L'intervento e 3D In vivo Immagini sono dimostrati.
Abstract
Il mouse glioma 261 (GL261) è riconosciuto come un sistema di modello in vivo che riassume molte delle caratteristiche del glioblastoma multiforme umano (GBM). La linea cellulare è stata originariamente indotta da iniezione intracranica di 3-metil-cholantrene in un C57BL / 6 ceppo di topi singenici 1; quindi, immunologicamente competenti C57BL / 6 topi possono essere utilizzati. Mentre usiamo GL261, il seguente protocollo può essere utilizzato per l'impianto e il monitoraggio di qualsiasi modello intracranica del tumore del mouse. GL261 cellule sono state progettate per esprimere stabilmente lucciola luciferasi (GL261-luc). Abbiamo anche creato la più brillante GL261-luc2 linea cellulare di trasfezione stabile del gene luc2 espressa dal promotore CMV. Topi C57BL/6-cBrd/cBrd/Cr (variante albino di C57BL / 6) dal National Cancer Institute, Frederick, MD sono stati utilizzati per eliminare l'attenuazione della luce causata da pelle nera e pelliccia. Con l'uso di C57BL albino / 6 topi, imaging in vivo utilizzando la Spectrum IVIS in vivo iml'invecchiamento del sistema è possibile dal giorno di impianto (Caliper Life Sciences, Hopkinton, MA). Il GL261 e GL261-luc-luc2 linee cellulari hanno mostrato lo stesso comportamento in vivo come genitori GL261 cellule. Alcune delle caratteristiche istologiche condivise presenti nel GBM umano e questo modello di topo sono: necrosi tumorale, pseudopalisades, neovascolarizzazione, invasione, ipercellularità, e l'infiammazione 1.
Prima di animali l'impianto sono stati anestetizzati con una iniezione intraperitoneale di ketamina (50 mg / kg), xilazina (5 mg / kg) e buprenorfina (0,05 mg / kg), inserito in un apparato stereotassico e una incisione è stata fatta con un bisturi il linea mediana del cranio. Un burrhole è stata fatta posteriore 0,1 millimetri al bregma e 2,3 millimetri a destra della linea mediana. Un ago è stato inserito ad una profondità di 0.4mm 3mm ritirato ad una profondità di 2,6 mm. Due ml di GL261-luc o GL261-luc2 cellule (10 7 cellule / ml) sono state infuse nel corso di 3 minuti. Il burrhole è stato chiusobonewax e con l'incisione è stata suturata.
In seguito l'impianto stereotassico le cellule bioluminescenti sono rilevabili dal giorno di impianto e il tumore può essere analizzato utilizzando la funzione di ricostruzione delle immagini 3D dello strumento Spectrum IVIS. Gli animali ricevono una iniezione sottocutanea di 150 mg luciferina / kg di peso corporeo 20 minuti prima di imaging. Massa tumorale è quantificato mediante bioluminescenza medio del tumore nel tempo. Portatori di tumore nei topi sono stati osservati quotidianamente per valutare la morbilità e sono stati sacrificati quando uno o più dei seguenti sintomi sono presenti: letargia, incapacità di deambulare, la postura ingobbita, il mancato sposo, anoressia con conseguente perdita> 10% del peso. I tumori sono stati evidenti in tutti gli animali della necroscopia.
Protocollo
1. Colture Cellulari
- Il GL26 linea cellulare è stata ottenuta dalla divisione del trattamento del cancro e diagnosi (DCTD) National Cancer Institute (NCI), Frederick, MD. Per facilitare una misurazione quantitativa del tumore tasso di crescita GL261 cellule bioluminescenti sono stati fatti utilizzando il Lentiphos HT System (Clontech Laboratories, Inc., Mountain View, CA) con le Lenti X-HT Packaging Mix (Clontech Laboratories, Inc.) e la FUW- GL plasmide (un dono generoso dal laboratorio di JB Rubin, MD, PhD). Le cellule sono state mantenute nel terreno di Dulbecco Modified Eagle (DMEM) con il 10% tetraciclina senza siero di vitello fetale (FCS; Clontech Laboratories, Inc.). GL261 cellule sono state anche trasfettate stabilmente con il luc2 gene che codifica utilizzando il pGL4.51 [luc2 / CMV / Neo] condizioni vettore (Promega Corp., Madison, WI) e FuGENE 6 Transfection Reagent (Roche Applied Science, Indianapolis, IN), a seguito specificato il produttore. Il gene luc2 codone è una versione ottimizzata di lucciola Luciferasé, che fornisce una potenza significativamente più alta luce rispetto il gene normale luc. Trasfettate stabile sono stati selezionati e mantenuti in mezzi di DMEM contenente 10% FCS e 100 mcg / ml Geneticin (G418, Invitrogen Corp., Carlsbad, CA).
- Prima dell'impianto le cellule coltivate vengono raccolte trypsinzation, lavato una volta in DMEM senza siero e risospese in DMEM senza siero ad una concentrazione di 1 x 10 7 cellule / ml.
2. Chirurgia Setup 2
- Un ambiente sterile è mantenuto per tutto l'intervento, compresi tutti gli strumenti chirurgici, forniture, guanti, tende, ecc.
- Dieci C57BL/6-cBrd/cBrd/Cr settimana di vita (albino C57BL / 6) i topi vengono acquistati dal National Cancer Institute Programma di Produzione Animale Federico e utilizzato in un peso medio di 20 grammi (NCI, Frederick, MD).
- Gli animali sono anestetizzati mediante iniezione intraperitoneale di xylazina (5 mg / kg), ketamina (50 mg / kg) e buprenorfina (0,05 mg / kg). Apizzicare e viene fatto per garantire che l'animale è adeguatamente anestetizzato prima della chirurgia è iniziata. Movimento (anche se lieve) di qualsiasi parte dell'animale è un'indicazione di una riduzione del livello di anestesia. Animale è immediatamente dato un ulteriore 3,3 mg / kg xylazina e 26,6 mg / kg di ketamina. La temperatura corporea viene mantenuta con una lampada e le medicazioni sterili che copre il corpo.
- Una volta che l'animale è adeguatamente anestetizzato, vengono immessi sul letto imbottito del castelletto stereotassica (Modello 900 Piccoli Animali Stereotassica, David Kopf Instruments) [Figura 1].
- Una piccola quantità (1 / 4 di pollice) di unguento oftalmico lubrificante AKWA Tears è applicato sulla cornea.
- L'animale è fissato nella cornice stereotassica aprendo la bocca dell'animale (mettendo il dito indice e il pollice attorno mandibola dell'animale) e facendo scorrere la parte superiore dei denti anteriori nella rientranza nel frame stereotassico. Il morsetto è serrato per assicurare la testa dell'animale in cuffia facendo in modo che esimotesta e si allinea e gli occhi sono centrate, facendo attenzione però a non esercitare una forza eccessiva sulla testa dell'animale.
- L'O 2 tubo è registrata in basso vicino narici dell'animale. Portata di ossigeno è di 0,5 l / min.
- La parte bassa della schiena e la coda è registrato fino al letto stereotassica facendo attenzione a non scendere a compromessi respirazione.
- Il sito di incisione chirurgica è rasata. Povidine-Iodio Stick tamponi sono usati per lavare la zona tra gli occhi di tornare nella zona tra le orecchie con lo iodio, assicurandosi che lo iodio non cola negli occhi dell'animale.
- Le cellule sono preparati per l'impianto poco prima della chirurgia e sono periodicamente miscelata per assicurare la non regolare.
- A 10 microlitri, 50 millimetri Mondiale strumento di precisione (WPI), Sarasota, FL, siringa con 26 gauge smussati viene caricato con l'inoculo delle cellule. Se le cellule sembrano essere insieme a blocchi può essere necessario per ricaricare la siringa.
- La siringa da 10 microlitri viene poi inserito nel UMP3-1 UltramicroPump micro iniettore (WPI, Sarasota, FL).
3. Impianto intracranica 2
- L'incisione cutanea è realizzato con un 15 bisturi dimensioni e pinze dentate. Una incisione 10-15 mm realizzato longitudinalmente dalla tra gli occhi dell'animale, verso le orecchie dell'animale esponendo il bregma (giunzione delle suture sagittale e coronale alla sommità del cranio). Assicurati di identificare correttamente il bregma perché può essere facilmente confusa con la zona del seno, che è distale rispetto al bregma [Figura 2].
- Dopo che l'animale viene sedato riceve una iniezione intra-incisionale dello 0,25% (2,5 mg / ml) bupivacaina.
- Un burrhole è 0,1 millimetri posteriore al bregma e 2,3 mm a destra della linea mediana lentamente ruotando a 16 gauge 1 ½ pollici aghi a mano, applicando una pressione poco a che l'ago mentre torsione fino a quando è penetrato il cranio e il cervello è esposto.
- L'ago della siringa è spostato verso il basso in posizione usando il microdrive stesiringa titolare reotactic fino a toccare solo la superficie del cervello. Da questa posizione, l'ago viene avanzato nel cervello ad una profondità di 3 mm e conservati in luogo per 3 minuti.
- L'ago viene ritirato 0,4 millimetri fino a una profondità totale di 2,6 mm sotto la superficie del cervello, creando una piccola tasca in cui le celle sono da infondere. E 'facoltativo, a questo punto di prendere una immagine a raggi X dell'ago nell'animale per assicurare il corretto posizionamento e la profondità.
- La sospensione cellulare è infusione di 3 minuti con l'iniettore micro impostato su un volume di 2000 nL (2 mL) con una velocità di infusione di 667 nL / minuto.
- L'ago viene lasciato in sede per 2 minuti per evitare perdite dal sito di infusione.
- L'ago è lentamente ritirato completamente.
- Il burrhole è pieno di cera ossea con un dissettore Penfield.
- L'incisione viene suturata con un 4-0 (1,5 Metrico) Vicryl sutura garantire l'assenza di grandi spazi vuoti vengono lasciati nella pelle. Vicryl è un materiale di sutura che si dissolvonos, e quindi punti di sutura non hanno bisogno di essere rimosso quando l'incisione è guarito.
- Dopo l'intervento gli animali siano posti in una gabbia sotto una lampada riscaldante che è posizionata all'altezza necessaria per riscaldare la superficie inferiore della gabbia a 30 ° C. Quando gli animali sono completamente svegli (come giudicato dal movimento normale in gabbia) sono tornati alla casa del gruppo. Ibuprofene orale è aggiunta l'acqua da bere per 5 giorni dopo l'intervento. 100 mg di ibuprofene per bambini (100mg/5ml) viene aggiunto a una normale bottiglia di acqua roditori 473 ml. Gli animali vengono osservati ogni giorno e fotografato e pesato ogni 3 giorni. Due settimane dopo l'impianto di osservazione è aumentato di due volte al giorno. Gli animali vengono eutanasia quando mostrano segni di declino della salute che comprende la postura ingobbita, mobilità ridotta e visibile perdita di peso corporeo (≥ 20%). Questi sintomi sono la risposta pubblicata sul tumore e riproducibile appaiono circa 1 giorno prima della morte a causa del tumore.
4. In vivo Imaging bioluminescenza 3
- Avviare il [immagine vivente] software.
- Il sistema viene inizializzato IVIS Imaging facendo clic su [inizializzare il sistema IVIS] sul lato in basso a destra del pannello di controllo.
- Selezionare il [luminescenti] Modalità Imaging sul lato superiore sinistro del pannello di controllo.
- Per determinare il momento ottimale di immagini dopo l'iniezione luciferina uno studio cinetico è necessario [Figura 3]. Questa descrizione è per la lucciola luciferasi;
- Iniettare 10μl / g di peso corporeo di D-luciferina lucciola (15mg/ml in PBS; Caliper Life Sciences Catalogo XR-1001 o un prodotto simile di un altro fornitore) nel animale, come descritto di seguito.
- Attendere 3 minuti, quindi anestetizzare il mouse mettendolo nella camera a gas anestesia (2% di gas isoflurano in O 2).
- Spegnere il gas anestesia alla camera e aprire la valvola di anestesia e il vuoto al collettore IVIS. Collocare immediatamente l'animale sedatosulla piattaforma di imaging temperatura controllata, assicurandosi narice del mouse è posizionato correttamente nel collettore di anestesia del gas. La prima immagine dovrebbe essere preso circa 5 minuti dopo l'iniezione luciferina. Fino a 5 animali possono essere esposte in una sola volta nello strumento Spectrum IVIS. Se meno di 5 animali devono essere ripreso, è possibile collegare il collettore non utilizzati (s) per risparmiare sul gas isoflurano.
- Continuare a prendere le immagini ogni 3 minuti creando una sequenza fino a un'ora per generare una curva cinetica di espressione luciferina.
- Fare clic su [Imposta sequenza] pulsante nel pannello di controllo.
- L'editor sequenza appare.
- Nel pannello di controllo, specificare le impostazioni per la prima immagine della sequenza bioluminescenti.
- Si consiglia di iniziare con la categorizzazione di media.
- Si consiglia inoltre di Auto-esposizione per determinare il tempo ottimale di esposizione.
- Selezionare il [Ritardo] pulsante nell'editor di sequenza una° specificare un tempo di ritardo di 3 minuti tra ogni acquisizione.
- Fare clic su [Aggiungi] nell'editor di sequenza. Parametri di acquisizione sono poi aggiunte alla tabella.
- Ripetere il passo 4 per ogni immagine della sequenza.
- Una volta che la curva è stabilito, il tempo di imaging ottimale può essere determinato tracciando la potenza del segnale (intensità) in funzione del tempo. Animali immagine al momento della più alta in vivo fotone contare per ottenere il segnale più forte e più preciso.
- Primi esperimenti utilizzati intraperitoneale (ip) l'inserimento di luciferina, tuttavia, le iniezioni ip occasionalmente portato a risultati intermittenti mostrando poco o nessun bioluminescenza nel tumore. Abbiamo ipotizzato che la mancanza occasionale casuale di segnale era dovuta alla consegna del luciferina per l'intestino o altri organi interni. Abbiamo quindi iniziato a usare per via sottocutanea (sc) luciferina iniezioni e vide la riproducibilità di imaging maggiore [Figura 3].
- Ventiminuti dopo l'iniezione sottocutanea, gli animali sono anestetizzati mettendoli in una camera con 2% di gas isoflurano in O 2 fino a che non rispondono.
- L'animale anestetizzato (s) vengono spostati nella camera di imaging. Unguento oftalmico deve essere utilizzato per lo studio cinetico a causa della lunghezza di imaging. Non è necessario per le procedure di imaging, perché sono di breve durata.
- L'immagine viene acquisita a binning media con un tempo di esposizione di 5 minuti. L'opzione di acquisizione automatica può anche essere usato.
- Se il segnale è satura e / o di svenimento in binning media, tempo di binning o l'esposizione può essere regolata.
- Il file di programma e commenti immagini successive sono salvate nella directory del computer dell'utente.
5. 3D Imaging 3
- Fare clic su [Imaging guidata] nella [Setup Sequenza] finestra del pannello di controllo.
- Selezionare il [bioluminescenza] modalità di imaging sullo schermo immagini di inizio e guidata click [Avanti].
- Nella "bioluminescenza - DLIT" finestra della procedura guidata di immagini, selezionare [Firefly] giornalista sonda. L'emissione / eccitazione del selezionati spettro fonte lucciola apparirà con le sei selezioni di filtro corrispondenti da acquisire.
- L'ultima schermata apparirà con scelte predefinite che includono i parametri di acquisizione automatica dell'esposizione e una di Campo visivo C. Le impostazioni predefinite funzionano molto bene, tuttavia, queste impostazioni possono essere modificate se necessario.
- Fare clic su [Avanti] e la finestra di editor sequenza verrà popolata con la sequenza di sei regioni spettrali a 20 nm filtri largo (560 nm, 580 nm, 600 nm, 620 nm, 640 nm e 660 nm). Premete [Acquisisci Sequenza]. Il primo filtro (560 nm) conterrà un modello strutturato luce utilizzando un galvanometro laser per stabilire topografia della superficie.
- Selezionare il menu [topografia della superficie] nella tavolozza degli strumenti. Lisciatura della superficie può essere applicato a tenere conto di qualsiasi angoli acuti creati durante il processo di ricostruzione. Illisciatura di default bassa è consigliata.
- Fare clic su [Crea] e la finestra di analisi di tomografia apparirà. Disegnare una casella di ritaglio che comprende l'intero animale e quindi fare clic su [Avanti].
- Lo strumento della soglia apparirà come una maschera viola la regione selezionata. La maschera deve essere impostato automaticamente per abbinare la fotografia dell'animale. Se necessario, regolare la soglia della maschera per adattarsi in modo più appropriato la sagoma dell'animale.
- Fare clic su [Fine] e la rete apparirà ricostruito. La ricostruzione può quindi essere salvate nella scheda dei risultati.
- In seguito alla creazione della topografia della superficie dell'animale, procedere alla [DLIT Ricostruzione 3D] discesa sulla tavolozza degli strumenti.
- Sotto la [Analizza] scheda selezionare tutte e sei le lunghezze d'onda per eseguire la ricostruzione. Deselezionare le immagini che ha dato pixel saturi o conta di sotto di 600. Lasciare le impostazioni in [Parametri] scheda di default.
- Nella scheda [Proprietà], "Muscle" dovrebbe essere indicato come la scelta di default perProprietà del tessuto r, e "Firefly" dovrebbe essere elencato come lo spettro di sorgente.
- Fare clic su [Ricostruire] sotto la scheda Analizza, e la ricostruzione 3D della superficie dell'animale e la ricostruzione corrispondente della sorgente di segnale dovrebbe apparire [Figura 4].
- Per determinare la posizione e l'intensità del segnale, selezionare il pulsante voxel sulla scheda 3D Strumenti della tavolozza degli strumenti.
- Disegnare un quadrato attorno a tutti voxel visualizzati e le misure di flusso totale è mostrato nella parte inferiore della scheda del volume.
- Fare clic su [Centro di Massa] per identificare la posizione del segnale del voxel selezionato. Coronali, sagittali e fette transassiale dell'animale apparirà e utilizzando [Display cursore di misura] la distanza dalla superficie dell'animale al centro voxel può essere misurata.
- Si prega di fare riferimento al manuale utente Living Image Software per ulteriori informazioni su co-registrazione di atlanti organi e altre funzioni avanzate.
6. Dati AANALISI 3
- Dopo che l'immagine viene acquisita e salvata, accedere al file del programma cliccando sul pulsante [Sfoglia] e selezionando il file.
- Le informazioni sull'immagine si possono trovare sotto [Vedi] → [Informazioni immagine].
- L'intensità del segnale può essere quantificato, selezionando la regione di interesse (ROI) [ROI Strumenti] pulsante. Assicurarsi che l'immagine viene analizzata sotto il modo [Photon] selezionando "Photon" sul menu a tendina in alto a sinistra del pannello di controllo dell'immagine.
- Selezionare il [Misurazione del ROI] pulsante dal menu a discesa "Tipo" lista. Selezionare la forma ROI di interesse; opzioni includono Cerchio, Quadrato, e o Griglia. Coprono tutte le aree di intensità sull'immagine acquisita.
- La posizione di ROI è impostato trascinando la selezione della forma del ROI per la regione contenente il segnale bioluminescente.
- L'intensità di segnale del ROI è calcolato facendo clic su [Misura] pulsante. L'etichetta ROI mostra l'intensità. ROI possono essere gestiti e salvati USIng il software immagine vivente.
7. Rappresentante dei risultati:
L'impianto di cellule di successo è evidente quando le cellule impiantate sono rilevabili utilizzando lo spettro IVIS il giorno dell'intervento. Entrambi GL261 e GL261-luc-luc2 cellule sono rilevabili, tuttavia, il gene luc2 fornirà un livello superiore di bioluminescenza [Figura 5]. Le immagini scattate subito dopo l'impianto potrebbe avere non specifici segnali sulle zampe dell'animale e il naso che deve essere ignorato come sfondo. Segnale situato presso il sito dell'impianto è reale e il segnale aumenterà con il tempo [Fig. 6]. La diminuzione dell'intensità del segnale il giorno 6 è riproducibile e molto probabilmente a causa della perdita di tumore prendere per alcune delle cellule impiantate. Misurazioni quantitative della massa tumorale sono riproducibili in quanto dovrebbe aumentare costantemente fino a quando l'animale soccombe infine alla malattia. Tuttavia, le curve di crescita dipenderà in larga misura lo stato delle cellule impiantate, e inevitabile o var minori ESPONSABILITÀ nella procedura di impianto. Il nostro laboratorio ha scelto di animali immagine impiantati ogni tre giorni.
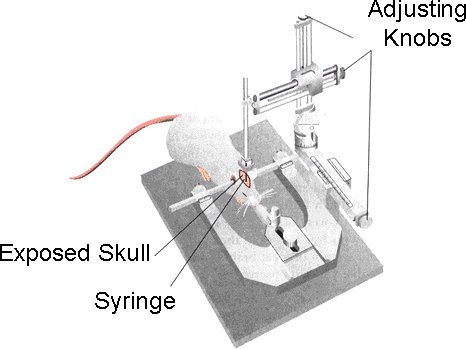
Figura 1. Dopo il mouse viene adeguatamente anestetizzato, si colloca nella cornice stereotassica. La testa del mouse è assicurato utilizzando la pinza bocca.

Figura 2. Dopo la pelle è aperto principali attrazioni anatomiche sono identificate tra cui includono il bregma, le suture coronali e sagittali. Il burrhole è 2,3 millimetri alla destra del bregma lentamente ruotando a 16 gauge 1 ½ ago pollici con una piccola quantità di pressione fino a quando il cranio è penetrato e il cervello è esposto.
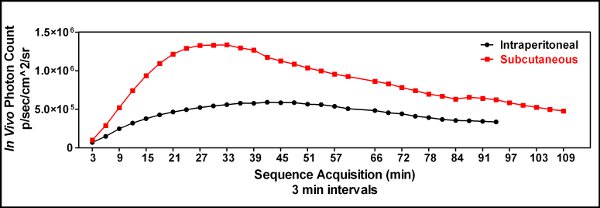
Figura 3. Un confronto cinetica del sottocutaneo (iles/ftp_upload/3403/3403fig3_1.jpg "alt =" Figure3.1 "/>) rispetto intraperitoneale (  ) Iniezione luciferina è stata effettuata per dimostrare l'utilità di una iniezione sottocutanea luciferina e per individuare il momento ottimale per l'immagine dopo la somministrazione luciferina. Tre minuti dopo la luciferina è stato iniettato il topo è stato sedato, collocato nello strumento Spectrum IVIS e ripreso ogni 3 minuti fino a un'ora e ogni 6 minuti dopo che per generare una curva cinetica di bioluminescenza. Ciò ha dimostrato che una via sottocutanea luciferina amministrazione è stata superiore a un'iniezione intraperitoneale nelle nostre mani, e che il tempo ottimale per l'immagine degli animali è stato di circa 25 minuti dopo l'iniezione luciferina quando GL261-luc cellule sono state utilizzate.
) Iniezione luciferina è stata effettuata per dimostrare l'utilità di una iniezione sottocutanea luciferina e per individuare il momento ottimale per l'immagine dopo la somministrazione luciferina. Tre minuti dopo la luciferina è stato iniettato il topo è stato sedato, collocato nello strumento Spectrum IVIS e ripreso ogni 3 minuti fino a un'ora e ogni 6 minuti dopo che per generare una curva cinetica di bioluminescenza. Ciò ha dimostrato che una via sottocutanea luciferina amministrazione è stata superiore a un'iniezione intraperitoneale nelle nostre mani, e che il tempo ottimale per l'immagine degli animali è stato di circa 25 minuti dopo l'iniezione luciferina quando GL261-luc cellule sono state utilizzate.
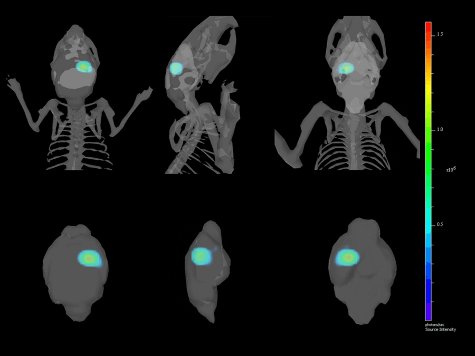
Viste Figura 4. Multiple di un 3-Dimensional reconstruction di impianto intracranico di GL261-luc2 cellule co-registrati con lo scheletro e il cervello del mouse.
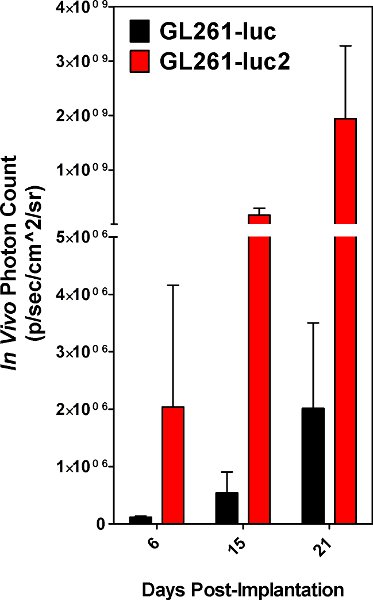
Figura 5. Conteggi Photon ottenuto da tumori derivi dalla GL261-luc cellule vs GL261-luc2 cellule. I risultati sono una media di 5 animali.

Figura 6. Grafico di GL261-luc crescita delle cellule tumorali in un C57BL albino / 6 del mouse. Bioluminescenza è stata misurata ogni 3 giorni e tracciati come nella conta vivo fotone contro giorno dopo l'impianto. Fotografie mostrano bioluminescenza in vari momenti. La colorazione è un'indicazione di bioluminescenza (intensità dei pixel), che è relativo al numero delle cellule tumorali (barra di colore viene mostrato a destra). Dopo che l'animale ceduto alla malattia del cervello è stato dissezionato e luciferina è stato aggiunto localmente per ottenere il imag ex vivoe mostrato nella figura inserto.
Discussione
L'inoculo delle cellule è infuso ad una profondità di 2,6 mm dalla superficie del cervello dopo la creazione di una tasca 0,4 mm. Per garantire il corretto posizionamento e la profondità dell'ago una radiografia può essere assunto con un C-Arm o simili a raggi X dispositivo di intensificazione dell'immagine, ma questo è opzionale. Le complicanze della chirurgia possono insorgere se l'animale non è adeguatamente sedato, a quel punto l'animale può muoversi durante l'infusione delle cellule. Questo può causare perdite di miscela di cellule o sanguinamento da pista ago. Perdita di cellule causa la crescita ectopica di cellule tumorali. E 'anche importante non forare il ventricolo, che può essere fatto se l'è fatta burrhole mediale a mm 2,3 descritte nel protocollo 4. Il corretto posizionamento della diffusione ago e cellulari è stato testato infondendo un mouse con 2 colorante blu di metilene microlitri e sezionare il tessuto cerebrale per verificare la posizione del colorante infuso.
In questo protocollo abbiamo utilizzato lo spettro IVIS imaging in vivo del sistema e tha Living software Image (v 4.0) progettato per essere utilizzato con questo strumento. (Caliper Life Sciences). Qualsiasi paragonabile sistema di imaging in vivo e gli strumenti di analisi delle immagini può essere usata per ottenere risultati simili. Questi sistemi offrono alcuni vantaggi rispetto ai tradizionali risonanza magnetica (MRI) per seguire la crescita di un tumore sperimentale intracranica. Il più evidente è il costo relativo dei 2 strumenti - Macchine per animali RM sono molto più costosi e di solito richiedono i servizi di un tecnico specializzato risonanza magnetica. Imaging in vivo, come ciò che è stato qui descritto può essere effettuata dall'utente finale. I dati bioluminescenza è quantitativa, mentre la quantificazione dei dati MRI è in termini di tempo e un po 'inesatto. Inoltre, le immagini MRI mostrano edema e infiammazione, oltre alle cellule tumorali e può essere difficile separare l'effetto del trattamento di tumore. Per queste ragioni ottenere accurate misurazioni volumetriche del tumore in crescita può essere una sfida. Bioluminescenza richiede ATP, Quindi solo le cellule tumorali vive contribuire ai dati dimensioni del tumore. Nonostante questo, ci sono alcuni vantaggi a risonanza magnetica se una macchina è disponibile. Le cellule non devono essere etichettati con un pennarello bioluminescenti per essere visualizzate alla risonanza magnetica. La possibilità di visualizzare peri-tumorali edema può essere un vantaggio per alcuni protocolli sperimentali. Un punto di forza di entrambe le tecnologie è che l'utilizzo di uno non esclude l'uso degli altri, quindi i dati possono essere ottenuti sulla crescita del tumore così come la presenza di peri-tumorali edema e infiammazione dello stesso animale, quando le due tecnologie sono disponibili al ricercatore.
Divulgazioni
Accesso gratuito a questo articolo è sponsorizzato da Caliper Life Sciences.
Riconoscimenti
Vorremmo ringraziare il dottor Joshua B. Rubin per il generoso dono dei plasmidi per il sistema di lentivirus e Mahil Rao per il suggerimento utile per la preparazione della GL261-luc cellule.
Ringraziamo gli studenti Sostenere Tumore Brain Research (SSBTR), The Barrow Neurological Fondazione e la Fondazione Wallace per il loro generoso sostegno.
Esperimenti su animali sono stati eseguiti secondo le linee guida e regolamenti stabiliti dalla cura degli animali e del Comitato Istituzionale uso dell'Ospedale San Giuseppe e Medical Center.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente o fornitura | Azienda | Numero di catalogo | Commenti |
| GL261-luc2 Bioware Ultra | Caliper Life Sciences | GL261-luc2 | |
| Dulbecco modificato (DMEM) | Invitrogen | 10313039 | |
| Geneticin (G418) | Gibco (Invitrogen) | 11811-023 | |
| Di siero fetale bovino (FCS) | Invitrogen | 26140079 | |
| Soluzione salina tamponata con fosfato (PBS) | Invitrogen | 70011044 | |
| C57BL/6-cBrd/cBrd/Cr Mice | NCI-Frederick | ||
| AKWA Tears lubrificante unguento oftalmico | Akorn Inc | 17478-062-35 | |
| Ketaset (cloridrato di ketamina) | Wyeth | 11570775 | |
| Sedazine (cloridrato xilazina) | Wyeth | 10031894 | |
| Piccoli Animali Strumento Stereotassica | Kopf Instruments | 900 | |
| UltraMicroPump con SYS-Micro4 controller | Mondo Strumenti di precisione | UMP3-1 | Se non disponibile, è possibile infondere manualmente |
| Siringa 10μl con 26 gauge smussato aghi | Mondo Strumenti di precisione | SGE010RNS | |
| Adison Pinza | Mondo Strumenti di precisione | 500092 | |
| Penfield Dissector | Codman | 65-1015 | |
| 16g 1 ½ di precisione Glide Needle | Beckton, Dickinson and Company (BD) | 305198 | |
| Lama maniglia chirurgico | BD | 371030 | |
| Taglia 15 Lama | BD | 371315 | |
| 4-0 sutura Vicryl | Ethicon | VCP496G | |
| Bone Wax | Medline | DYNJBW25 | |
| Povidine Iodio-tampone Sticks | Medline | MD93901 | |
| D-Luciferin Potassio Salt | Caliper Life Sciences | 122796 | |
| Foraneo (isoflurano) | Baxter | 1001936060 | |
| OPMI Pentero Microscopio | Carl Zeiss, Inc. | Ogni microscopio operatorio sarà sufficiente | |
| Xenogen Spectrum IVIS con sistema di anestesia opzionale | Caliper Life Sciences |
Riferimenti
- Candolfi, M. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathological characterization and tumor progression. J Neurooncol. 85, 133-148 (2007).
- Stafford, P., Abdelwahab, M. G., do, K. i. m., Preul, Y., Rho, M. C., M, J., Scheck, A. C. The ketogenic diet reverses gene expression patterns and redudes reactive oxygen species levels when used as an adjuvant therapy for glioma. Nutr Metab. 7, (2010).
- Caliper Life Sciences, Inc. . Living Image Software Version 4.0. VivoVision Systems. , (2010).
- Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Jouanneau, E., Poujol, D., Gulia, S., Le, M. I., Blay, J. Y., Belin, M. F. Dendritic cells are essential for priming but inefficient for boosting antitumour immune response in an orthotopic murine glioma model. Cancer Immunol Immunother. 55, 254-267 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon